ALK 阳性大B 细胞淋巴瘤临床病理特征与鉴别诊断分析
李晓琴 何欣 康雅琼 罗雁 宋丽娟 李婷玉 王登科 李晓梅 刘芳 张小芸
甘肃省肿瘤医院,甘肃 兰州 730050
间变性淋巴瘤激酶阳性大B 细胞淋巴瘤(anaplastic lymphoma kinase-positive large B-cell lymphoma,ALK+LBCL)是一种罕见并具特征性形态学、免疫组化和遗传学特征的淋巴瘤。1997 年 Delsol 等[1]首次报道,目前国内外报道100 余例[2]。本文回顾性分析我院诊断1 例ALK+LBCL 患者临床病理资料并分析相关文献,探讨其发病原因、临床病理学特征、免疫表型、分子遗传学及鉴别诊断,以提高对该病的认识。
1 材料与方法
1.1 临床资料 患者男性,31 岁,因“双侧颈部多发肿物1 年余”收住入院。患者于1 年前无明显诱因发现右侧下颌区“拇指”大小肿物,肿物无疼痛并未给予治疗,自行消退。于1 月前再次发现左颌下区多发肿物,局部压痛(+),且逐渐增大。查体:左侧下颌至颈部中下段可触及多个质韧结节,大小约2~3cm,质中,活动度尚可,与周围组织界限清楚,有融合迹象。手术完整切除左侧下颌区肿块。术后病理诊断ALK+LBCL,临床分期ⅢA期,辅以化疗,随访13 个月,患者病情稳定。
1.2 方法 手术切除肿块经10%中性福尔马林固定,多切面取材,常规脱水,石蜡包埋,HE 染色,光镜观察。免疫组化采用EnVision 两步法染色,一抗,LCA、CD38、CD138、Mum-1、EMA、BcL-2、ALK、CD10、Oct-2、Bob-1、lambda、CD20、Pax-5、CD79a、CD3、CD2、Bcl-6、CD34、CD43、CD7、CD8、CD4、CD30、CD56 和 kappa 均购自迈新公司,显色试剂盒及二抗均购自罗氏公司。
1.3 FISH 检测 采用ALK 断裂基因和EML4-ALK融合基因检测、BCL2 融合基因、Bcl-6 和 C-myc 分离基因检测,试剂盒均购自广州安必平公司。
1.4 EBER 检测 采用原位杂交反义探针的Epstein-Barr 病毒(EBV)编码的 RNA(EBER)。
2 结果
2.1 眼观 左侧下颌区淋巴结多枚,直径1.2~2.4cm,表面呈多结节状,似有包膜,切面灰白、灰褐,质稍韧。
2.2 镜检 正常淋巴结结构破坏,瘤细胞弥漫/窦内生长,呈巢片状或黏附性生长(图1),肿瘤细胞中等偏大,由较一致的免疫母细胞样细胞/浆细胞样细胞组成(图2);免疫母细胞样细胞核大圆形,核膜清晰,染色质凝集,呈细颗粒状,具有明显单一中位大核仁,胞质丰富,嗜碱性/嗜双色性;浆母细胞体积较大,核大、居中或偏位,染色质呈细颗粒状、疏松,核仁明显,胞质嗜碱性,部分嗜双色;可见不典型的多核瘤巨细胞。
2.3 免疫表型 ALK 表达胞浆内颗粒状阳性(图3),且肿瘤细胞 LCA、CD138(图 4)、上皮膜抗原(EMA)、Mum-1、Oct-2、Bob-1 和 lambda 表达水平较高,Ki-67增殖指数也较高;相反,肿瘤细胞B 细胞标志物CD20(图 3)、Pax-5 和 CD79a 表达呈阴性。此外,对 CD3、CD2、Bcl-6、CD34、CD43、CD7、CD8、CD4、CD30、CD56和kappa 的检测均为阴性。
2.4 FISH 法结果 发现ALK(图5)基因断裂和EML4-ALK(图 6)融合基因,BcL2 融合基因、BcL-6 分离基因和C-myc 分离基因均阴性;EBER 检测阴性。
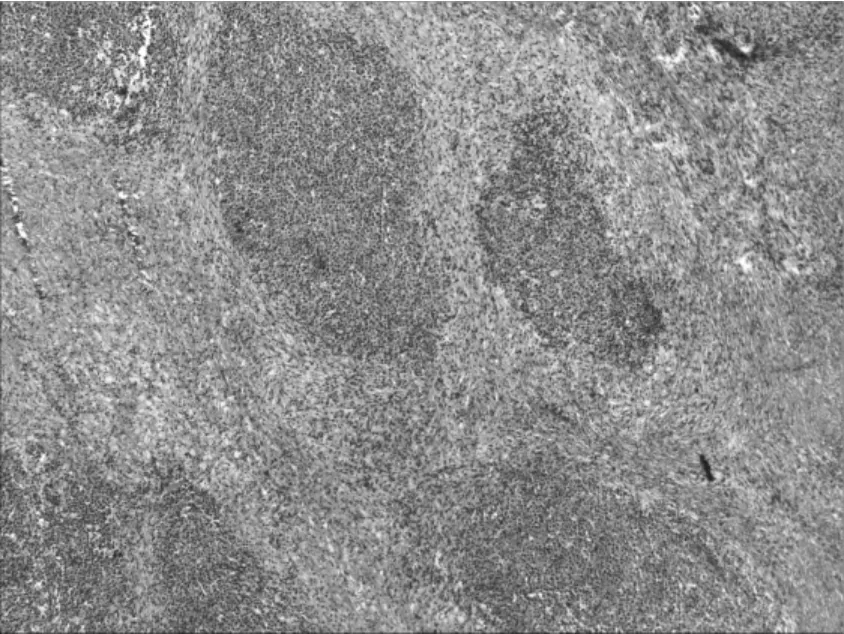
图 1 HE 染色

图2 HE 染色

图3 免疫组化染色(EnVision 法)
2.5 病理诊断 ALK 阳性大B 细胞淋巴瘤。
3 讨论

图4 免疫组化染色(EnVision 法)
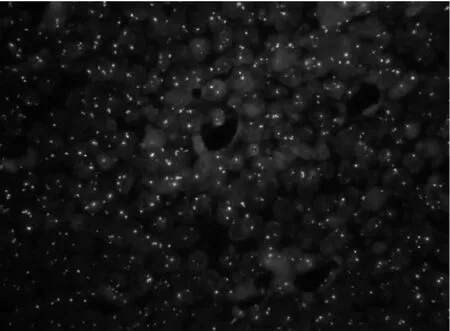
图5 基因检测(FISH 法)

图6 基因检测(FISH 法)
ALK+LBCL 是弥漫性大 B 细胞淋巴瘤(DLBCL)罕见的侵袭性亚型,具有特征性的ALK 重排和蛋白表达,染色体易位t(2;17)(p23;q23)是本病最常见的细胞遗传学异常,该易位导致CLTC(clathrin)和ALK 基因融合。ALK+LBCL 最初是由Delsol 等人于1997 年根据7 例病例报道,并于2008 年被WHO 正式定义为一种新的淋巴瘤亚型。
3.1 发病原因 ALK+LBCL 的发病机制尚不清楚。多项研究表明ALK 融合基因在ALK+LBCL 发病机制中起着重要作用,ALK 重排产生具有组成型酪氨酸激酶活性的融合蛋白,如CLTC-ALK、NPM1-ALK、SQSTM1-ALK 或SEC31A-ALK 等,该蛋白激活多个下游途径,其中之一是STAT3 信号的激活。Valera A[3]等发现STAT3 在ALK+LBCL 病例中高度磷酸化,表明该途径可能在这些淋巴瘤的发病机制中起重要作用。此外STAT3 还调控许多参与肿瘤细胞增殖的蛋白,包括MYC,并认为持续激活STAT3 可能是促进MYC 在该肿瘤中表达的另一种机制[3]。也有学者[4]认为 ALK 嵌合蛋白可独立于配体结合而诱导ALK 酪氨酸激酶的激活,随后激活下游信号蛋白,最终导致淋巴瘤形成。
3.2 临床表现 此病发生于任何年龄,平均年龄和中位年龄分别为38.4 岁和35 岁[4],文献报道中青年男性好发(男女比为3.5∶1)。病变主要累及颈部和纵隔淋巴结,但也可累及结外其他部位,包括卵巢、鼻咽、胃肠道、舌、脑、肝、骨、脾等;该肿瘤占弥漫大B 细胞淋巴瘤<1%[5],发现时多为晚期,是一种侵袭性疾病,病程进展快,预后较差,大多数患者在两年内死亡,五年总生存率(OS)为34%,中位生存期为1.83 年;在Ⅲ/Ⅳ期患者中,5 年OS 仅为8%。但Ⅰ/Ⅱ期患者的总生存率明显提高,分别为76%和66%[4]。虽然多数患者表现为进展期(Ⅲ或Ⅳ期),但很少累及骨髓。本例为男性患者(进展期),年龄31 岁,原发左颌下区淋巴结,未侵犯骨髓,患者年龄、性别、病变部位、临床分期、发病情况等均与文献报道相似。
3.3 病理组织学特点 该例正常淋巴结结构破坏,瘤细胞弥漫/窦内生长,呈巢、片状或黏附性生长,肿瘤细胞中等偏大,由较一致的免疫母细胞样细胞/浆细胞样细胞组成,免疫母细胞样细胞核大圆形,核膜清晰,染色质凝集,呈细颗粒状,具有明显单一中位大核仁,胞质丰富,嗜碱性/嗜双色性;浆母细胞体积大,核大、居中或偏位,染色质呈细颗粒状、疏松,核仁明显,胞质嗜碱性或嗜双色性;可见不典型的多核瘤巨细胞。因该肿瘤呈巢状、窦性分布,且缺乏T 细胞和大多数B 细胞标志物的表达,有时与转移性癌难以分辨,易混淆,特别是EMA、CK 阳性,更易造成误诊。
该肿瘤具有独特免疫组化表型特征,通常缺乏B细胞 CD20、Pax5、CD79α 及 T 细胞 CD3 和 CD5 的表达,但至少表达一种终末B 细胞分化标记,如CD138、CD38 和 Ig(通常为 IgA,偶见 IgG),或表达 MUM1 以及 Oct-1、Bob-1,有时也可表达 CD4 和 CD57,此外,肿瘤细胞中上皮膜抗原(EMA)和CK 也可出现不同程度表达,ALK 呈强阳性。值得注意的是,该肿瘤细胞ALK呈颗粒状细胞质染色(GCS)模式,这与间变性大细胞淋巴瘤(ALCL)的胞质和/或核模式特征不同。有文献报道,BOB1 和OCT2 是识别 ALK+LBCL 非常敏感的标记物,几乎所有ALK+LBCL 中BOB1 和OCT2 均为阳性[4]。此外文献报道显示,ALK+LBCL 未发现 EB 病毒感染[6],且肿瘤细胞Ki-67 有较高的增殖指数。
ALK 是一种酪氨酸激酶受体,属于胰岛素受体超家族。ALK 基因位于2p23 号染色体上,正常情况下,ALK 在淋巴样细胞中不表达。研究表明ALK+LBCL 中最常见的细胞遗传学异常是染色体易位t(2;17)(p23;q23),这导致 2p23 染色体处的ALK 基因与 17q23 处的网格蛋白基因(CLTC)融合[7]。由于CLTC 编码参与胞吞活性的被膜囊泡蛋白,携带CLTC-ALK 易位的淋巴瘤细胞表现出独特的细胞质颗粒状ALK 染色模式。本次报道与多数文献报道一致,为颗粒状胞质染色。少数病例胞核和胞质着色,与t(2;5)(p23;q35)染色体易位形成NPM-ALK 融合基因相关,呈现出间变大细胞淋巴瘤的遗传学特点。但是ALK 蛋白染色方式与染色体易位不具有绝对相关性,Lee 等[8]研究发现1 例ALK+LBCL 患者 5’-ALK 基因缺失,提示 ALK 基因可能涉及不同类型的细胞遗传学异常;也有学者发现[9],伴有CLTC-ALK 融合基因的ALK+LBCL 可以仅出现胞质染色,提示可能存在新的未知的ALK 染色体易位模式。此外,NPM1-ALK 和 SQSTM1-ALK、SEC31AALK、ALK 基因 3’端插入到 4 号染色体 q22-24 之间,也已在ALK+LBCL 中描述。
由于ALK 阳性的LBCL 较ALK 阴性的DLBCL更具侵袭性,且与常规治疗相比预后较差,因此研究人员一直在寻找治疗这种疾病的新方法;Cerchietti 等[10]首次建立了CLTC-ALK 阳性的LBCL 细胞系和移植瘤小鼠。在小鼠体内的研究表明,CLTC-ALK 阳性的B细胞淋巴瘤对ALK 抑制剂反应良好。随后Sara Redaelli又报道了11 例ALK 阳性淋巴瘤患者对细胞毒治疗[11]产生了耐药性,并推荐用250 mg 克唑替尼来治疗ALK+LBCL。Wass 等[12]报道了一例克唑替尼治疗原发性难治性ALK+LBCL 病例,患者PR 恢原,但由于克唑替尼耐药性,病情迅速复发。虽然患者缓解时间较短,但克唑替尼对ALK+LBCL 仍有一定疗效,为进一步的临床治疗研究提供了依据。相继Sakamoto 等[6]也报道了ALK+LBCL 伴 EML4-ALK 融合基因,并将 ALK 染色分为胞质着色和非胞质着色,研究发现非胞质着色与总生存期较差密切相关,并认为与患者年龄和临床分期差异更显著,由此可见ALK 蛋白表达与ALK 融合基因相关。由于ALK+LBCL 患者存在ALK 易位和融合,尤其是伴EML4-ALK 融合基因,因此小分子ALK 抑制物克唑替尼,将为ALK+LBCL 患者提供新的治疗方向。
本例ALK+LBCL 经FISH 检测发现其存在ALK染色体易位基因,并存在EML4-ALK 融合基因,结合ALK 蛋白表达为典型的胞质内颗粒状染色,提示可能携带t(2;17)(p23;q23)/CLTC-ALK。同时对该例也进行了BcL2 融合基因、Bcl-6 和C-myc 分离基因的检测,均阴性;本例结合典型的免疫表型、ALK 断裂基因和EML4-ALK 融合基因的FISH 检测,较易确诊。
3.4 鉴别诊断 (1)ALK+的间变性大细胞淋巴瘤:均可出现肿瘤细胞大,胞质丰富,核仁明显,呈浆母细胞样及窦性生长的方式。尤其裸细胞型ALCL 也可出现T、B 细胞抗原的丢失,故极易误诊。但ALCL 通常CD30强阳性,ALK 蛋白多呈胞核和胞质着色,并表达细胞毒颗粒蛋白,有助于鉴别。(2)浆母细胞性淋巴瘤大部分发生在HIV 感染患者的口腔,与免疫缺陷有关,1/3 病例发生在口腔以外的部位,73%EBV 检测阳性,但ALK阴性,易于鉴别。(3)原发渗出性淋巴瘤和HHV8+大B细胞淋巴瘤几乎只发生在HIV+的患者中,且肿瘤细胞通常CD45、CD30 阳性,且临床表现具有特征性,在大多数病例中发现EBV 感染,且ALK 阴性;而ALK+LBCL 发生在免疫功能正常的患者中,与EBV 或HHV8感染无关,故易于鉴别。(4)浆母细胞型的浆细胞瘤与ALK+LBCL 相比,该病变在淋巴结内很少发生,且ALK阴性,可鉴别。(5)DLBCL,NOS(免疫母细胞变型)强表达 B 细胞标记(CD20、CD79a 和PAX5),不表达 ALK,易于鉴别。(6)转移性癌:该肿瘤细胞可呈巢、团状分布,核仁明显,且免疫组化EMA 常常阳性,故易误诊为转移癌,但其一般不表达ALK,可鉴别。(7)上皮样恶性黑色素瘤:肿瘤细胞失黏附,胞核圆形,核仁大居中,免疫组化标记 S-100、SOX-10、Mela-A、HMB-45 均阳性,故易鉴别。
综上所述,ALK+LBCL 是DLBCL 的罕见独立亚型,易与其他肿瘤混淆,导致误诊,掌握其独特的组织病理学、免疫表型和细胞遗传学特征,有助于对该病的认识和准确诊断。

