神经干细胞对大鼠抑郁症模型中海马神经元修复的影响
张燕 姚露 江龙委 伍小勇
1.东部战区总医院,江苏 南京 210002;2.无锡联勤保障中心药品仪器监督检验站,江苏 南京 210002
抑郁症是一种常见精神疾病。临床上以明显而持久的心境低落为主要表现,并伴有运动迟滞。随着现代生活节奏加快,社会压力增大,其发病率逐年上升,在发达国家其患病率已跃居第一位[1]。目前认为抑郁症是单胺类神经递质及其受体、HPA 轴功能失调、免疫因素等多因素综合作用结果[2-3]。
抑郁症发病机制复杂,难以开展针对性地治疗。临床治疗主要有以下途径:(1)药物治疗。目前一线用药主要是选择性5-HT 再摄取抑制剂(如氟西汀)[4]。(2)社会心理治疗,主要改变患者不适当的认知或思考习惯[5]。(3)电休克疗法(ECT),以一定量的电流通过大脑,引起意识丧失和痉挛发作,可迅速缓解病情[6]。(4)中医药治疗[7]。
近年来影像学研究发现,海马体损伤是多数抑郁症患者的共同表现[8]。海马是边缘系统的重要组成部分,而边缘系统具有调节内脏功能活动和情绪反应的双重功能,因此能否通过修复海马神经元来治疗抑郁成为研究热点。海马主要由海马回和齿状回组成,齿状回内存在神经干细胞且可终身产生新的神经元。神经干细胞通常具备四个特性:自我更新、增殖分裂、多潜能性、应激能力。神经干细胞受到刺激经不对称分裂成为神经干细胞和祖细胞,祖细胞最终分化成为神经元或神经胶质细胞,整合到齿状回的颗粒细胞层,从而具备突触传递功能。在大鼠慢性不可预见性应激(CUMS)抑郁症模型研究中发现,海马锥体细胞形态不规则,数量减少,排列疏松不齐,齿状回苔藓纤维末梢突触小泡聚集在激活的突触带附近,存在耗损现象[9]。
基于已有的报道,本研究小组建立CUMS 大鼠抑郁症模型,体外回输神经干细胞,研究神经干细胞对大鼠抑郁症的干预作用,寻找更有效的抗抑郁途径。
1 材料与方法
1.1 实验动物 选用清洁级Wistar 大鼠(雄性)50 只,体重(200±20)g,购自扬州大学比较医学中心,动物合格证号(201401142)。
1.2 主要试剂及仪器 试剂:氟西汀(苏州礼来制药有限公司,国药准字:J20030017);蔗糖(上海源叶生物科技公司,S11055);Anti-Nestin antibody(Abcam,ab6142),HiScriPtⅡQ RT SuPerMix for qPCR(Vazyme,R222-01),苏木素伊红(HE)染色试剂盒(Beyotime,C0105),DMEM/F12(Gibco,11330032)。仪器:分光光度计(日本SHIMAZDUUV-2540);高速冷冻离心机(德国eppendorf,5024R);台式恒温振荡器(中国上海精宏实验设备有限公司,THZ-312);脱色摇床(中国江苏金坛市正基仪器厂,HY-4);分析天平(德国 Sartorius,BL310/BL21S);组织匀浆器(中国海门爱苯德,2mL);涡旋振荡器(中国海门其林贝尔,XW-80A);移液器(德国eppendorf,2.5/10/200/1000μL);荧光定量 PCR 仪(ABI 7500)。
1.3 实验方法
1.3.1 CUMS 大鼠抑郁症模型的建立。采用Willner等[10]提出的抑郁动物模型的标准进行建立。Wistar大鼠共50 只,其中10 只大鼠合笼饲养为空白组,其余40 只大鼠采取孤养进行造模。造模组按照以下应激方式在28d 内:禁食不禁水24h;禁水不禁食24h;4℃游泳5min;夹尾1min(止血钳距尾根1cm);束缚应激 2h;40℃环境 5min;潮湿垫料、鼠笼倾斜(45°)24h;悬吊5min;明暗颠倒24h。每日采用1 种刺激,每种刺激平均被采用2 次,每种刺激不能连续出现。分别在0、7、14、21、28 天记录每只大鼠体重。
1.3.2 行为学测定。①分别在 0、7、14、21、28 天给予所有大鼠1 瓶纯水和1 瓶2%蔗糖水,均为50g,大鼠自由饮用60min 后移走两瓶水并分别称重。记录每只动物的总液体消耗、糖水消耗、纯水消耗。计算糖水偏好(糖水偏好=糖水消耗/总液体消耗×100%)。②旷场实验(Open-field)设备为 80cm×80cm×40cm 光洁敞箱,底面平均划分为25 个等边方格,内面用黑漆涂满,置于安静的房间内。分别在 0、7、14、21、28 天将大鼠置于中心方格内,观察大鼠行为学,如5min 内穿越格数、后肢直立次数。穿越1 格计为1 分,后肢直立1 次计为1 分。
1.3.3 神经干细胞的分离、培养。①怀孕11.5~13d 雌大鼠引颈处死,打开腹腔取出胎鼠,分离海马组织并剪碎,透明质酸酶、胶原酶消化,原代接种。②神经干细胞的传代:当神经干细胞长至80%后,按照1∶4 进行传代。
1.3.4 神经干细胞的鉴定。①收集神经干细胞;②接种于0.1%明胶包被;③4%多聚甲醛固定;④PBS 清洗3次;⑤封1h 5%FBS 液;⑥一抗4℃孵育过夜;⑦FITC标记的二抗室温避光孵育4h;⑧光显微镜观察。
1.4 大鼠给药方法 21 天将造模组大鼠进行随机分组,分别为模型组,氟西汀组,神经干细胞组,阴性对照组,每组10 只。模型组:22 天给予氟西汀组等体积的生理盐水灌胃,连续7 天;氟西汀组:22 天给予氟西汀灌胃 2mg/kg,连续 7 天;神经干细胞组:22 天,接受脑室内神经干细胞移植(10μL 细胞悬液:1.0×105细胞悬浮于 10μL 生理盐水);阴性对照组:22 天,接受脑室内注射10μL 生理盐水。
1.5 海马组织HE 染色及神经相关因子表达测定 29天,处死大鼠,取海马组织。HE 染色观察海马细胞形态学变化。RT-PCR 检测海马组织脑源性神经营养因子(BDNF)、环磷腺苷效应元件结合蛋白(CREB)、细胞外调节蛋白激酶-42(ERK-42)、细胞外调节蛋白激酶-44(ERK-44)神经因子表达。
1.6 统计学方法 采用SPSS18.0 软件进行统计学处理,数据以表示,采用 t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 神经干细胞鉴定 神经干细胞在显微镜下呈球形悬浮生长,经鉴定nestin 蛋白表达阳性(见图1),且在一定的条件下能分化成神经元细胞、星形角质细胞和少突胶质细胞,符合神经干细胞的特征。
2.2 造模前后及治疗后大鼠的体重变化 造模21 天,与空白组比较,造模组体重明显下降(P<0.05)。28 天氟西汀组和神经干细胞组经治疗7 天后,两组大鼠体重相较于模型组均显著性升高(P<0.05)。见图2。
2.3 造模前后及治疗后大鼠的糖水偏好变化 造模21 天,造模组大鼠糖水偏好度明显低于空白组(P<0.01)。28 天,氟西汀组与神经干细胞组糖水偏好度相较于模型组均显著性升高(P<0.05)。见图3。
2.4 造模前后及治疗后大鼠的垂直运动次数变化 造模21 天,造模各组垂直运动次数较空白组显著性降低(P<0.01)。28 天,神经干细胞组大鼠垂直运动次数相较于模型组显著性升高(P<0.05),且改善情况明显高于氟西汀组(P<0.01)。见图 4。

图1 神经干细胞形态

图2 造模前后及治疗后大鼠的体重变化
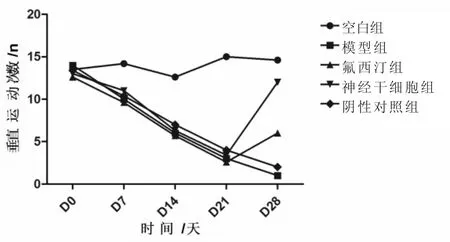
图4 造模前后及治疗后大鼠的垂直运动次数变化
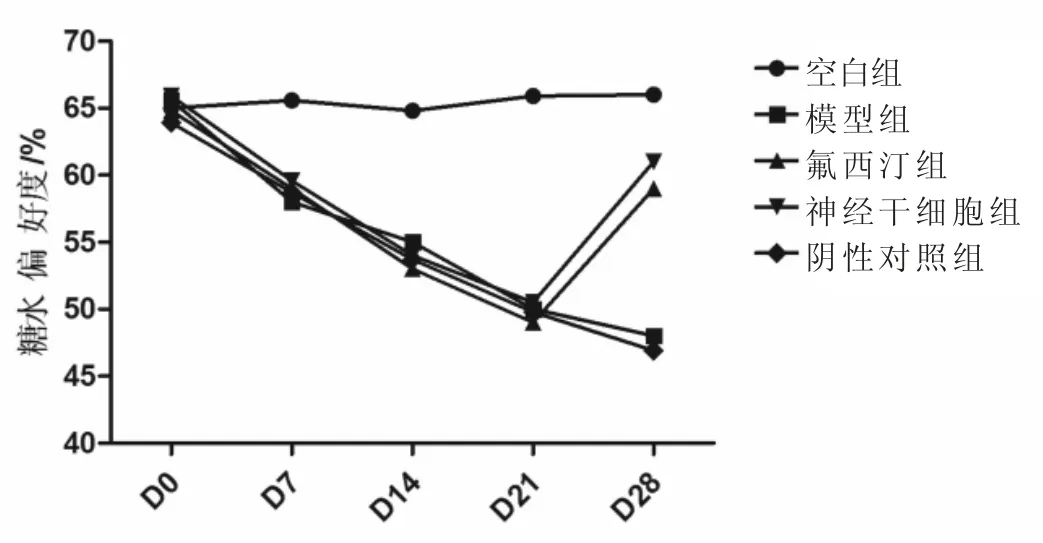
图3 造模前后及治疗后大鼠的糖水偏爱度变化

图5 造模前后及治疗后大鼠的水平运动次数变化
2.5 造模前后及治疗后大鼠的水平运动次数变化 造模21 天,造模各组水平运动次数均明显低于空白组(P<0.05)。28 天,神经干细胞组和氟西汀组水平运动次数均明显高于模型组(P<0.01),且神经干细胞组改善情况明显高于氟西汀组(P<0.05)。见图5。
2.6 治疗后各组海马组织HE 染色情况 模型组海马区HE 染色图,表现为锥体细胞排列紊乱、层次不清。多数锥体细胞形态不规则,细胞核固缩。白质血管周围间隙增大,呈轻度血管性水肿。部分血管周围有红细胞,疑为漏出性出血。神经干细胞组HE 染色图,锥体细胞排列整齐,层次清楚,锥体细胞核大而圆,核仁明显、数目多。细胞无变性、坏死,无增生。白质无水肿。氟西汀组也有一定海马修复作用,但不如神经干细胞组。见图6。
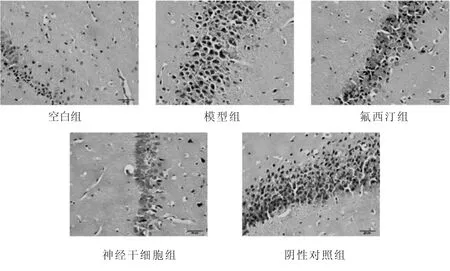
图6 治疗后各组海马组织HE 染色情况
2.7 治疗后各组神经相关因子的表达 造模后,模型组 BDNF、CREB、ERK-42、ERK-44 因子表达均显著低于空白组(P<0.01),阴性对照组及氟西汀组经治疗后无明显改善(P>0.05)。相较于模型组,神经干细胞组BDNF、CREB、ERK-42、ERK-44 的表达均明显升高(P<0.05)。见图 7。
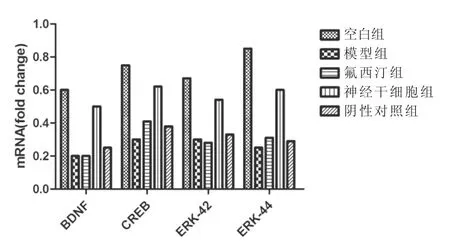
图7 治疗后神经相关因子的变化
3 讨论
抑郁症和其他神经性疾病比如癫痫、中风等一样都是由神经系统受损或其功能紊乱引起的。大多数抑郁症产生的原因,是神经递质的不平衡—也就是在大脑中传递信号的细胞发生了功能紊乱而无法准确传递信号物质。
抑郁症形成过程中存在神经元萎缩、再生受损以及凋亡的可塑性变化。有研究表明,CUMS 致大鼠抑郁行为可能与神经元氧化-抗氧化系统失衡,自由基生成增加,由此致海马神经元受损和脑源性神经营养因子(BDNF)表达减少有关,而这些损伤与抑郁症的发生密切相关[11-12]。环磷酸腺苷反应元件蛋白(cAMP-response element binding protein,CREB)是广泛存在于神经细胞核内的一种转录因子,具有激活BDNF 作用。研究证实海马和额叶部位CREB 磷酸化水平可能与应激导致的情绪精神障碍发生机制相关[13]。研究发现,ERK1/2信号通路对调节神经细胞的生长、分化和存活起关键作用。当受到应激、炎症、生长因子等细胞外信号刺激后信号通路被激活,转位至细胞核,调节核转录因子CREB 的活性,参与细胞增殖与分化。慢性应激刺激导致抑郁模型大鼠海马区ERK 蛋白表达下降,进一步证实ERK 与抑郁症的发病密切相关[14]。本实验结果提示,大鼠CUMS 抑郁症模型海马区的BDNF、CREB、ERK-42、ERK-44 表达量均明显低于空白组(P<0.01)。在海马区给予神经干细胞治疗后,大鼠海马区的BDNF、CREB、ERK-42、ERK-44 表达量较模型组显著升高(P<0.05),说明神经干细胞可提高神经相关因子表达,从而修复受损的海马神经元,达到治疗抑郁症的目的。
海马损伤是抑郁症中枢神经系统的主要病理表现,它与以下途径亢进有关,即下丘脑-腺垂体-肾上腺轴-谷氨酸-N-甲基-D-天冬氨酸受体-一氧化氮,并且该途径能够抑制海马神经干细胞的增殖分化,导致海马自身修复能力降低,进而引起海马萎缩[15]。相关文献报道成人脑细胞中神经干细胞(neural stem cell,NSCs)的增殖可以产生功能性的神经元,也就是说神经系统的损伤可以通过大脑中内源性NSCs 的治疗得到改善[16]。以上研究结果表明,抑郁症的发生与海马神经元受损有关,促进海马神经干细胞的增殖分化对抑郁症的治疗至关重要。本研究HE 染色结果提示,大鼠脑部局部注射NSCs 可改善海马损伤,从而减轻神经系统损伤。
神经干细胞具有高度的自我更新能力、低免疫原性、多潜能分化、迁移功能及良好的组织融合性等特性[17-18]。虽然这类细胞终身存在,但限于绝对数量和局部微环境,损伤神经组织自我修复作用微乎其微。现有的研究证实,外源性的NSCs 移植是治疗神经系统疾病最具前景的治疗方法之一。于立坚等人[19]通过对小鼠脑损伤模型进行了研究,探讨神经干细胞裂解液的无细胞滤液(cell-free filtrate of neural stem cell lysates,FNSCL)脑室内注射促进谷氨酸盐诱导的成年小鼠兴奋性神经元损伤修复的可能性。结果显示,无论是神经干细胞裂解液无细胞滤液脑室内注射还是神经干细胞脑室内移植都同样能促进谷氨酸盐诱导的成年小鼠兴奋性神经元损伤的修复。Moriyama 等[20]研究表明NSCs 移植能增加体内BDNF、ERK 及 CREB 表达,改善脑缺血后抑郁症状。Tfilin 等[21]的研究发现,间充质干细胞注射至大鼠体内后能移植至同侧海马齿状回,并促进该区域神经发生,并改善大鼠抑郁行为。本研究结果提示,大鼠在接受神经干细胞治疗后,体重较模型组显著性升高,行为学指标糖水偏好度、垂直运动次数、水平运动次数较模型组均有明显改善。此结果说明局部注射神经干细胞可改善大鼠的抑郁行为。
随着神经元再生调节机制研究的不断深入,为进一步探讨抑郁症的发生机制以及发展新型抗抑郁治疗药物提供了新的思路与视角,并且NSCs 的增殖及分化能力使利用神经干细胞替代多种损伤和退行性变的组织细胞的治疗成为可能。本研究通过对应激性大鼠抑郁症模型海马神经元修复治疗,探索NSCs 治疗应激性抑郁症的有效性及临床可行性。

