烯丙基硼试剂与醛高选择性合成γ-丁内酯
沈 娅, 石 艳, 吴其旭, 李有桂, 罗云飞
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
烯丙基硼试剂是绿色无毒的烯丙基金属试剂[1],已有许多烯丙基硼试剂作为商业试剂使用[2-3]。近年来,烯丙基硼试剂广泛应用于天然产物和药物分子的合成中[4],如强生制药公司用手性1-萘基酮与烯丙基硼酸频哪醇酯进行烯丙基化,合成出新的抗结核药物(R207910)[5]。α-支链的手性烯丙基硼试剂在与醛发生烯丙基加成时,硼基连接的手性碳可以完美地将烯丙基硼的手性过剩率传递至产物,因此该类试剂在γ-丁内酯合成中的应用具有潜在的巨大价值。
五元环的γ-丁内酯是众多天然产物以及药物有机分子的结构骨架。在化工、香料、医学和药学领域发挥着重要作用。例如,Paraconicacids[6]是一种重要的五元环内酯,具有抗肿瘤和抗生素的生物活性。五元环内酯的合成方法主要包括:Bode和Glorius研究出用杂环卡宾催化α,β-不饱和醛的反应,这是一种有效的合成得γ-丁内酯结构的方法[7-8];Kitamura课题组利用手性膦配体对内消旋酸酐进行铑催化氢化反应,构建γ-丁内酯的结构[9];Vinogradov及其同事研究了基于RuCl3-(R)-BINAP-HCl的催化条件下,对γ-酮酯对映选择性氢化一步合成各种γ-取代的丁内酯的合成方法[10]。
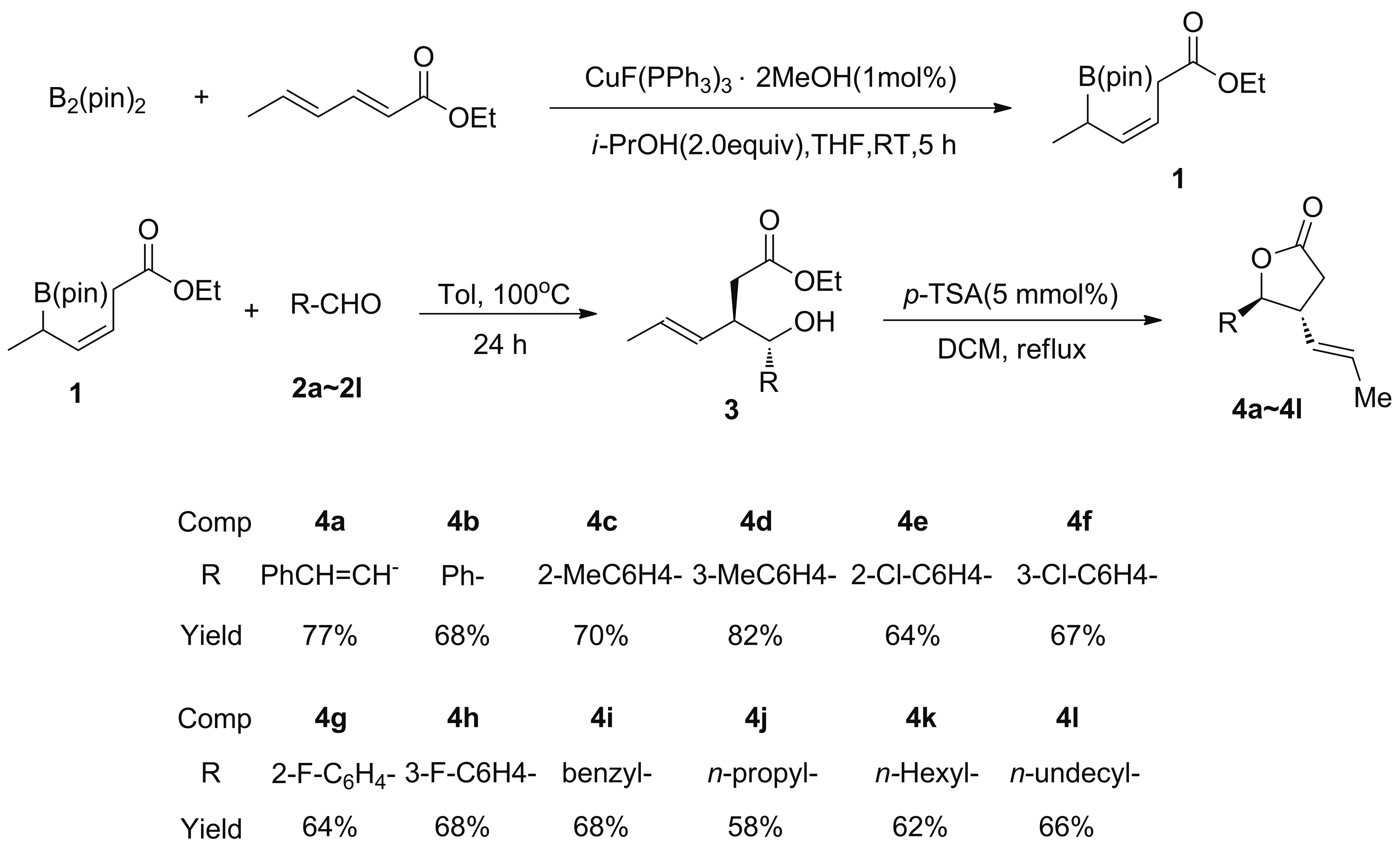
Scheme 1
虽然近年来构建单一非对映异构体的γ-丁内酯的方法取得了重要的进展[11-14],但大多数合成方法存在需要贵金属作催化剂,合成步骤复杂收率低等缺点。本文以廉价易得的山梨酸乙酯为原料,以三(三苯基膦)氟化亚铜为催化剂,与双联频哪醇硼酸酯反应制得顺式构型的烯丙基硼试剂(1)[15];1与不同醛类化合物(2a~2l)进行烯丙基加成和内酯化反应合成了γ-丁内酯(4a~4l, Scheme 1),其结构经1H NMR,13C NMR, HR-MS(ESI)表征。并研究了反应机理。
1 实验部分
1.1 仪器与试剂
Agilent VNMRS 600 MHz型超导核磁共振仪(TMS为内标);Waters型高分辨质谱仪。
1按文献[15]方法合成;对甲苯磺酸(p-TSA),国药集团化学试剂有限公司;其余所用试剂均为分析纯。
1.2 4a~4l的合成通法
在Schlenk反应管中加入醛类化合物(2a~2l)0.3 mmol,1120.68 mg(0.45 mmol)和甲苯2 mL,加热至100 ℃,搅拌下反应24 h。冷却至室温,旋蒸除去甲苯,残余物溶于二氯甲烷2 mL中,加入催化量的p-TSA 2.85 mg(0.015 mmol),回流反应5 h。用饱和NaHCO3溶液(15 mL)淬灭反应,用二氯甲烷(3×20 mL)萃取,合并有机层,用无水硫酸镁干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/25,V/V)纯化得化合物4a~4l。
4-丙烯基-5-苯乙烯基-二氢-呋喃-2-酮(4a): 无色油状液体52.67 mg,收率77%;1H NMR(600 MHz, CDCl3)δ: 7.40(d,J=7.5 Hz, 2H), 7.34(t,J=7.5 Hz, 2H), 7.28(t,J=7.3 Hz, 1H), 6.68(d,J=15.9 Hz, 1H), 6.17(dd,J=15.9 Hz, 6.8 Hz, 1H), 5.61(dq,J=13.0 Hz, 6.4 Hz, 1H), 5.39(ddd,J=15.2 Hz, 7.7 Hz, 1.2 Hz, 1H), 4.68(t,J=7.8 Hz, 1H), 2.98~2.86(m, 1H), 2.73(dd,J=17.3 Hz, 8.1 Hz, 1H), 2.48(dd,J=17.3 Hz, 10.9 Hz, 1H), 1.70(dd,J=6.4 Hz, 0.5 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 175.5, 135.6, 133.59, 129.45, 128.61, 128.28, 127.41, 126.6, 124.72, 85.16, 46.10, 35.41, 17.88; HR-MS(ESI)m/z: Calcd for C15H16O2{[M+H]+}228.1150, found 228.1157。
5-苯基-4-丙烯基-二氢-呋喃-2-酮(4b): 无色油状液体41.23 mg,收率68%;1H NMR(600 MHz, CDCl3)δ: 7.42~7.29(m, 5H), 5.52~5.38(m, 2H), 5.06(t,J=10.2 Hz, 1H), 3.07~2.95(m, 1H), 2.78(dd,J=17.4 Hz, 8.1 Hz, 1H), 2.55(dd,J=17.3 Hz, 11.0 Hz, 1H), 1.68(d,J=5.8 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 175.58, 137.63, 129.59, 128.50(d,J=1.8 Hz), 127.39, 125.80, 85.85, 48.29, 35.83, 17.84; HR-MS(ESI)m/z: Calcd for C13H14O2{[M+H]+}202.0994, found 202.0999。
4-丙烯基-5-邻甲苯基-二氢-呋喃-2-酮(4c): 无色油状液体45.36 mg,收率70%;1H NMR (600 MHz, CDCl3)δ: 7.32(dd,J=5.2 Hz, 3.9 Hz, 1H), 7.24(dd,J=5.6 Hz, 3.4 Hz, 2H), 7.20~7.15(m, 1H), 5.56~5.42(m, 2H), 5.38(d,J=7.6 Hz, 1H), 3.12~3.01(m, 1H), 2.80(dd,J=17.4 Hz, 8.1 Hz, 1H), 2.54(dd,J=17.4 Hz, 9.4 Hz, 1H), 2.33(s, 3H), 1.67(d,J=5.6 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 176.15, 135.77, 135.38, 130.60, 128.95, 128.29, 127.99, 126.30, 125.23, 83.05, 47.37, 35.39, 19.41, 17.83; HR-MS(ESI)m/z: Calcd for C14H16O2{[M+H]+}216.110, found 216.1155。
4-丙烯基-5-间甲苯基-二氢-呋喃-2-酮(4d): 无色油状液体53.16 mg,收率82%;1H NMR(600 MHz, CDCl3)δ: 7.29(dd,J=8.9 Hz, 6.7 Hz, 1H), 7.18(d,J=4.7 Hz, 2H), 7.13(d,J=7.6 Hz, 1H), 5.49(dd,J=19.0 Hz, 6.6 Hz, 2H), 5.07(d,J=8.7 Hz, 1H), 3.10~2.99(m, 1H), 2.81(dd,J=17.3 Hz, 8.1 Hz, 1H), 2.58(dd,J=17.3 Hz, 10.9 Hz, 1H), 2.40(s, 3H), 1.72(d,J=5.9 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 175.74, 138.29, 137.51, 129.48, 129.26, 128.35, 127.42, 126.40, 122.98, 85.96, 48.21, 35.81, 21.39, 17.88; HR-MS(ESI)m/z: Calcd for C14H16O2{[M+H]+}216.1150, found 216.1145。
5-(2-氯-苯基)-4-丙烯基-二氢-呋喃-2-酮(4e): 无色油状液体45.31 mg,收率64%;1H NMR(600 MHz, CDCl3)δ: 7.42~7.33(m, 2H), 7.33~7.22(m, 2H), 5.55(d,J=6.4 Hz, 1H), 5.52(dd,J=6.4 Hz, 4.9 Hz, 2H), 3.10~2.99(m, 1H), 2.73(dd,J=17.5 Hz, 8.2 Hz, 1H), 2.49(dd,J=17.5 Hz, 7.9 Hz, 1H), 1.66(d,J=4.3 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 176.07, 135.71, 132.32, 129.82, 129.56, 128.59, 128.09, 127.16, 126.79, 82.68, 46.99, 34.62, 17.80; HR-MS(ESI)m/z: Calcd for C13H13O2Cl{[M+H]+}236.0604, found 236.0609。
5-(3-氯-苯基)-4-丙烯基-二氢-呋喃-2-酮(4f): 无色油状液体47.44 mg,收率67%;1H NMR(600 MHz, CDCl3)δ: 7.37~7.24(m, 3H), 7.19(dd,J=3.9 Hz, 1.7 Hz, 1H), 5.49(dt,J=12.5 Hz, 6.3 Hz, 1H), 5.45~5.37(m, 1H), 5.02(d,J=8.8 Hz, 1H), 3.03~2.90(m, 1H), 2.78(dd,J=17.4 Hz, 8.1 Hz, 1H), 2.55(dd,J=17.4 Hz, 11.1 Hz, 1H), 1.73~1.64(m, 3H);13C NMR(101 MHz, CDCl3)δ: 175.22, 139.71, 134.52, 130.23, 129.84, 128.65, 126.97, 125.86, 123.90, 84.82, 48.44, 35.75, 17.89; HR-MS(ESI)m/z: Calcd for C13H13O2Cl{[M+H]+}236.0604, found 236.0598。
4-(2-氟-苯基)-4-丙烯基-二氢-呋喃-2-酮(4g): 无色油状液体42.43 mg,收率64%;1H NMR(600 MHz, CDCl3)δ: 7.33(dt,J=13.1 Hz, 6.9 Hz, 2H), 7.16(t,J=7.5 Hz, 1H), 7.06(t,J= 9.3 Hz, 1H), 5.54~5.39(m, 2H), 5.36(d,J=8.1 Hz, 1H), 3.14~3.02(m, 1H), 2.78(dd,J=17.4 Hz, 8.2 Hz, 1H), 2.53(dd,J=17.4 Hz, 10.0 Hz, 1H), 1.65(d,J=5.6 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 175.66, 161.36, 158.89, 130.26(d,J=8.3 Hz), 129.21, 127.41(d,J=3.6 Hz), 124.97(d,J=12.5 Hz), 124.41 (d,J=3.6 Hz), 115.79, 115.57, 80.55(d,J=1.6 Hz), 47.27, 35.43, 17.81; HR-MS(ESI)m/z: Calcd for C13H13O2F{[M+H]+}220.0900, found 220.0905。
5-(3-氟-苯基)-4-丙烯基-二氢-呋喃-2-酮(4h): 无色油状液体45.08 mg,收率68%;1H NMR(600 MHz, CDCl3)δ: 7.33(dd,J=13.7 Hz, 7.8 Hz, 1H), 7.13~6.98(m, 3H), 5.57~5.33(m, 2H), 5.04(d,J=8.9 Hz, 1H), 2.96(dd,J=10.9 Hz, 8.4 Hz, 1H), 2.78(dd,J=17.4 Hz, 8.1 Hz, 1H), 2.56(dd,J=17.4 Hz, 11.2 Hz, 1H), 1.71~1.66(m, 3H);13C NMR(151 MHz, CDCl3)δ: 175.15, 163.59, 161.95, 140.29, 130.39~129.97(m), 127.16, 121.33(d,J=2.9 Hz), 115.4, 115.38(d,J=21.1 Hz), 112.82, 112.67, 84.85, 48.36, 35.74, 17.83; HR-MS(ESI)m/z: Calcd for C13H13O2F{[M+H]+}220.0900, found 220.0894。
5-苄基-4-丙烯基-二氢-呋喃-2-酮(4i): 无色油状液体44.06 mg,收率68%;1H NMR(600 MHz, CDCl3)δ: 7.33~7.27(m, 2H), 7.23(dd,J=10.2 Hz, 4.2 Hz, 3H), 5.58(dd,J=14.9 Hz, 6.8 Hz, 1H), 5.29(ddd,J=15.1 Hz, 8.2 Hz, 1.3 Hz, 1H), 4.36~4.31(m, 1H), 3.06(dd,J=14.6 Hz, 3.7 Hz, 1H), 2.89(dd,J=14.6 Hz, 7.3 Hz, 1H), 2.82~2.73(m, 1H), 2.54(dd,J=17.4 Hz, 8.4 Hz, 1H), 2.35(dd,J=17.4 Hz, 10.8 Hz, 1H), 1.68(dd,J=6.5 Hz, 1.0 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 175.61, 136.28, 129.4, 129.19, 128.3, 128.12, 126.66, 84.92, 44.23, 38.80, 35.56, 17.78; HR-MS(ESI)m/z: Calcd for C14H16O2{[M+H]+}216.1150, found 216.1156。
4-丙烯基-5-丙基-二氢-呋喃-2-酮(4j): 无色油状液体29.23 mg,收率58%;1H NMR(600 MHz, CDCl3)δ: 5.59(dd,J=15.0 Hz, 6.7 Hz, 1H), 5.31(ddd,J=15.2 Hz, 8.1 Hz, 1.5 Hz, 1H), 4.09(td,J=8.5 Hz, 3.5 Hz, 1H), 2.71(dd,J=10.2 Hz, 8.6 Hz, 1H), 2.63(dd,J=17.2 Hz, 8.3 Hz, 1H), 2.38(dd,J=17.2 Hz, 10.7 Hz, 1H), 1.69(dd,J=6.5 Hz, 1.3 Hz, 3H), 1.66(ddd,J=10.6 Hz, 5.4 Hz, 3.0 Hz, 1H), 1.61~1.48(m, 2H), 1.47~1.34(m, 1H), 0.94(t,J=7.3 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 176.15, 129.01, 128.52, 85.06, 45.58, 35.95, 35.56, 19.10, 17.86, 13.80; HR-MS(ESI)m/z: Calcd for C10H16O2{[M+H]+} 168.1150, found 168.1154。
5-己基-4-丙烯基-二氢-呋喃-2-酮(4k): 无色油状液体26.04 mg,收率62%;1H NMR(600 MHz, CDCl3)δ: 5.58(dd,J=15.0 Hz, 6.6 Hz, 1H), 5.31(ddd,J=15.2 Hz, 8.0 Hz, 0.9 Hz, 1H), 4.07(td,J=8.5 Hz, 3.3 Hz, 1H), 2.69(dd,J=18.3 Hz, 8.8 Hz, 1H), 2.62(dd,J=17.3 Hz, 8.3 Hz, 1H), 2.38(dd,J=17.2 Hz, 10.7 Hz, 1H), 1.80~1.62(m, 4H), 1.62~1.43(m, 2H), 1.43~1.17(m, 7H), 0.87(t,J=6.8 Hz, 3H);13C NMR(101 MHz, CDCl3)δ: 176.15, 128.97, 128.55, 85.28, 45.54, 35.94, 33.48, 31.5, 28.97, 25.71, 22.45, 17.85, 14.00; HR-MS(ESI)m/z: Calcd for C13H22O2{[M+H]+}210.1620, found 210.1625。
4-丙烯基-5-十一烷基-二氢-呋喃-2-酮(4l): 无色油状液体38.80 mg,收率66%;1H NMR (600 MHz, CDCl3)δ: 5.56(dq,J=15.3 Hz, 6.3 Hz, 1H), 5.30(ddd,J=15.2 Hz, 8.1 Hz, 1.2 Hz, 1H), 4.06(ddd,J=8.5 Hz, 8.5 Hz, 3.4 Hz, 1H), 2.73~2.66(m, 1H), 2.61(dd,J=17.3 Hz, 8.3 Hz, 1H), 2.37(dd,J=17.3 Hz, 10.7 Hz, 1H), 1.71~1.61(m, 1H), 1.67(dd,J=6.6 Hz, 0.9 Hz, 3H), 1.60~1.43(m, 2H), 1.40~1.13(m, 17H), 0.86(t,J=7.0 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 176.0, 128.9, 128.6, 85.2, 45.5, 35.9, 33.5, 31.8, 29.54, 29.53, 29.45, 29.37, 29.30, 29.25, 25.7, 22.6, 17.8, 14.0; HR-MS(ESI)m/z: Calcd for C18H32O2{[M+H]+}280.2402, found 280.2409。
2 结果与讨论
2.1 反应条件优化
以2a和1的反应为模型反应,优化了反应条件,结果见表1。由表1可知,溶剂对反应的影响较大(No.1~5),在四氢呋喃(THF)、二氯甲烷(DCM)、甲醇(MT)中,反应收率均低于10%(No.1~3),选用DMF和甲苯(Tol)为溶剂时,反应收率分别为18%和24%(No.4和No.5),可能是由于硼原子与DMF或Tol的配位,促进了反应的进行。No.5~7为温度对反应的影响。当反应温度为100 ℃,收率可以达到46%(No.7)。以甲苯为溶剂和100 ℃的反应温度的反应条件下,通过TLC检测发现原料基本反应完,但存在大量没有关环的中间产物,未关环的中间产物转化为目标产物可能存在过渡态的状态,延长反应时间至24 h,发现收率几乎没有变化。因此考虑加入路易斯酸来促进关环的进行[13]。在温度100 ℃,甲苯为溶剂的条件下,反应24 h后,加入催化量的对甲苯磺酸, TLC检测发现未关环的产物几乎全部转化为目标产物,收率提高至77%(No.11)。
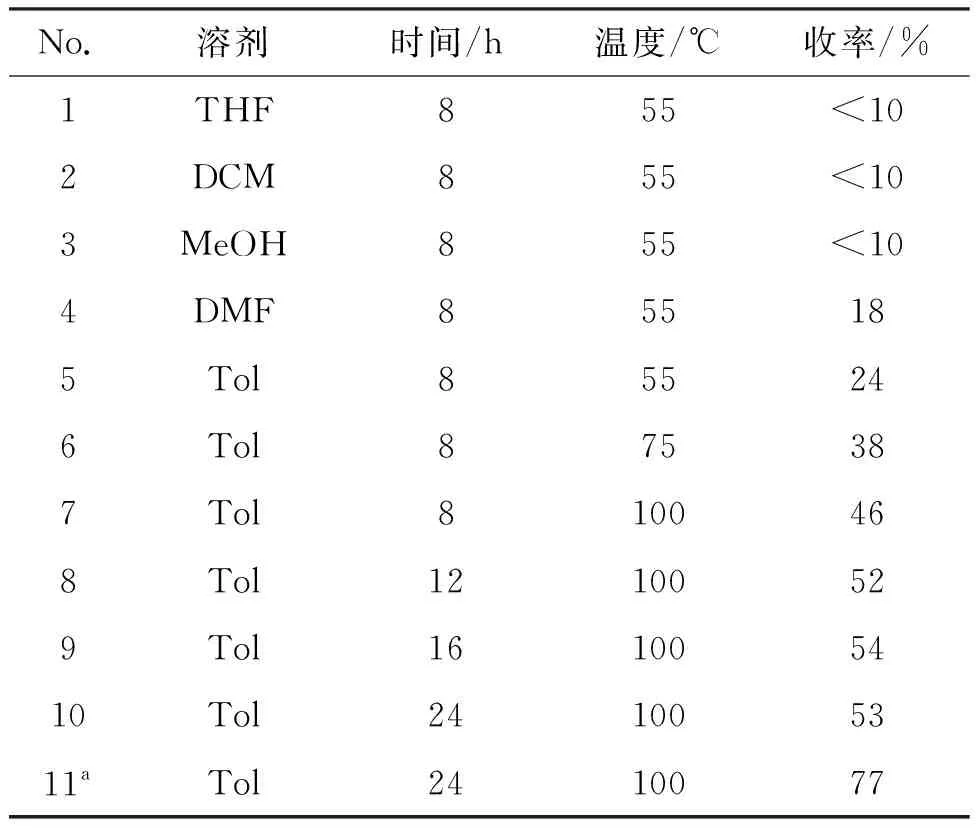
表 1 合成4a的条件优化
综上可见,合成3a的最优反应条件为:2a(0.3 mmol),1(0.45 mmol),甲苯(2 mL),反应温度100 ℃,反应24 h;加入二氯甲烷后和催化剂p-TSA(0.0015 mmol),反应5 h,收率为77%。
2.2 底物适应性
在最优反应条件的基础上,研究了底物适应性(Scheme 1)。芳基上的取代基一定程度上影响反应效果,供电子基团较于吸电子基团明显更具有优势,芳基上有供电子基团(CH3)取代基的底物得到产物的收率(4c: 70%,4d: 82%)明显高于芳基上为吸电子基团(Cl, F)取代基底物得到产物的收率(4e: 64%,4f: 67%,4g:64%,4h: 68%)。长链烷基醛比短链烷基醛反应效果更好(4j: 58%,4l: 66%),可能是由于短链的烷基醛在水中的溶解性好,易形成水合醛化合物,且不利于羰基键的烯丙基化。
2.3 产物构型
烯丙基硼试剂与羰基化合物进行烯丙基加成反应生成高烯丙基醇化合物,然后高烯丙基醇化合物内酯化生成内酯结构[16-18]。烯丙基硼试剂可以活化醛类化合物的羰基键,通过六元椅式过渡态与醛发生亲核加生成产物。Zimmerman-Traxler构型分析在多数情况下可以较好地预测产物构型,但在某些情况下不能解释产物分布[19-20],具有反式结构的手性烯丙基硼试剂经过烯丙基化反应给出两种构型Z-和E-的混合物。
如Scheme 2所示,具有顺式结构的1经Zimmerman-Traxler六元环过渡态的最低能量构型TS-1获得了单一产物(E)-3(此化合物在反应体系中经对甲苯磺酸催化形成内酯4b)。对此我们的解释是由于烯烃的反式构型,使得酯基官能团在两种过渡态中都处于轴向位,当甲基也处于轴向位时,二者之间的1,3-相互作用就变得显著,使得通过这一过渡态生成的产品(Z)-3成为次要产物,经历平伏位过渡态产物(E)-3与轴向位过渡态的产物(Z)-3大于20/1。值得注意的是,这一相互作用使所有产物都仅生成反式结构的高烯丙醇中间产物(E)-3,在提高了收率的同时避免了复杂的分离。其次,由于这类烯丙基硼试剂为手性试剂,当对映体纯的产品被合成出来后,利用其完美的手性传递作用可以成为合成手性纯的含多取代基的γ-丁内酯的强有力合成工具。

Scheme 2
以廉价易得的山梨酸乙酯为原料,与双联频哪醇硼酸酯反应,制得具有单一顺式结构的烯丙基硼酸酯,并将其与醛类化合物发生高选择性的烯丙基加成反应,然后在对甲苯磺酸催化下,经“一锅煮”合成了单一非对映体的4,5-双取代γ-丁内酯,总收率58%~82%。该研究为构建γ-丁内酯的结构骨架提供了一种简单经济的新方法。

