超声波法制备阿苯达唑包合物工艺研究
吴 蕾,刘红云,张 莉,吴 昊,许世富
(安徽省兽药饲料监察所,合肥 230091)
阿苯达唑(Albendazole,以下简称ABZ)系苯并咪唑类衍生物,是一种人兽共用的广谱抗蠕虫药,对多种寄生虫具有高度活性。作为兽药使用时,由于其在水中不溶[1]而限制了该品种新剂型的发展,目前一般以片剂或者预混剂形式应用。β-环糊精(以下简称β-CD)具有内疏水、外亲水的特殊结构,分子空腔大小适中、无毒,可容纳客分子,从而相对提高难溶物质的水溶性、稳定性及生物利用度[2],其性质安全无毒,不引起免疫反应,口服后可在肠道中参与机体代谢,体内不累积,且生产成本低,是一种广泛应用于食品、制药等领域的常见辅料[3-4]。本文以超声波法制备阿苯达唑β-CD 包合物,采用L9(34) 正交试验法,以包合率、包合物得率为综合指标对包合工艺进行优选,通过相溶解度法研究考察包合物中主客体分子之间的包合物物质的量之比,并考察包合物的溶解度、紫外光谱吸收、熔点等物理性质,旨在为兽用新剂型的开发提供技术思路。
1 仪器与试药
TU-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司),KS4000控温震荡摇床(德国IKA),KS500超声波清洗器(宁波科生仪器厂),D3000高效液相色谱仪(美国赛默飞),WRR熔点仪(上海申光仪器仪表有限公司),RCZ-8 W溶出度仪(天津天大天发科技有限公司),VD23减压干燥箱(德国BINDER),IQ7000超纯水仪(美国密理博公司),BT125D电子天平(德国赛多利斯),HJ-4A磁力搅拌器(常州国宇仪表厂)。阿苯达唑(河北美荷药业有限公司),β-环糊精(国药集团试剂有效公司),甲醇、乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 高效液相检测包合物中阿苯达唑含量方法的建立
2.1.1 检测波长的选取 取ABZ对照品加4%乙酸甲醇(2 ∶50,V∶V,下同)溶解,在波长200~400 nm范围内扫描,ABZ在波长296 nm 处有最大吸收峰,空白辅料在此波长处无吸收,不干扰ABZ的测定,因此选定296 nm作为检测波长。紫外吸收见图1。
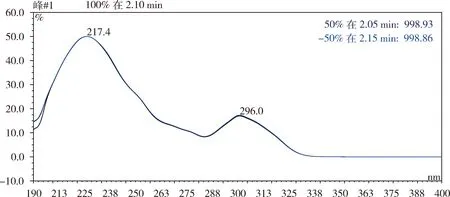
图1 ABZ紫外吸收图Fig 1 UV-absorption spectrum of ABZ
2.1.2 色谱条件 色谱柱为eclipse Plus C18 柱(150 mm×4.6 mm,5 μm),柱温25 ℃,流动相为乙腈-甲醇-水(56 ∶28 ∶18,V∶V),流速1 mL/min,检测波长296 nm,进样量10 μL,外标法定量。ABZ标准溶液色谱图见图2。

图2 ABZ对照品HPLC图Fig 2 HPLC chromatograms of ABZ
2.1.3 标准曲线 精密称取ABZ对照品20 mg,用4%乙酸甲醇溶解并定容于50 mL量瓶中,得浓度为400 μg/mL的母液。分别从母液中移取1.0、2.0、5.0、10.0、20.0 mL 置100 mL量瓶中,甲醇定容至刻度,得浓度分别为4.0、8.0、20.0、40.0、80.0 μg/mL的对照品溶液。精密吸取10 μL 上述溶液,进样测定。由ABZ峰面积(Y)对质量浓度(X)进行线性回归,得回归方程Y=0.8876X-0.8627,r=0.9992,表明ABZ在4.0~80.0 μg/mL线性关系良好。
2.1.4 精密度试验 取质量浓度为20.0 μg/mL ABZ对照品溶液,按照色谱条件重复进样5次,得色谱图按峰面积积分计算RSD为0.88%(n=5)。
2.1.5 供试品溶液的制备 精密称取干燥包合物0.2 g至50 mL量瓶中,加入2 mL冰醋酸、10 mL甲醇,超声20 min,放冷至室温后甲醇定容至刻度,0.45 μm滤膜过滤,进样。
2.1.6 回收率试验 取适量ABZ-β-CD(按ABZ与β-CD物质的量之比1∶1)加蒸馏水至刻度,共18份,分成3组,每组6份,每组分别加入不同量的ABZ对照品溶液配制成质量浓度分别为3.42、10.16、40.63 μg/mL的低、中、高3种质量浓度样品溶液,涡旋混合均匀后按照前述供试品的制备方法进行处理后进样10 μL,由测定的峰面积计算测得量,并分别计算回收率为95.23%、96.17%、100.02%,RSD为0.36%、0.48%、0.43%(n=6)。
2.1.7 稳定性试验 取“2.1.4”项下的溶液1份,室温下放置,按照前述色谱条件分别在12、24、36、48、60、72 h 进样分析,峰面积RSD为0.65%,表明供试品溶液在72 h内稳定。
2.1.8 重复性试验 取同一样品,按“2.1.5”制备5份供试品,按照色谱条件进样分析,峰面积RSD为0.56%。
2.2 包合物制备方法研究
2.2.1 不同制备方法的比较
2.2.1.1 饱和溶液法 精密称取一定量的ABZ至50 mL乙醇-丙酮(1∶1,V∶V)中,55 ℃恒温搅拌,另称取β-CD适量至50 mL蒸馏水中,55 ℃恒温搅拌溶解,缓慢滴入前液,滴定完成后,溶液均相透明,恒温55 ℃搅拌5 h,置4 ℃冰箱放置12 h,抽滤,用60 ℃的乙醇-丙酮(1∶1,V∶V)洗涤未包合的主药,60 ℃减压干燥,得包合物。平行制备3份,包合率为41.12%±0.35%,包合物得率为79.34%±0.75%(n=3)。
2.2.1.2 超声波法 精密称取β-CD适量,加入适量55 ℃的超纯水中制成不同浓度的水溶液,精密称取ABZ适量,加入50 mL乙醇-丙酮(1∶1,V∶V),55 ℃恒温搅拌使溶解,按规定比例将β-CD水溶液缓缓滴入ABZ溶液中。设置条件,超声,冷至室温,4 ℃冷藏12 h,抽滤,用60 ℃的乙醇-丙酮(1∶1,V∶V)洗涤,60 ℃减压干燥,得包合物。平行制备3份,包合率为61.12%±0.35%,包合物收率为89.02%±0.75%(n=3)。
通过以上试验比较发现,超声波法制备的包合物包合率较高,故选择超声波法制备阿苯达唑包合物。
2.2.2 包合物制备工艺优化
2.2.2.1 正交设计 根据预试验结果及参考文献,初步判断影响β-CD包合率的主要因素为主客分子的投料摩尔比(A)、超声时间(B)及β-CD水溶液浓度(C)等[5]。本试验以包合率、得率的综合评分作为评价指标,每个因素各取3个水平,采用L9(34)正交表进行正交试验,因素水平见表1。

表1 正交试验因素与水平表Tab 1 The factor and level of orthogonal test
2.2.2.2 包合物的制备 精密称取β-CD适量,加入适量50 ℃的超纯水中制成不同浓度的水溶液,精密称取ABZ适量,加入50 mL乙醇-丙酮(1∶1,V∶V),60 ℃恒温搅拌使溶解,按规定比例将β-CD缓缓滴入ABZ溶液中。设置条件,超声,冷至室温,4 ℃冷藏12 h,抽滤,用60 ℃的乙醇-丙酮(1∶1,V∶V)洗涤,60 ℃减压干燥,得包合物。
2.2.2.3 包合率、包合物得率的测定 包合率、包合物得率的具体计算公式如下:
包合率= 包合物中ABZ量/ABZ投入量×100%
包合物得率=包合物质量/(β-CD加入质量+ABZ加入质量)×100%
2.2.2.4 综合评价 由参阅文献所知,包合率是衡量包合效果的重要指标[6],包合率越高,包合效果越好,对稳定性的提高起关键作用,故权重系数定为0.6;而得率在实际生产中具有重要意义,在投入量一定的情况下,得率越高,包合率越高,权重系数定为0.4。包合率max、得率max分别是试验中各指标的最大值,综合评分按下列公式计算:
综合评分=(包合率/包合率max)×0.6+(得率/得率max)×0.4
2.2.2.5 正交试验结果及数据分析 按正交试验方案,进行9组试验,每组平行3次,计算相关指标的平均值。正交试验结果及直观分析见表2。

表2 正交实验结果Tab 2 The results of orthogonal test
根据正交试验的结果及极差直观分析可知,影响包合效果的顺序为B >A >C,进一步方差分析可知,因素B对包合工艺有极显著影响,因素A和C对包合工艺有显著影响。因此,确定最佳包合工艺为A3B2C1,即ABZ与β-CD投料比为1∶2,超声时间40 min,β-CD水溶液浓度8%为最优包合条件。
2.2.2.6 工艺验证试验 按正交试验筛选出的最佳工艺条件A3B2C1进行验证,结果见表3,可看出正交试验所确定的ABZ-β-CD 包合工艺稳定。

表3 正交验证试验结果Tab 3 The verification results of orthogonal test
2.3 包合物的验证
2.3.1 紫外光谱扫描 称取适量ABZ-β-CD包合物、β-CD,分别溶于水中,在室温下于200~800 nm进行扫描,结果见图3。可以看出ABZ-β-CD包合物在290 nm附近有较强吸收,β-CD在200~800 nm基本无吸收,说明包合物已经形成。
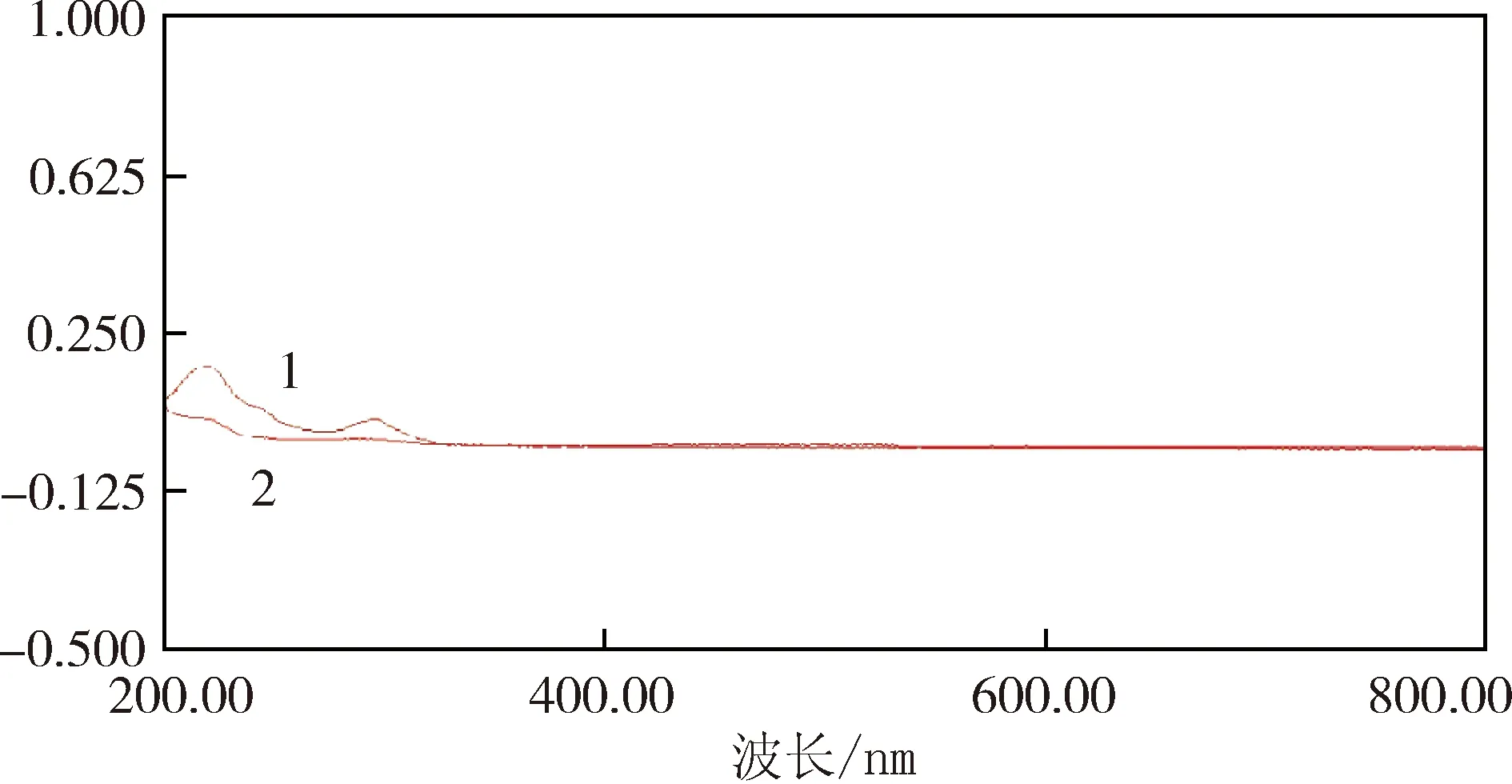
1:ABZ-β-CD包合物;2:β-CD图3 紫外吸收比较图Fig 3 UV spectrum
2.3.2 相溶解度的测定 精密称量β-CD粉末适量,分别配制成浓度为2、4、8、10、14、16 mmol/L的β-CD水溶液,精密量取上述溶液各10 mL,至50 mL离心管中,分别加入过量的ABZ粉末,密封,超声10 min,涡旋混合1 min,然后置于30 ℃恒温振荡器中振荡72 h,静置12 h,上清液经0.46 μm滤膜过滤,以4%乙酸甲醇稀释,按2.1项方法测定,以β-CD浓度(mmol/L)为横坐标,ABZ的浓度(μg/mL)为纵坐标,绘制相溶解度图(图4)。结果显示,ABZ的质量浓度随β-CD 质量浓度的增加而呈非线性增加,其相溶解度图为典型的Ap型[7],表明ABZ-β-CD在该质量浓度内药物与环糊精形成1∶n(n>1) 的包合物。
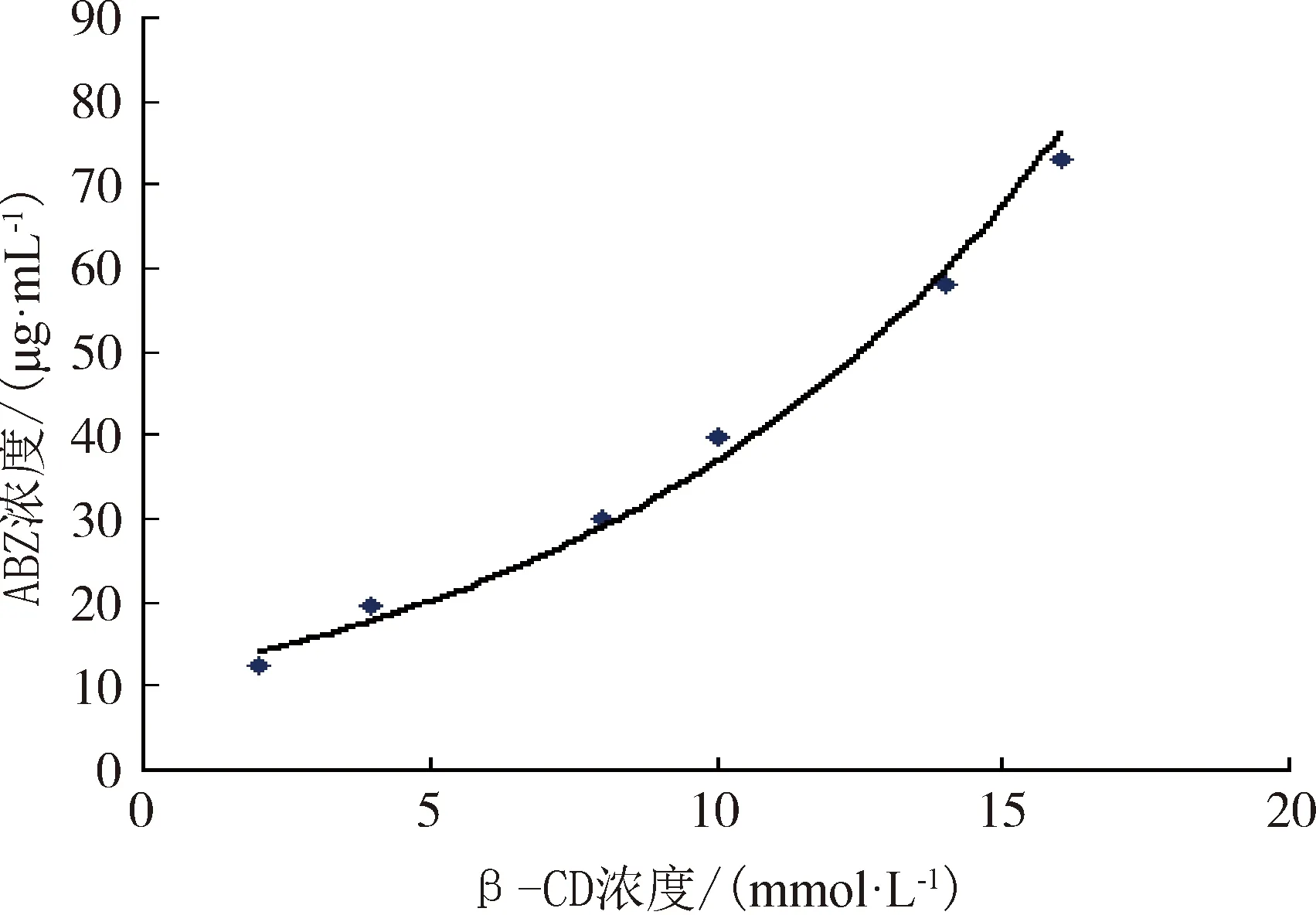
图4 ABZ-β-CD相溶解图Fig 4 Phase solubility diagram of ABZ-β-CD
2.3.3 包合物在水中表观溶解度的测定 称取ABZ-β-CD 包合物,置25 mL量瓶中,加水至刻度,25 ℃振荡平衡48 h,形成ABZ-β-CD包合物的过饱和溶液。移取上述溶液,0.45 μm 微孔滤膜滤过,取续滤液测定,计算包合物质量浓度和表观溶解度。结果ABZ-β-CD包合物在水中的表观溶解度为15 mg/mL,比阿苯达唑在水中溶解度至少提高20倍。
2.3.4 熔点测定 对ABZ、β-CD、ABZ-β-CD包合物以及ABZ和β-CD物理混合物进行熔点测定。结果显示,ABZ熔点为209~212 ℃,β-CD熔点为193~196 ℃,ABZ-β-CD包合物熔点为229~235 ℃,ABZ和β-CD物理混合物熔点为205~220 ℃。由此可见,包合物熔点与ABZ、β-CD、物理混合物熔点明显不同,这也可以说明包合物为新的物相。
3 讨 论
3.1 检测波长的确定 本实验建立了HPLC检测ABZ的分析方法,该方法简便易行,专属性强,回收率稳定,出峰时间短,可用于包合物中ABZ的定量测定。阿苯达唑对照品溶液在200~400 nm 内的紫外光谱扫描结果显示,其最大吸收波长在296 nm,而β-CD在此波长处无吸收,不干扰测定。故本文将检测波长定为296 nm。
3.2 主药溶解介质的确定 阿苯达唑水溶性极差,在丙酮、乙醇、氯仿中也仅是微溶。有文献报道[8]将阿苯达唑溶于甲酸后再用乙醇溶解,但由于β-CD在酸性环境中会发生解离,会极大降低包合物的得率。许爱霞等[9]采用55 ℃的丙酮∶乙醇(1∶1,V∶V)混合溶剂作为主药的溶解介质。
3.3 制备方法的确定 包合物的制备方法一般有饱和水溶液法、研磨法、喷雾干燥法、冷冻干燥法等。方法的选择需要考虑多个因素,如包合物的包合率、得率、方法的普适性、成本、放大效应等。冷冻干燥、喷雾干燥、研磨法均需特殊的设备,饱和水溶液法搅拌时间过长,费时费力。超声波法则较为简便快速。有报道称,超声处理可以提供更高的物理作用力,利于包合过程的形成[10]。在2.2.1.1项中,本文参考文献[8]采用逆向搅拌法考察饱和溶液法的实验指标,发现饱和溶液法较为费时,滴加速度慢(平均1 mL/min),含药溶液50 mL滴加完成需1 h左右,且还需长时间搅拌,预实验包合率也仅为41%,远低于超声波法,故在本试验中采用设备简便易得的超声波法制备ABZ-β-CD包合物并采用正交设计优化制备工艺。在后续研究中,将研究工业化生产适用方法如喷雾干燥或研磨法,进一步提高生产效率。
3.4 包合物的鉴定 本文在制备包含物后经相溶解度研究、熔点测定、紫外吸收光谱的测定证明包合物形成了新的物象,而不是β-CD与ABZ的简单混合。相溶解度研究证明,ABZ与β-CD相溶解度图为典型的AP型,说明有可溶性的包合物形成,且包合比是1∶n。与正交试验筛选出的主客体摩尔比1∶2吻合。

