六种哺乳动物细胞系染色体制片条件优化研究
王磊,杨承槐,刘莹
(中国兽医药品监察所,北京 100081)
与哺乳动物原代细胞相比,传代细胞系在生物制品研发、生产过程中具有突出的优势[1],已有多种传代细胞系成功应用于生物制品生产、检验的各个环节[2]。传代细胞系自身的特性(诸如染色体特性、致瘤性等)与生物制品的安全性息息相关。因此,国内无论是人用还是兽用生物制品法典都明确要求特定的传代细胞系或二倍体细胞作为疫苗生产用基质前,必须对特定代次进行胞核学检验[3-4]。细胞染色体制片是胞核学检验中的重要环节,影响因素较多,对环境和操作的要求较高,任何一个条件控制不好都会导致细胞染色体分散度差、长度不适于观察计数、结果重复性不好,进而影响到后续的检验结果[5-6]。
国家兽医微生物菌种保藏中心(国家兽医微生物资源平台)保藏的仓鼠肾细胞(BHK-21)、中国仓鼠卵巢细胞系(CHO)、猪睾丸细胞系(ST)、羊睾丸细胞系(OA3.Ts)、牛肾细胞系(MDBK)、兔肾细胞系(RK-13)既具有种属代表性又是生物制品研发和生产中的常用生产基质[7-8]。本研究参考人类羊水细胞以及多种原代细胞的染色体制备方法,对以上6种哺乳动物细胞系的染色体制片条件进行优化研究,旨在对鼠源、猪源、羊源、牛源、兔源传代细胞系的染色体制片提供有益借鉴和参考。
1 材料方法
1.1 材料及试剂
1.1.1 细胞系 BHK-21细胞第55代,批号20170719;CHO(代次不明),批号20160721;ST细胞第125代,批号20170621;OA3.Ts细胞第29代,批号20160806;MDBK细胞第9代,批号20170623;RK-13细胞第24代,批号20181130;均来自国家兽医微生物菌种保藏中心。
1.1.2 试剂及培养基 秋水仙素(沃凯,批号20171202)配制成100 μg/mL溶液、固定液(甲醇(沪试,批号20170821):乙酸(国药集团,批号20161010)=3∶1)、KCl(Vetec,批号wxbc4662v)配制成0.4%(g/V)溶液和0.075 mol/mL溶液、DMEM(Gibco,批号8119416)、胎牛血清(PAN,批号ST170802)、0.25% EDTA-胰蛋白酶(Gibco,批号1953147)、0.01 mol/L PBS缓冲溶液(实验室配制)、吉姆萨染液(Solarbio,批号20161124)。
1.1.3 主要仪器 Leica核型分析系统(型号 CyoVision capture station)、Hettich离心机(型号320R)、Thermo CO2培养箱(型号Heracell 240i)、Nikon倒置显微镜(型号TS100)。
1.2 实验方法
1.2.1 细胞培养条件 分别将冻存管中的CHO、BHK-21、ST、OA3.Ts、MDBK、RK-13六种细胞在37 ℃水浴中融化后,各加入含10 mL DMEM培养基(10%胎牛血清)的25 cm2细胞培养瓶中,放置在37 ℃、5% CO2的培养箱中培养。
1.2.2 染色体制片 待6种细胞均长成良好单层时,以1∶2比例传代至相应瓶数。随后分别按照以下方法进行制片条件的优化(表1)。

表1 染色体制片优化条件选择Tab 1 Selection of optimal conditions for chromosome production
传代后培养24 h时滴加秋水仙素(终浓度分别为1 μg/mL、4 μg/mL、7.5 μg/mL)处理1 h。随后吸净培养液,加1 mL胰酶消化中和后,充分吹散细胞。1 200 r/min离心,8 min收集细胞沉淀。细胞沉淀中加入8 mL KCl低渗液(浓度分别为0.4%和0.075 mol/mL),将细胞沉淀团块吹散后室温处理不同时间(20 min、40 min、60 min);然后加入3 mL固定液,混匀,1 200 r/min离心8 min,弃掉上清液。重复滴加固定液、离心处理两次后,重悬于2 mL的固定液中。将固定处理好的细胞滴在-20 ℃预冷的干净玻片上,干燥后,用Giemsa染色液浸泡8 min,用纯化水轻柔冲洗干净。对分散较好的单个细胞的染色体视野用CytoVision System (Applied Imaging)软件进行图像拍摄并统计染色体数目,共统计50个以上细胞的染色体条数。
2 结果与分析
本实验通过对不同细胞在不同秋水仙素浓度、低渗液浓度、低渗液处理时间的条件摸索发现,以上六种细胞系用25 cm2细胞培养瓶传代后培养24~48 h,1 μg/mL的秋水仙素处理60 min,处在中期分裂相的细胞最多,视野中染色体长度适中,用0.4% KCl溶液低渗处理40 min,细胞中染色体在载玻片上形态最佳,分散度最好(图1)。
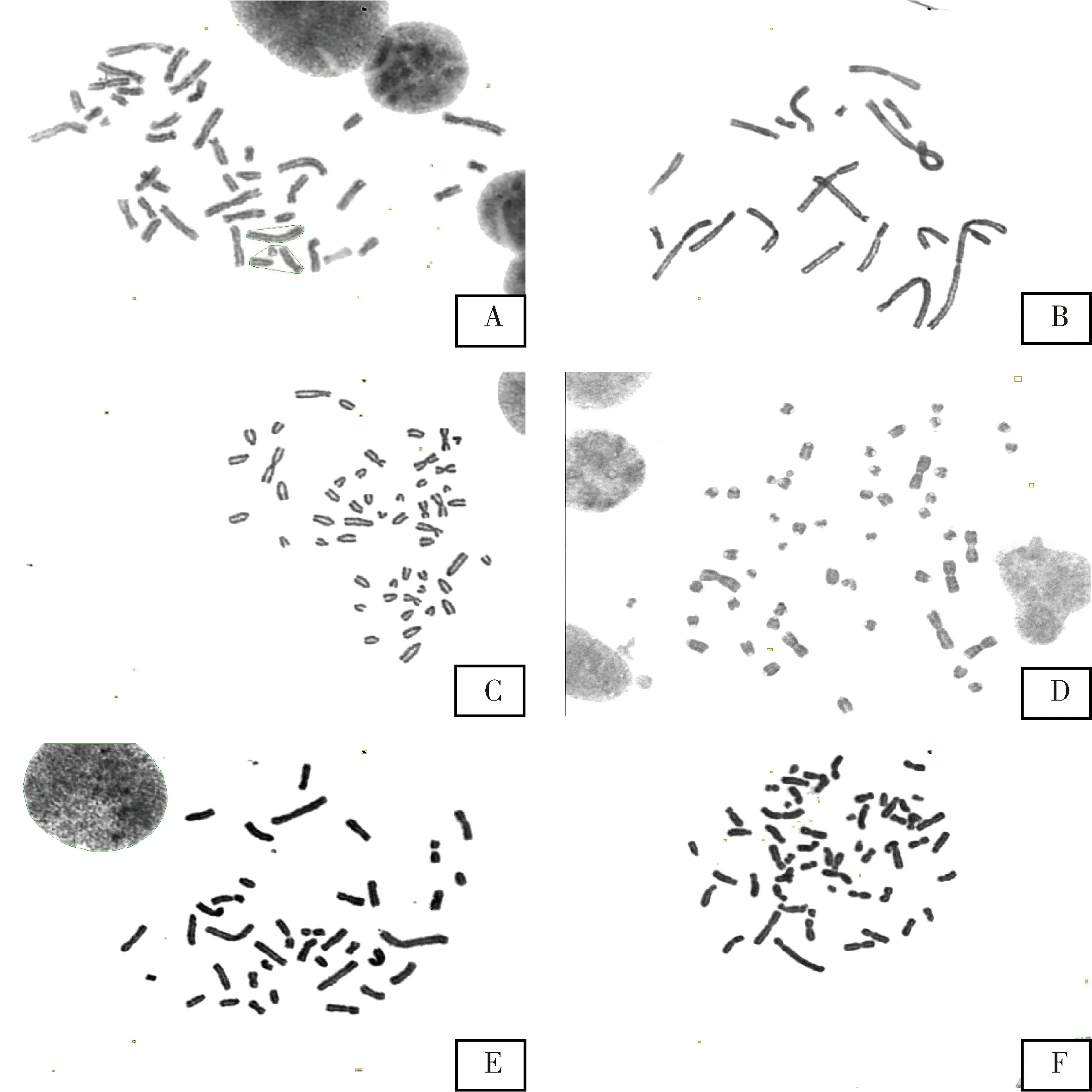
A:BHK-21细胞;B:CHO细胞;C:MDBK细胞; D:OA3.Ts细胞;E:ST细胞;F:RK-13细胞A:BHK-21 cell;B:CHO cell;C:MDBK cell;D:OA3.Ts cell;E:ST cell;F:RK-13 cell图1 条件优化后的六种传代细胞系染色体制片效果(100倍油镜观察)Fig 1 Chromosome slicing effect of optimized six cell lines (100-fold oil microscopic observation)
镜下观察六种传代细胞的染色体的形态和结构,高倍镜下挑选50 个以上染色体轮廓清晰分散良好的处于中期细胞,精确计数每个细胞的染色体数,通过统计确定六种细胞众数结果(表2)。
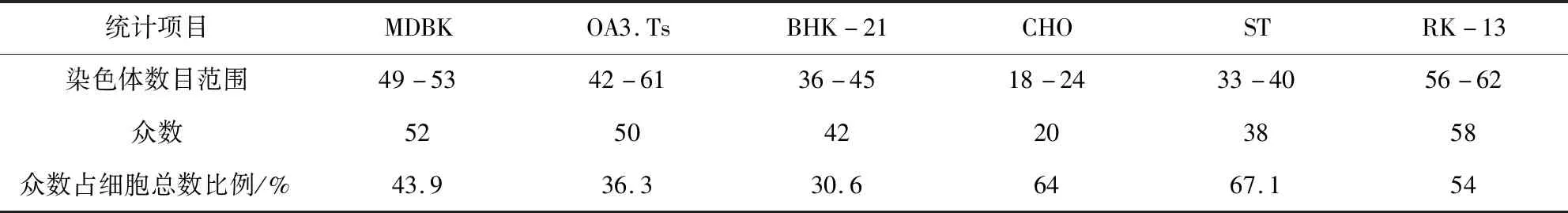
表2 六种细胞染色体条数统计结果Tab 2 Mode number of chromosomes of six cell lines
3 讨论与结论
由于细胞染色体的核型作为一种特异性的细胞遗传信息很好地表现出自身的种质特性[1],因此胞核学检验通过染色体核型检查可以清楚地反映细胞系的遗传背景和传代的稳定性(传代过程中的染色体是否发生畸变或者缺失等情况)[9]。研究发现:ST细胞众数与猪源原代细胞染色体众数(2n=38)一致,占细胞总数的67.1%,说明该细胞系染色体分布频率在正常二倍体细胞附近;其他五种细胞的众数与其对应原代细胞相比,均有不同程度的偏差,并且染色体的数量分布也较为离散。张德礼等认为细胞的致瘤性与否和细胞系染色体的变异情况直接相关,细胞系染色体的众数与原代细胞相比偏离的越高、染色体数目范围越宽,出现致瘤性的几率就越大[10-12]。
细胞染色体制片质量的好坏会直接影响胞核学检验的准确性和检验效率[13]。秋水仙素的处理对染色体的形态和处于中期分裂相的数量起到了关键作用。秋水仙素具有细胞毒性,会抑制细胞生长,促进细胞凋亡,导致染色体分裂抑制,形态变异[14]。本研究参考相关文献[5,7],结合细胞染色体制备经验,对秋水仙素的浓度进行了优化,发现使用终浓度为1 μg/mL的秋水仙素处理后,细胞染色体臂长适中并且形态最佳;秋水仙素的浓度过高或时间较长,染色体会呈“点”状(图2B),导致后续G带显色分析时带型无法分辨;秋水仙素浓度过低或处理时间过短,染色体会因为长度过长而纠缠在一起(图2C),也影响后续的结果分析。秋水仙素处理细胞的时机亦会影响到染色体的形态以及长度。秋水仙素处理的时机应尽量选择在细胞系传代后24~48 h,细胞生长90%至刚刚长满细胞瓶时。错误的处理时间可能会导致处于中期分裂相的细胞过少,或者滴片后细胞染色体的分散度不好呈“菊花”状(图2A)。
滴片后染色体的分散程度常与低渗液的处理是否合适有关。常见的低渗溶液包括KCl溶液、柠檬酸钠溶液或者氯化钠溶液[15-16]。0.075 mol/mL的KCl溶液作用20~60 min多用于传代细胞系和羊水细胞的低渗处理[13,17]。为了尝试在低渗过程中使细胞膨胀更加充分,在滴片后得到最佳的染色体分散效果,本研究增加了1组浓度更低的低渗液(0.4% KCl)处理。结果表明,待检细胞用0.4% KCl溶液在37 ℃水浴中处理40 min时的低渗效果最佳,细胞滴片后染色体分散适中,破碎释放染色体的细胞视野较多。而采用浓度过低的低渗液或者处理时间过长会导致细胞在滴片前就提前破碎,滴片后视野背景中会出现大量游离的染色体。采用浓度过高的低渗液或者低渗液处理时间过短会造成等渗的效果,在滴片后没有细胞破碎释放出染色体(图2D),得不到理想的染色体中期分裂相视野。
除以上涉及的影响因素外,细胞的培养状态、传代比例甚至是滴片时的温湿度条件和载玻片的质量亦会对制片效果产生很重要的影响。胞核学检验是一个很经典的实验方法,如何将染色体制片的过程标准化,满足多种属细胞检验需求,是今后下一步的努力方向。
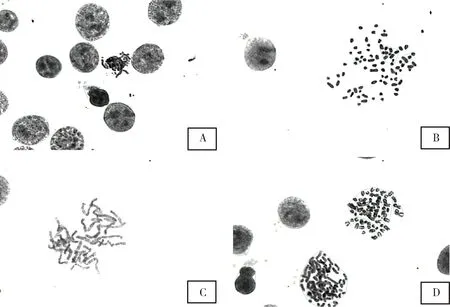
A.染色体呈“菊花状”(ST细胞);B.染色体呈“点状”(OA3.Ts细胞);C.染色体长度过长(MDBK细胞);D.染色体分散度差(OA3.Ts细胞)A.The chromosome is “chrysanthemum like” (ST cell);B.The chromosome is “punctate”(OA3.Ts细胞);C.Chromosome length is too long(MDBK cell);D.Poor chromosome dispersion(OA3.Ts cell)图2 染色体制片过程中的常见问题Fig 2 Common problems in chromosome production

