结核分枝杆菌对德拉马尼的耐药机制研究进展
刘原园 初平 韩书婧 杨慧 鲁洁
结核病是全球重大的公共卫生问题,日益增加的耐多药和广泛耐药结核病(MDR-TB/XDR-TB)是结核病广泛传播的重要原因之一[1-2]。与对药品敏感的结核病相比,MDR-TB的治疗需要4~6种抗结核药品联合使用,其中也包括毒性更强但效力较弱的二线药品,可使其治疗时间长达2年,具有治愈率低、治疗时间长、死亡率高等特点[3-4],同时XDR-TB的治疗成功率也仅为44%[5]。近年来,抗结核药品的研发取得了一些新的进展。其中,德拉马尼(delamanid,Dlm)首次获得欧洲药品管理局的批准,被世界卫生组织列入MDR-TB治疗指南,可与标准抗结核方案联合用于成年MDR-TB患者[6-7],为治疗MDR-TB/XDR-TB带来了希望。然而,Dlm作为新药,其耐药株的及时检测对于最大限度地减少耐药风险及保持药品的有效性也是至关重要的。笔者对Dlm的耐药机制及其耐药相关基因突变进行综述,为Dlm耐药株的早期分子检测提供参考。
一、 Dlm的作用机制及抗菌活性
Dlm又称为OPC-67683,是一种硝基二氢咪唑类衍生物,由日本大冢制药有限公司研发。其作用机制主要是抑制分枝菌酸的生物合成,尤其是甲氧基分枝菌酸和酮类分枝菌酸[8],进而扰乱细胞壁的合成,促进药品对分枝杆菌的渗透[9]。此外,一项转录组测序(RNA-seq)技术的研究显示,Dlm可限制MTB的有氧呼吸,提示呼吸中毒在其杀菌作用中也起着至关重要的作用[10]。
研究表明,无论临床MTB分离株对一线抗结核药品是否耐药,Dlm对其在体外和体内均显示出较低的最低抑菌浓度(minimum inhibitory concentration,MIC;范围为0.006~0.024 mg/L),具有很强的抗结核活性[8, 11],可认为Dlm对细胞内复制活跃、低氧条件下非复制的MTB均具有较强的杀菌能力,且与目前使用的任何抗结核药品均不存在交叉耐药性[7,10]及相互作用。另有研究提出,Dlm也与抗逆转录病毒药品无相互作用[12],且MDR-TB患者对其耐受较好,最常见的不良反应是胃肠道反应和失眠,提示Dlm对于并发HIV感染/AIDS和MDR-TB患者具有较好的抗菌活性。然而,Dlm用于临床仅1年,西藏就出现了首例对Dlm耐药的结核病患者,同时也对另一种抗结核新药贝达喹啉耐药[13-14]。因此,为有效预防Dlm耐药的发生,应当深入研究其耐药机制。
二、 Dlm的耐药机制
1.Dlm的自发耐药率:MTB对Dlm的耐药性可由自发的基因突变引起。已报道的研究中,MTB标准株(H37Rv)对Dlm的自发耐药频率为6.44×10-6~4.19×10-5,卡介苗东京株为2.51×10-5~3.95×10-5,与异烟肼相似[8, 15]。另外,Kardan-Yamchi等[16]纳入了35株利福平耐药MTB菌株,发现9株(25.7%)对Dlm呈表型耐药;而Wen等[17]检测了MDR-MTB和XDR-MTB各110株菌株,发现仅有4株(3.6%)和3株(2.7%)对Dlm耐药;Yang等[18]纳入了420株临床MTB分离株,发现41株(9.8%)对Dlm耐药,其中15株为MDR-MTB、11株为XDR-MTB、9株为前广泛耐药(pre-extensively drug resistant,pre-XDR)菌株;Pang等[19]研究检测了90株XDR-MTB临床分离株,发现对Dlm的耐药率为4.4%;Schena等[20]分析了未采用Dlm治疗的结核病患者的159株临床MTB分离株,体外耐药性检测发现仅4株对Dlm耐药。这些研究表明,不同来源的临床分离菌株对于Dlm的耐药率不尽相同,进一步说明对临床分离菌株及时进行Dlm耐药性检测的必要性。
2.Dlm的耐药机制:有研究认为,MTB获得性耐药与其药物靶点基因或参与药物激活基因的突变密切相关[21]。Dlm作为一种前体药品,需要脱氮黄素依赖性硝基还原酶[deazaflavin (F420cofactor)-dependent nitroreductase,Ddn]激活其抗结核活性[15](图1)。而Ddn的酶活性依赖于脱氮黄素F420辅因子的氧化还原循环,该循环将还原形式的F420(F420H2)氧化成F420,再由F420依赖性葡萄糖-6-磷酸脱氢酶(F420-dependent glucose-6-phosphate dehydrogenase,Fgd1)将F420还原[7],为下一个循环周期的使用做准备。F420辅因子由3种F420生物合成蛋白(F420biosynthesis protein,Fbi)——FbiA、FbiB和FbiC共同参与合成。
在实验室诱导耐药研究中发现,Dlm激活途径中的5个基因[ddn(编码Ddn酶)、fgd1(编码Fgd1)、fbiA、fbiB和fbiC(分别编码FbiA、FbiB和FbiC)]中的任一基因突变都可能导致对Dlm的耐药性[15]。根据耐药相关基因的不同,将Dlm耐药机制分为3类:一是ddn基因突变,导致Ddn蛋白结构异常、功能丧失,破坏了依赖于F420的硝基还原酶途径;二是fbiA、fbiB和fbiC基因突变,导致F420合成酶的功能异常,产生非功能性形式的F420;三是fgd1基因突变,导致氧化形式F420的积累,也与Dlm耐药性有关[15, 22]。此外,Ddn能将Dlm转化为无活性的去硝基形式代谢物[8],而Dlm杀灭MTB的确切靶点尚未可知,因此推测在此硝化还原过程中产生的尚未鉴定的活性中间体是Dlm发挥疗效的原因[7]。
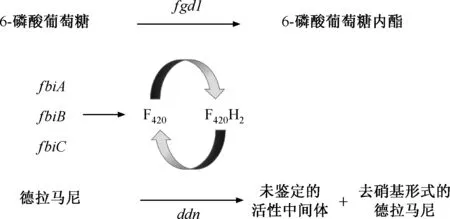
图1 参与德拉马尼生物激活的基因
三、 Dlm耐药基因的相关突变
据报道,Ddn、Fgd1和FbiA对MTB在体外的最佳生长不是必需的,也没有需要FbiB和FbiC必要性的证据[23]。笔者综合了现有涉及Dlm耐药基因突变结果的11篇文献,对已报道的96株Dlm耐药突变株的基因突变位点进行综述分析,发现ddn基因突变最常见(50株),其次是fgd1(21株)、fbiA(11株)、fbiC(11株)基因,而fbiB基因突变最少,仅3株。
(一)ddn基因突变
已报道的对Dlm发生ddn基因突变的MTB共计62株,其中50株为耐药菌株,12株为敏感菌株。共发现9个非同义突变、1个同义突变、6个移码突变(插入/缺失突变)(表1)。
Trp88STOP**突变是携带有提前终止密码子的ddn突变,与耐药相关,且可使MTB分离株的MIC值增加1000倍(>32 mg/L)[20],可能与其突变导致Ddn酶蛋白合成失败或结构异常,使其硝基还原功能丧失,从而对Dlm耐药有关[24];另外,突变频率最多的是81位密码子,其中Gly81Ser突变分别在耐药株和敏感株中被发现,故不能确定Gly81Ser突变是否与耐药有关[18];而Gly81Asp、Gly53Asp、Asn91Thr、Leu107Pro突变分别在2、3、2、1株耐药株中被发现,提示与耐药相关,认为可能与Gly53Asp和氨基酸G53位于Ddn蛋白的保守结构域,可替换其影响酶的功能有关[25]。而6个移码突变菌株也均与耐药相关,且MIC值除91G 缺失外均处于相对高的水平。
(二)fgd1基因突变
已报道的对Dlm发生fgd1突变的MTB共有109株,其中21株为耐药菌株、88株为敏感菌株。共发现有4个非同义突变,2个同义突变,3个移码突变(表2)。
耐药菌株中,Ghodousi等[26]发现1例应用Dlm后出现耐药的患者,对其临床分离株进行测序后显示为Gly104Ser突变,由此推测Gly104Ser突变可能与Dlm耐药相关。而Ala89Pro突变、227C位点缺失、630G位点插入突变,均仅在耐药株中被发现,提示与Dlm耐药相关性较高(MIC>25 mg/L)[15]。Bloemberg等[13]发现1株G49移码突变与出现对Dlm的表型耐药相吻合,也可认为与Dlm耐药有关。但突变频率最高的Phe320Phe同义突变,分别在10株耐药株[15, 17]和72株敏感株[20]中被发现,提示与耐药性无关。同时,Lys296Glu和Lys270Met两个非同义突变和Tyr155Tyr同义突变分别在敏感株中被发现[20],暂可认为均与Dlm耐药无关。
(三)fbiA基因突变
已报道对Dlm发生fbiA基因突变的MTB共计41株,其中11株为耐药株、30株为敏感株,共发现11个非同义突变、7个同义突变、3个移码突变(表3)。
耐药菌株中,提前终止密码子突变Lys250STOP**与1株 Asp106Gly突变具有较高的MIC值,推测是导致Dlm耐药的突变。Bloemberg等[13]研究发现3株第49位密码子的Asp49Thr突变,且突变频率增加,与对Dlm表型耐药的出现时间相吻合;另一研究也发现第49位密码子上不同的Asp49Tyr突变[14],提示第49位密码子突变可能与耐Dlm有关。Wen等[17]研究发现1株Glu249Lys非同义突变,推测可能与MTB对Dlm的高水平耐药有关。另外,272—275CAGG插入,以及452A、222C、223C缺失仅出现在耐药菌株中(MIC>25 mg/L)[15],提示插入与缺失突变对Dlm耐药有直接影响。而发生Arg175His突变的10株菌株中,仅1株为耐药株[13-14],提示Arg175His与Dlm耐药相关性较小。
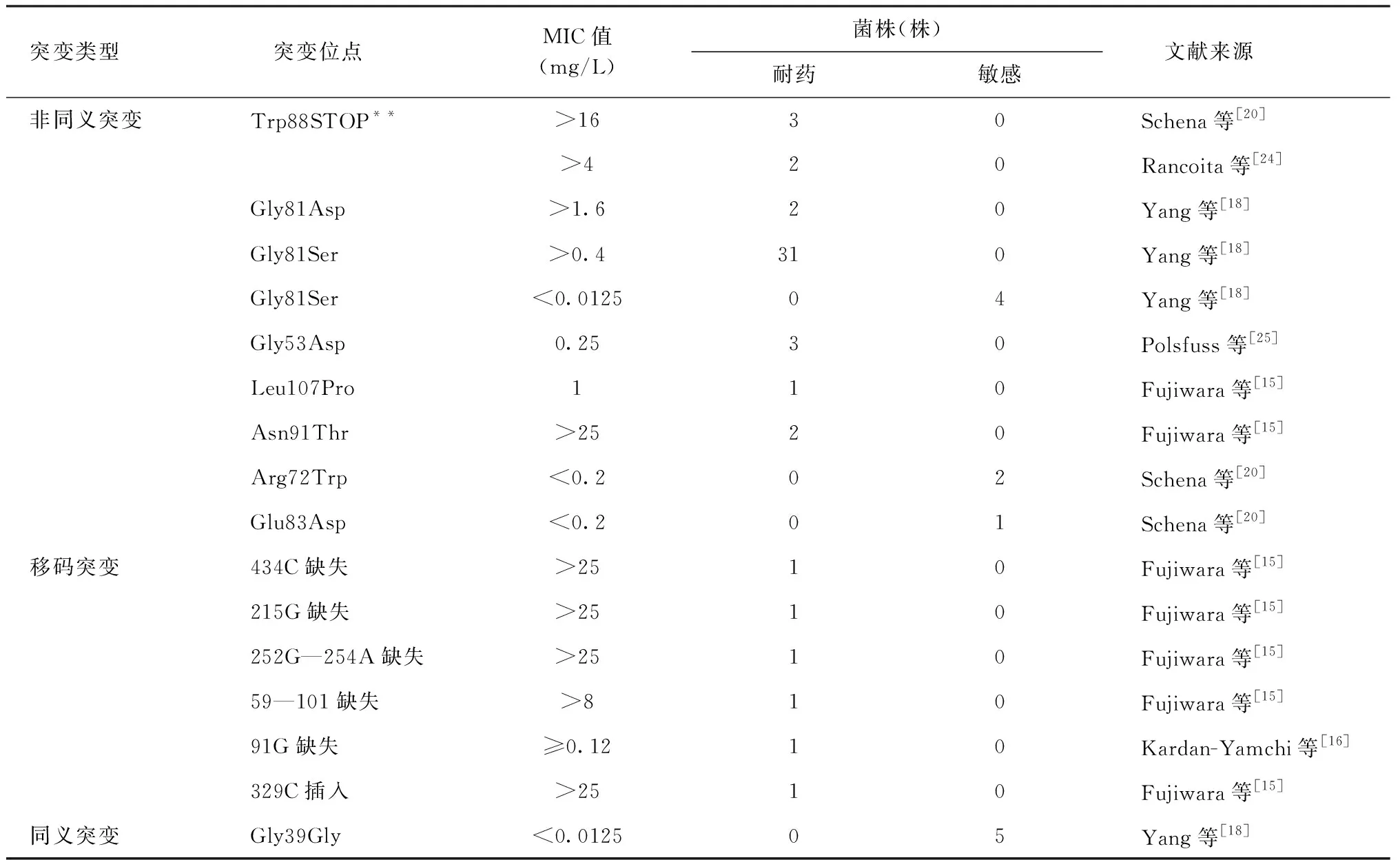
表1 Dlm耐药相关ddn基因突变

表2 Dlm耐药相关fgd1基因突变
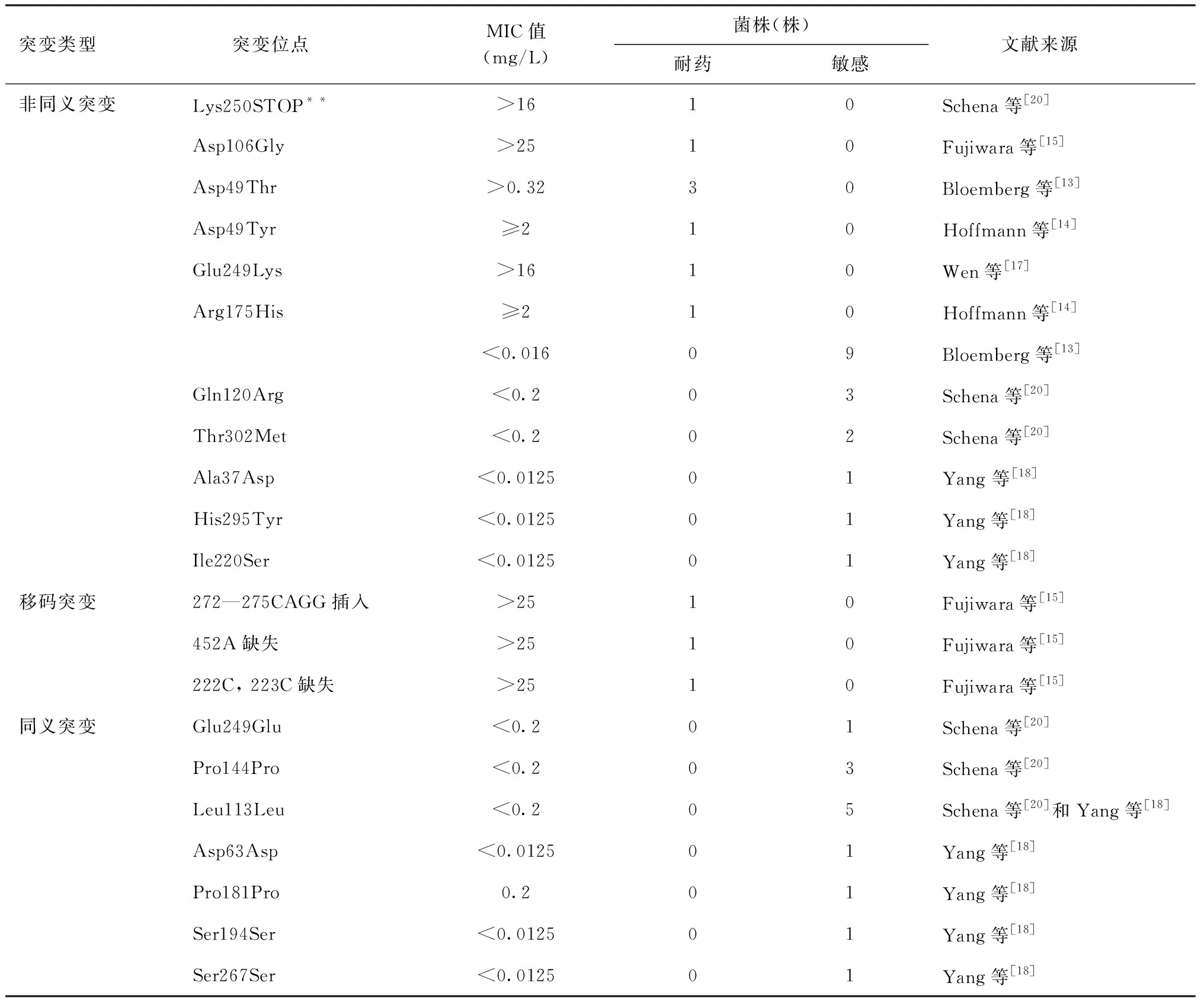
表3 Dlm耐药相关fbiA基因突变
同时,突变的敏感株包括Gln120Arg、Thr302Met、Ala37Asp、His295Tyr、Ile220Ser等非同义突变,以及249、144、113、63、181、194、267等密码子位点同义突变,可见fbiA基因突变位点较多,但多数突变与Dlm敏感相关。
(四)fbiB基因突变
已报道对Dlm发生fbiB基因突变的MTB共计13株,其中2株为耐药株、11株为敏感株;发现3个非同义突变、1个同义突变、2个移码突变(表4),其中1148C—1155G与1263G—1264G缺失突变仅在耐药株中发现[15],可认为与Dlm耐药直接相关。而敏感株中发现的1株Thr92Thr同义突变[25]和3株非同义突变(Leu447Arg、Lys448Arg、Phe220Leu)[20],认为均与Dlm耐药无关。
(五)fbiC基因突变
已报道对Dlm发生fbiC基因突变的MTB共计23株,其中11株为耐药株、12株为敏感株;发现7个为非同义突变、4个同义突变、4个缺失突变(表5)。
在耐药菌株中,1339G、811G、813C、699C和1638T等不同位点的缺失突变均具有很高的MIC值[15],可认为与Dlm耐药直接相关。提前终止密码子Arg220STOP**突变的MIC>25 mg/L[15],推测与Dlm耐药相关。Pang等[19]研究认为,2株Val318Ile突变是潜在的与Dlm耐药相关的非同义突变;而Cys98Tyr和Leu53Pro非同义突变的MIC值也同样很高[15],认为三者均为Dlm耐药的相关突变。Rancoita等[24]发现2株Arg536Leu突变,且在同一实验中发现ddn基因的Trp88STOP**突变比fbiC基因的Arg536Leu突变的耐药相关性更高,说明ddn基因对Dlm耐药性的产生更为关键。

表4 Dlm耐药相关fbiB基因突变
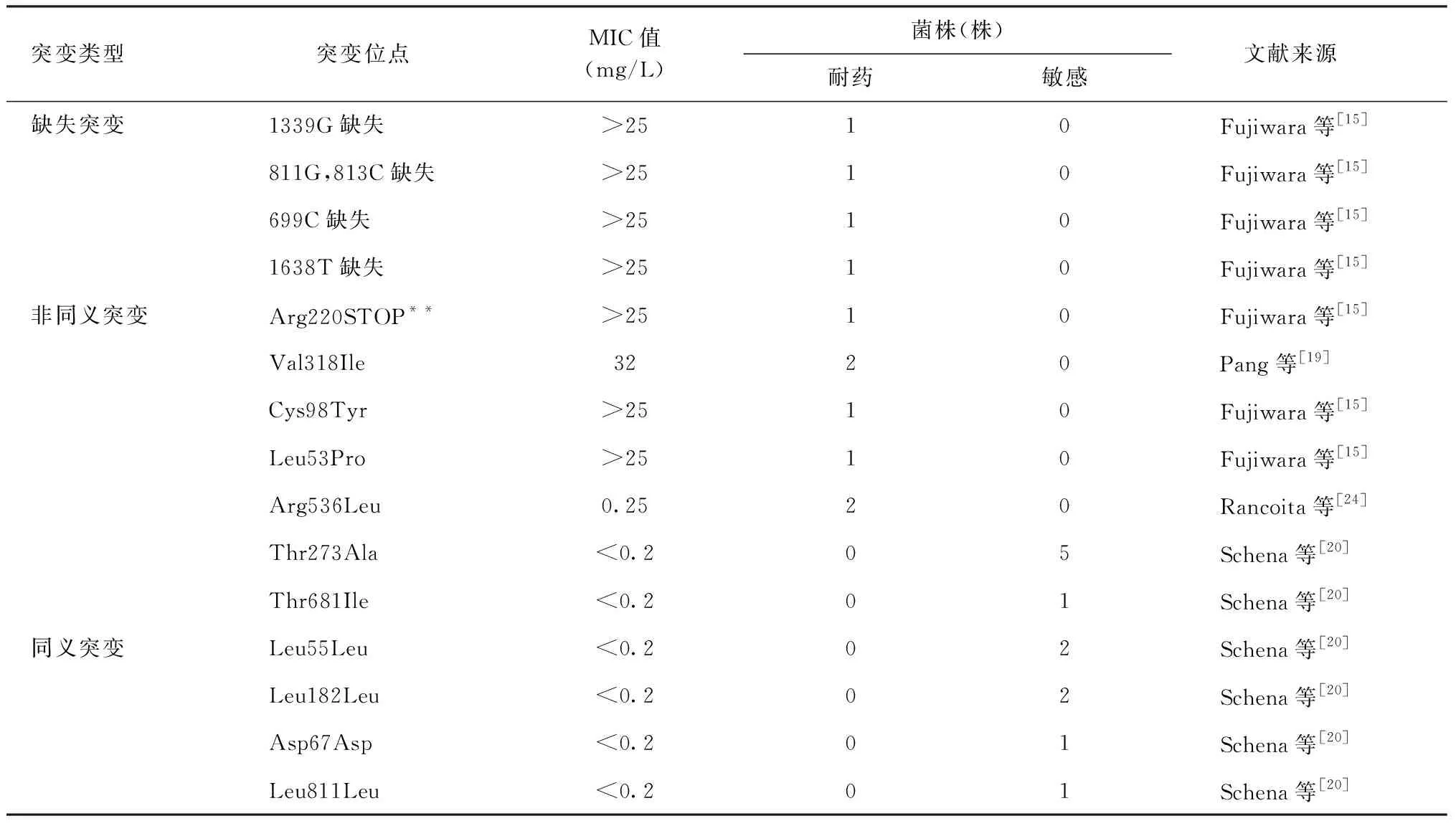
表5 Dlm耐药相关fbiC基因突变
Thr273Ala及Thr681Ile非同义突变和4个不同位点(密码子位点分别为55、182、67、811)的同义突变[21]仅在敏感株中出现,暂认为与Dlm耐药无关。
四、Dlm与普托马尼交叉耐药突变
普托马尼(pretomanid),又名PA-824,与Dlm同为硝基咪唑类抗结核药品,有着相同的耐药机制和耐药相关基因[27-28]。目前,仅Wen等[17]报道了1株对Dlm及PA-824同时耐药的菌株,且均有较高的MIC值(MIC>16 mg/L),其fbiA基因存在Glu249Lys突变,提示Glu249Lys为硝基咪唑类抗结核药品的共同耐药相关突变。
五、展望
对Dlm耐药的ddn、fgd1、fbiA、fbiB、fbiC5个基因突变均存在同义、非同义突变及移码(插入/缺失)突变,且除Phe320Phe外所有同义突变均为非耐药相关突变,所有移码突变均与耐药相关;而对于仅在耐药株中出现的非同义突变,可以推测与耐药相关。建议进一步对与耐药相关的单氨基酸改变频次较高的ddn、fbiA、fbiC基因进行生物信息学分析,可能有助于阐明突变的耐药途径及确定有效突变位点。虽然与fgd1相关耐药突变位点的报道不多,但因有临床病例证据,认为也有必要进一步实验研究。而对于在各项研究中报道最少的fbiB突变,因未发现与耐药相关的单氨基酸改变,笔者认为研究价值相对较低。
综上所述,笔者对Dlm耐药基因的突变进行了详细分析,为进一步研究Dlm耐药性机制和开发新的快速的分子药物敏感性检测方法提供了理论参考,对指导临床早期进行分子诊断具有重要意义。

