稀硫酸预处理对杂交狼尾草木质纤维素化学组分和表征结构的影响
高凤芹,景媛媛,德英,万其号,刘鹰昊,塔娜
稀硫酸预处理对杂交狼尾草木质纤维素化学组分和表征结构的影响
高凤芹,景媛媛,德英,万其号,刘鹰昊,塔娜
(中国农业科学院草原研究所,呼和浩特 010010)
【】研究稀硫酸预处理下,酸浓度、固液比、处理时间及温度对杂交狼尾草木质纤维素降解效率的影响,分析稀硫酸对木质纤维素降解的作用机理,并筛选最佳预处理工艺。以杂交狼尾草为研究对象,以H2SO4浓度(0.5%、1.0%、1.5%、2.0%、2.5%)、固液比(1﹕6、1﹕8、1﹕10、1﹕12、1﹕14)、时间(15、30、45、60、90 min)和温度(80、100、110、120、125℃)4个单因素进行试验,每个因素取5个水平,3次重复,分析单因素对固体分解率、纤维素降解率、半纤维素降解率、木质素脱除率及水解糖的影响。在单因素试验基础上,采用4因素2水平的L8(24)正交试验确定主要影响因素,并对最佳工艺条件预处理下的杂交狼尾草进行SEM分析和XRD分析。单因素试验结果表明,各因素下半纤维素降解率均高于木质素降解率。其中,硫酸浓度的增加使纤维素和半纤维素的降解率增加,木质素脱除率降低;由纤维素水解产生的葡萄糖产量也随着浓度的增加而增加,但木糖含量逐渐降低;低浓度的硫酸(0.5%—1.5%)促进杂交狼尾草固体物质降解消化,继续增加硫酸浓度(>1.5%)杂交狼尾草的固体降解无显著变化。固液比对各指标的影响差异较小,固液比增加至1﹕10时,固体分解率、半纤维素和木质素脱除均达到最大。预处理时间的长短对固体分解率、半纤维素和木质素的降解影响不明显,但促进半纤维素降解和葡萄糖生成。温度对固体分解率、纤维素、半纤维素和木质素的降解及水解糖产量的影响效果明显,100℃是重要的临界温度,有效降解木质纤维素需要温度达100℃以上。正交试验结果表明,影响半纤维素降解的因素依次为:温度-浓度-时间-固液比。稀硫酸预处理后杂交狼尾草木质纤维素结构塌陷,非纤维物质被显著脱除,纤维束裸露(SEM);纤维素结晶聚合度增加(XRD)。稀硫酸预处理杂交狼尾草主要降解半纤维素,对木质素的降解效果较差。温度是最主要的影响因素,其次为酸浓度。4 因素影响下的最佳工艺条件为:浓度1.5%,固液比1﹕6,时间15 min,温度120℃。
杂交狼尾草;木质纤维素;稀硫酸预处理;最佳工艺
0 引言
【研究意义】木质纤维素生物质具有可再生性、低污染性、广泛分布性、资源丰富和碳中性的特点,是重要的可再生能源之一[1-4]。利用木质纤维素生产清洁能源,如甲烷、乙醇,不仅能够缓解目前能源紧张问题,而且对环境污染小。木质纤维素清洁能源的生产极具开发前景[5-6],近年来备受关注,但生产成本还相对较高,其中一个关键的原因是预处理技术不成熟。预处理可以破坏木质纤维素结构,改变原材料的组成成分、聚合度、结晶度等,使酶的可及性增加,以加快降解速度[7]。【前人研究进展】关于木质纤维素的降解,化学方法仍是目前暴露细胞壁纤维素最有效的方法之一[8-10],而酸预处理主要是对半纤维素进行水解,使其从细胞壁中脱离,增加纤维素酶对纤维素的可及性,从而进行后期糖化反应[11]。在酸预处理过程中,酸的种类、浓度、温度、固液比及反应时间不同均会对木质素的降解效果产生极大影响[12-13],根据试验材料、降解效率、试验过程中能耗及废液处理等情况,具体的试剂浓度、固液比、反应时间及温度等也不同[6,14-15]。硫酸是一种常用的酸预处理试剂[15-16]。美国国家可再生能源实验室曾研制了一种先进的稀酸预处理反应器处理玉米秸秆,其反应条件为:155—185℃,硫酸浓度1%—2%,固液比1﹕2[17];LEE等[18]指出稀酸预处理一般采用0.5%—5%的硫酸(或其他酸),反应温度为121—220℃。SIEVERS等使用1% H2SO4对玉米秸秆在165℃下预处理10 min,其木糖产量最高,木质纤维素降解效果良好[19]。王晓娟等[20]指出稀酸预处理木质纤维素通常在高温(120—200℃)和高压(103—520 kPa)条件下进行反应(30—120 min)。BALLESTEROS等[21]用稀硫酸预处理朝鲜蓟时发现硫酸浓度和温度对木糖得率有较大影响,而固体浓度的影响不明显。很显然,不同植物木质纤维素对稀硫酸预处理的浓度、温度、时间等因素的要求不同。【本研究切入点】由于木质纤维素的天然结构复杂,各种类的木质纤维素结构又不尽相同,造成预处理技术也需要相应改变。杂交狼尾草再生性好,是木质纤维素丰富的能源草,近年来被广泛种植[22],是制备生物能源和化学品的极具潜力的原料[23]。【拟解决的关键问题】本研究以杂交狼尾草为研究材料,利用稀硫酸进行预处理,并对不同的稀硫酸浓度、固液比、消化时间和消化温度进行单因素分析,找出可以降解杂交狼尾草的最佳工艺条件,并分析影响其降解的主要屏障。
1 材料与方法
1.1 材料
杂交狼尾草(×)于2017年10月从北京市农林科学院小汤山基地获取,风干样品去杂后切短至2—4 cm,混匀装入自封袋中带回实验室备用。预处理样品粉碎过1 mm筛。105℃烘干测定干物质含量。
1.2 试验方法
1.2.1 稀硫酸预处理单因素试验 采用硫酸浓度、固液比、时间和温度4因素5水平的单因素试验,每个处理重复3次(表1)。步骤如下:称取10 g样品及相应体积的H2SO4,装入500 mL三角瓶中,置于立式高压蒸汽灭菌器中。预处理结束后用纱布过滤,滤液装入50 mL离心管低温(-20℃)保存用于葡萄糖和木糖的测定;残留物用自来水冲洗至中性,在恒温鼓风干燥箱40—60℃烘干备用。
1.2.2 稀硫酸预处理正交试验 为优化预处理的工艺条件,研究酸浓度、固液比、时间和温度4个单因素对杂交狼尾草降解效果影响的主次顺序。在单因素试验基础上,各单因素选取两种最有效的因子水平进行L8(24)正交试验,选取的因子水平详见表2。

表1 杂交狼尾草稀硫酸预处理单因素试验设计
表2 杂交狼尾草硫酸预处理L8(24)正交试验表
1.3 测定指标及方法
1.3.1 化学成分 中性洗涤纤维(neutral detergent fiber, NDF)、酸性洗涤纤维(acid detergent fiber, ADF)、木质素(lignin):参照VAN SOEST[24]所述方法,采用foss半自动纤维素分析仪进行测定。杂交狼尾草的化学成分见表3。计算方式如下:
木质素(%)=(提取ADF后经72%硫酸处理并干燥的残渣重量-粗灰分)/(样品重×干物质含量)×100
纤维素(%)=(ADF重量-提取ADF后经72%硫酸处理并干燥的残渣重量)/(样品重×干物质量含)×100
半纤维素(%) = NDF(%)-ADF(%)

表3 杂交狼尾草的化学成分含量
1.3.2 葡萄糖和木糖含量 采用高效液相色谱法(LC1200-HPLC, Agilent Technologies Co. Ltd., Santa Clara, California, US)分析葡萄糖和木糖的浓度。分析条件如下,色谱柱:Agilent糖柱,流动相:乙腈-水(80﹕20),检测器:示差折光检测器,检测器温度:25℃,柱温:30℃,压力:40 MPa,进样量:10 µL,流速1 mL·min-1[6]。
1.3.3 SEM和XRD分析 扫描电镜图谱(scanning electron microscope, SEM)使用S-530电子显微镜扫描(Hitachi S-530, Hitachi manufacturing Co, Tokyo, Japan),X射线衍射图谱(X-ray diffraction, XRD)使用X'Pert Pro MPD 测得(X'Pert Pro MPD, PANalytical B.V. Co, Netherlands)。
1.4 数据分析
单因素试验采用SPSS 19.0 one-way ANOVA分析(显著水平为0.05),Sigmaplot 10.0作图;正交试验采用了极差和综合平衡法相结合的分析方法。
2 结果
2.1 稀酸预处理下单因素对杂交狼尾草固体分解率的影响
固体分解率反映纤维素、半纤维素、木质素及其他杂质的去除情况,是评价预处理效果的综合指标。稀硫酸预处理下,随着酸浓度的增加,杂交狼尾草固体分解率呈先增后减趋势。低浓度的硫酸(0.5%—1.5%)促进杂交狼尾草固体物质降解消化,继续增加硫酸浓度(>1.5%)使杂交狼尾草的降解无显著变化(图1)。
固液比增加,杂交狼尾草的固体分解率先增后减。1﹕10时最高为44.27%(<0.05),其他处理间差异不显著(>0.05)。
处理时间增加时固体分解率没有一定的增减趋势,相关关系不确定。处理30 min固体分解率最大,显著高于15、45和90 min,与60 min 差异不显著;除30 min外,其他处理的时间相互之间差异不显著。说明稀硫酸处理时间的长短对固体分解率的影响不明显。
温度增加,固体分解率显著增加,增温至120℃之后,固体分解率开始降低。从80℃到100℃时,固体分解率增加2.74倍,从110℃增温至120℃,固体分解率增加1.24倍。
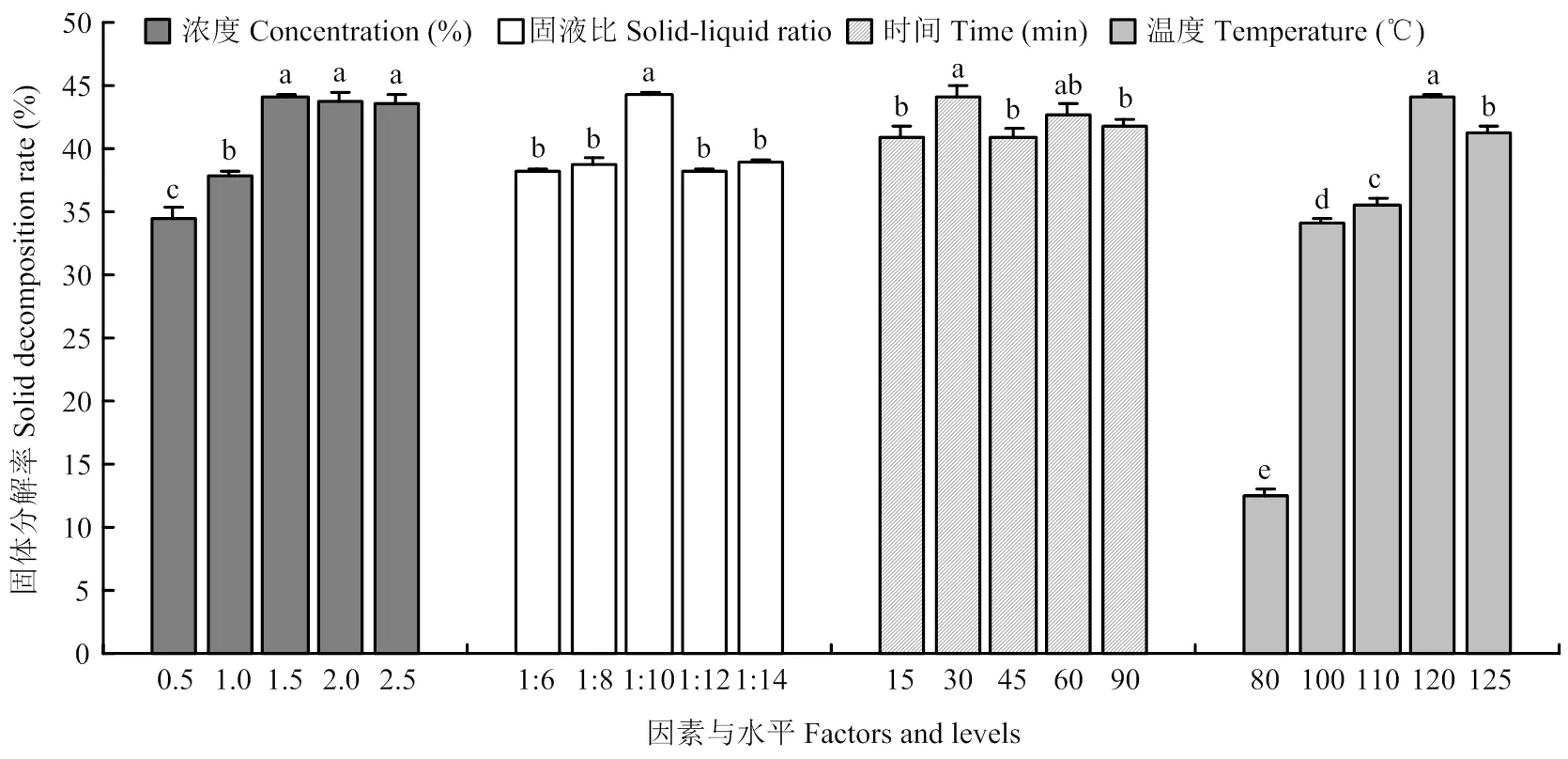
图中不同小写字母表示相互之间差异显著(P<0.05)。下同
2.2 稀酸预处理对杂交狼尾草木质纤维素降解率的影响
如图2所示,不同浓度硫酸预处理杂交狼尾草时,半纤维素的降解率程度最大(图2-A);纤维素降解率最低。随着硫酸浓度的增加,纤维素和半纤维素的降解率逐渐增加,木质素脱除率逐渐降低。硫酸浓度在0.5%—1.0%时,纤维素降解率变化显著(<0.05);0.5%—1.5%时,半纤维素降解率增加显著(<0.05),超过1.5%后,纤维素和半纤维素降解率变化都不显著(>0.05)。
稀硫酸预处理下,不同固液比对杂交狼尾草降解率的影响表现如图2-B。不同固液比条件下,半纤维素的降解程度都最大,经预处理的半纤维素含量低于5%(原材料为27.65%)。稀酸条件下,纤维素降解率和木质素的脱除率在1﹕10时均最大,且显著高于其他处理(<0.05);其他处理间的纤维素降解率差异不显著,1﹕6、1﹕8和1﹕12之间的木质素脱除率差异不显著(>0.05)。半纤维素降解在1﹕14时最高,显著高于1﹕6和1﹕12,但与1﹕8、1﹕10之间差异都不显著,各处理间半纤维素增减幅度不超过5.84%。稀硫酸预处理下半纤维素降解效率最大,其次为木质素,但不同固液比对半纤维素的降解影响差异不大。
稀硫酸预处理下,不同处理时间对杂交狼尾草降解率的影响表现如图2-C。随着处理时间的增加,半纤维素降解增加幅度最大,降解率在87.34%—94.49%之间,且随着时间的增加而在增加;纤维素降解率为10.67%—16.39%,随着时间的变化没有一定的变化规律;木质素脱除率为0.09%—12.48%,随着时间延长,木质素脱除率降低。15 min和30 min之间差异均不显著,30 min和45 min之间差异显著,45 min后,继续延长处理时间,对半纤维素降解和木质素脱除没有显著影响。预处理后纤维素含量在29.3%—32.3%,半纤维素低于4%,木质素为9.6%—11.3%。不同时间的稀硫酸预处理下,半纤维素降解效率都最大;处理时间的不同对木质纤维素的降解变化不大。
稀硫酸预处理下,不同处理温度对杂交狼尾草降解率的影响如图2-D:温度对纤维素、半纤维素和木质素的降解效果明显,尤其是100℃,使半纤维素降解率增加8.39倍,纤维素降解率增加3.86倍,但木质素脱除率降低。可见,随着温度的增加,纤维素和半纤维素降解率增加,木质素脱除率下降。处理温度超过100℃的预处理,半纤维素含量逐渐降低,且低于7.3%,各处理间差异显著。温度增加,纤维素被降解,含量降低,木质素增加。最大限度地降解木质素和半纤维素的同时,保留纤维素,预处理温度需要超过100℃,但过高也会促进纤维素的降解。

图2 不同浓度H2SO4预处理对杂交狼尾草木质纤维素降解的影响
2.3 稀酸预处理杂交狼尾草对水解糖产量的影响
稀硫酸预处理下,不同单因素处理对杂交狼尾草水解糖的影响表现如表4所示,木糖的浓度(13—20 g·L-1)明显高于葡萄糖(0.3—5 g·L-1),表明在稀硫酸处理下半纤维素更易降解产生木糖,而纤维素降解产生葡萄糖的效果明显低于半纤维素,这与预处理降解半纤维素而保留大量糖类聚合物的目标相吻合。随着酸浓度、处理时间和温度的增加,葡萄糖浓度都呈增加趋势,浓度和温度两个影响因子下,各处理水平间差异显著(表 4)。温度和浓度对葡萄糖产量的影响与这两个单因素下纤维素的降解趋势一致,与处理时间的变化不能相互吻合;固液比增加,葡萄糖产量降低,与纤维素的降解趋势也不同(图 2)。
随着酸浓度、固液比(>1﹕8)、处理时间和温度的增加,木糖浓度逐渐递减。这与半纤维素降解的整体趋势相反。酸浓度大于1.5%、固液比大于1﹕10后,木糖浓度递减差异不显著;15—60 min内,时间变化对木糖产量无显著影响。100℃和110℃之间木糖产量差异不显著,二者显著高于80℃,显著低于120℃和125℃。温度变化对木糖产量影响较大,其次是酸浓度和固液比,时间的影响最小。

表4 稀酸预处理下单因素对水解糖产量的影响
同一列的不同小写字母表示不同处理水平相互之间差异显著(<0.05)
Different lowercase letters in the same column indicate that different treatment levels are significantly different from each other (<0.05)
2.4 正交试验
如表5所示,影响纤维素含量的因素依次为:时间-温度-固液比-酸浓度;影响半纤维素降解的因素为:温度-浓度-时间-固液比。稀硫酸预处理下,半纤维素的降解率高于木质素脱除率,因此以半纤维素的降解为主要目的,根据综合平衡法及单因素试验分析得出1.5%的硫酸处理时半纤维素降解率增加明显,高温有利于半纤维素的脱除,固液比1﹕6和15 min处理组既节约成本又对试验结果影响较小。因此最终确定最优组合为:浓度1.5%,固液比1﹕6,时间15 min,温度120℃。
2.5 XRD图谱和SEM电镜扫描分析
对最佳工艺条件处理下的杂交狼尾草和未处理的杂交狼尾草进行SEM电镜扫描和XRD分析。结果如图3、4所示:稀硫酸预处理后的峰值更尖锐,结晶度变高。未处理的杂交狼尾草纤维素表面粗糙,附着大量非纤维物质;预处理后,外表层的非纤维物质被脱除,纤维束清晰;内表层的纤维素结构发生塌陷,少量纤维素已清晰可见。

表5 稀酸预处理杂交狼尾草正交试验

图3 杂交狼尾草稀硫酸预处理前后的XRD图谱
3 讨论
3.1 稀硫酸预处理下各因子对杂交狼尾草木质纤维素降解的影响
文中4个单因素对稀硫酸预处理杂交狼尾草降解木质素的影响各不相同,其中预处理温度是最主要的影响因素,其次是硫酸浓度,预处理时间和固液比的影响较小。Ballesteros等[21]也指出预处理温度的正效应最强,其次为酸浓度,与本文研究结论一致;但是温度和酸浓度之间还会发生负相互作用从而导致实际反应会有所不同。本研究认为持续增加温度促进半纤维素的降解,而固体分解率则在一定温度范围内增加(<120℃),原因是随着温度的增加木质素脱除率下降,导致固体物质分解下降,但不同植物物种对不同预处理方法的敏感性存在较大差异,还需具体分析[25]。大多数研究认为木质纤维素的降解需要100℃以上的温度[26-28],本研究也证实这一点,温度升至100℃时,固体分解率和半纤维素降解率显著提高,这与Bensah等[28]的研究一致。0.5%的稀硫酸被广泛地应用在其他木质纤维素预处理工艺上[29],而本研究也发现较低浓度的硫酸(0.5%—1.5%)能够有效地促进半纤维素和木质纤维素降解,并保留大部分纤维素。

A:预处理前木质纤维素外表面(×1000);B:预处理前木质纤维素内表面(×600);C:预处理后木质纤维素外表面(×1000);D:预处理后木质纤维素内表面(×600)
理想的预处理技术应该最大限度地脱除木质素并减少多糖(纤维素和半纤维素)的损失,但是由于半纤维素水解糖不能够很好地利用,因此,应尽可能多地脱除半纤维素和木质素而保留纤维素。稀硫酸预处理杂交狼尾草,主要水解半纤维素,半纤维素大部分被降解后,大量木质素仍残留在纤维素表层,但木质纤维素结构已经被破坏,佀胜利和朱忆魁等利用酸预处理其他草类植物时也得出相似的结论[12,30]。一般来说,酸性条件下,木质素少部分脱除,与预处理强度成正比[31-32],但本研究中木质素脱除率却与浓度、处理时间和温度呈反比关系,Gao等在关于稀硫酸预处理荻草时也出现类似现象,同时还指出固液比和处理时间对杂交狼尾草降解的贡献较小[6],与本研究结果一致。
本研究中半纤维素的降解效率远高于纤维素和木质素。一方面是因其本身的结构,纤维素被包裹,可及性低,降解少;另一方面原因是纤维素是线性单糖,具有高度结晶性,不易水解,而半纤维素是杂多糖,是支链,聚合度低,易于水解[33];第三个原因是:酸性条件下氢离子与水形成的H3O+促进半纤维素的增溶,H3O+使半纤维素中糖苷键选择性水解,而在相同条件下,半纤维素的溶出速率高于木质素[25],因此在稀酸预处理条件下,半纤维素降解效率远远高于木质素脱除率。
3.2 稀硫酸预处理下单因素对杂交狼尾草水解糖的影响
对于草本植物,预处理后纤维素和半纤维素的主要水解产物是葡萄糖和木糖。葡萄糖和木糖的含量可以更好地反映预处理对纤维素和半纤维素水解的影响[34]。稀硫酸预处理半纤维素水解产生木糖的效率远大于纤维素水解产生葡萄糖[35]。浓度和温度的增加对纤维素降解产生葡萄糖的量有明显确定的促进作用,而固液比的变化和处理时间的不同对葡萄糖产量的影响关系不确定。胡秋龙等指出硫酸浓度和温度对木糖得率有较大影响,而固体浓度的影响不明显[36],与本研究结论相一致。4个单因素水平的增加使半纤维素降解率都增加,但与木糖产量却成反比关系。这主要是因为纤维素是由无水葡萄糖单元组成的线性单糖,水解直接产生葡萄糖,而半纤维素是杂多糖,降解生成戊糖、己糖和醛酸,在一定条件下,如高酸、高温[26,34]等条件下发生二次反应,己糖分解产生有机酸,戊糖分解为糠醛,糠醛酸也会脱羧分解生成抑制物[9]。因此木糖含量会随着浓度、固液比、时间和温度的变化而转换成其他物质,降低木糖含量。
3.3 稀硫酸预处理对杂交狼尾草结晶度和纤维素结构的影响
稀硫酸预处理后,木质纤维素结构塌陷,大量的纤维素裸露出来,纤维素表层残留少量的木质素和半纤维素。经过稀硫酸预处理的杂交狼尾草XRD特征峰更明显,纤维素聚合密集,结晶度升高,但这并没有阻碍半纤维的脱除,这与吉喆的研究相一致[25]。LI等[37]对芦竹和荻草进行辐射预处理时也发现在木质纤维结构被破坏的同时,纤维素结晶度增加,其原因是预处理后纤维素分子的氢键分裂,各分子链变得松散,导致衍射强度减弱,会使结晶度增大;Gao等[6]的研究也发现同样现象。稀硫酸预处理后,大量半纤维素和少量木质素被溶解掉,纤维素裸露,使纤维素酶可及性大大增加,并将其分解成单糖。SEM图像验证了稀硫酸预处理可以改善木质纤维素的降解。
4 结论
稀硫酸预处理杂交狼尾草可以有效地降解其半纤维素,而对木质素的脱除效果较弱。经稀硫酸预处理后,杂交狼尾草结晶度增大,木质纤维素结构塌陷,非纤维物质被大量脱除,纤维束清晰可见。杂交狼尾草稀硫酸预处理的主要影响因素依次为:温度-浓度-时间-固液比,最佳工艺条件为:浓度1.5%,固液比1﹕6,时间15 min,温度120℃。
[1] 高凤芹. 柳枝稷发酵产甲烷过程中纤维素降解机制及微生物多样性变化[D]. 北京: 中国农业大学, 2015.
GAO F Q. Cellulose hydrolysis mechanism and microbial diversity change during anaerobic digestion of switchgrass for methane[D]. Beijing: China Agriculture University, 2015. (in Chinese)
[2] HOSSEINI K E, DAHADHA S, BAZYAR L A A, AZIZI A, ELBESHBISHY E. Enzymatic pretreatment of lignocellulosic biomass for enhanced biomethane production-A review., 2019, 233:774-784.
[3] ZHENG Y, ZHAO J, XU F Q, LI Y B. Pretreatment of lignocellulosic biomass for enhanced biogas production., 2014, 42(1):35-51.
[4] MÄKELÄ M R, BREDEWEG E L, MAGNUSON J K, BAKER S E, DE VRIES R P, HILDÉN K. Fungal ligninolytic enzymes and their applications., 2016, 4(6):1-13.
[5] RICHA A, NILESH K S, SACHIN K, RAJESH K S. Lignocellulosic ethanol: Feedstocks and bioprocessing., 2019, 165-185.
[6] GAO F Q, YANG F Y, ZHOU H, SUN Q Z, ZHANG Y W, MICHAEL A B. Evaluation of processing technology for(Maxim.) Nakai for ethanol production., 2014, 9(12): e114399.
[7] YANG H Y, SHI Z J, XU G F, QIN Y J, DENG J, YANG J. Bioethanol production from bamboo with alkali-catalyzed liquid hot water pretreatment., 2019, 274: 261-266.
[8] SUMIT K V, YOGENDRA S. Deterministic and stochastic optimization of acid pretreatment for lignocellulosic ethanol production., 2017, 40: 2149-2154.
[9] LEE J W, KIM J Y, JANG H M, LEE M W, PARK J M. Sequential dilute acid and alkali pretreatment of corn stover: Sugar recovery efficiency and structural characterization., 2015, 182: 296-301.
[10] DEMARTINI J D, PATTATHIL S, MILLER J S, LI H J, HAHN M G,WYMAN C E.Investigating plant cell wall components that affect biomass recalcitrance in poplar and switchgrass., 2013, 6(3): 898-909.
[11] SHIMIZU F L, MONTERIRO P Q, GHIRALDI P H C, MELATI R B, PAGNOCCA F C, SOUZA W, ANNA C S, BRIENZO M. Acid, alkali and peroxide pretreatments increase the cellulose accessibility and glucose yield of banana pseudostem., 2018, 115: 62-68.
[12] 佀胜利. 能源植物芒草细胞壁结构组成与糖化发酵关系的研究[D]. 武汉: 华中农业大学, 2015.
SI S L. Characterization of the wall polymer features that affect biomass saccharification and ethanol production in[D].Wuhan: Huazhong Agriculture University, 2015. (in Chinese)
[13] 希默尔. 生物质抗降解屏障-结构植物细胞壁产生物能. 北京: 化学工业出版社, 2010.
HIMMEL M E.. Beijing: Chemical Industry Press, 2010. (in Chinese)
[14] 尤毅娜, 邓红, 孟永宏, 房杰, 郭玉蓉, 张英. 碱性双氧水预处理对苹果渣化学组分和酶解得率的影响. 中国农业科学, 2016, 49(8): 1559-1566.
YOU Y N, DENG H, MENG Y H, FANG J, GUO Y R, ZHANG Y. The impact of alkaline hydrogen peroxide pretreatment on the chemical composition and enzymatic hydrolyzability of apple pomace., 2016, 49(8): 1559-1566. (in Chinese)
[15] IDREES M, ADNAN A, MALIK F, QURESHI F A. Enzymatic saccharification and lactic acid production from banana pseudo-stem through optimized pretreatment at lowest catalyst concentration., 2013, 12(4): 269-281.
[16] MIKULSKI D, KLOSOWSKI G. Efficiency of dilute sulfuric acid pretreatment of distillery stillage in the production of cellulosic ethanol., 2018, 268: 424-433.
[17] SHI S, GUAN W J, KANG L, LEE Y Y. Reaction kinetic model of dilute-acid catalyzed hemicellulose hydrolysis of corn stover under high-solid condition., 2017, 56(39): 10990–10997.
[18] LEE C, ZHENG Y, VANDERGHEYNST J S. Effects of pretreatment conditions and post–pretreatment washing on ethanol production from dilute acid pretreated rice straw., 2015, 137:36-42.
[19] SIEVERS D A, KUHN E M, TUCKER M P, MCMILLAN J D. Effects of dilute-acid pretreatment conditions on filtration performance of corn stover hydrolysate., 2017, 243: 474-480.
[20] 王晓娟, 杨阳, 张晓强, 姜少俊, 宋瑜, 周海辰, 金樑. 木质素与生物燃料生产:降低含量或解除束缚? 中国农业科学, 2015, 48(2): 229-240.
WANG X J, YANG Y, ZHANG X Q, JIANG S J, SONG Y, ZHOU H C, JIN L. To make biofuel: cutting the lignin or loosening lignin’s grip?, 2015, 48(2): 229-240. (in Chinese)
[21] BALLESTEROS I, BALLESTEROS M, MANZANARES P, NEGRO M J, OLIVA J M, SÁEZ F. Dilute sulfuric acid pretreatment of cardoon for ethanol production.2008, 42(1):84-91.
[22] 王文强, 周汉林, 唐军. 狼尾草属牧草研究及利用进展. 热带农业科学, 2018, 38(6): 49-55+78.
WANG W Q, ZHOU H L, TANG J. Research advances on development and utilization of forage ofspp., 2018, 38(6): 49-55+78. (in Chinese)
[23] 王敬枫, 郝茜珣, 侯新村, 张军华. 碱性亚硫酸盐预处理对杂交狼尾草酶水解特性的影响. 林业工程学报, 2018, 3(2): 95-101.
WANG J F, HAO X X, HOU X C, ZHANG J H. Effect of alkaline sulfite pretreatment on enzymatic hydrolysis of hybrid China wolftailgrass., 2018, 3(2): 95-101. (in Chinese)
[24] VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition., 1991, 74(10): 3583-3597.
[25] 吉喆. 稀酸碱预处理过程中植物细胞壁解构研究[D]. 北京: 北京林业大学, 2016.
JI Z. Deconstruction of plant cell wall during dilute acid and alkali pretreatment[D]. Beijing: Beijing Forestry University, 2016. (in Chinese)
[26] 刘荣厚. 燃料乙醇的制取工艺与实例. 北京: 化学工业出版社, 2008.
LIU R H.. Beijing: Chemical Industry Press, 2008. (in Chinese)
[27] GEDDES C C, PETERSON J J, ROSLANDER C,ZACCHI G, MULLINNIX M T, SHANMUGAM K T, INGRAM L O. Optimizing the saccharification of sugar cane bagasse using dilute phosphoric acid followed by fungal cellulases., 2010, 101(6): 1851-1857.
[28] BENSAH E C, MENSAH M. Chemical pretreatment methods for the production of cellulosic ethanol: technologies and innovations., 2013(11): 1-21.
[29] 钟佳, 王刚, 谭力, 孙照勇, 汤岳琴, 木田建次. 稀酸及稀酸-稀碱联合预处理对油菜秸秆酶糖化影响的研究. 中国环境科学学会, 2014: 266-270.
ZHONG J, WANG G, TAN L, SUN Z Y, TANG Y Q, BENTIAN C J. Effects of dilute acid and dilute acid-dilute alkali pretreatment on enzymatic saccharification of rape straw., 2014: 266-270. (in Chinese)
[30] 朱忆魁,徐栩坚,罗伟儒,邓小梅,吴蔼民,李慧玲. 稀酸和稀碱预处理对四种不同生物质资源制备还原糖的影响. 生物资源, 2018, 40(5): 400-404.
ZHU Y K, XU X J, LUO W R, DENG X M, WU A M, LI H L. Effects of dilute acid and alkali pretreatments on reducing sugar production from four different kinds of biomass., 2018, 40(5): 400-404. (in Chinese)
[31] KUMAR L, CHANDRA R, CHUNG P A, SADDLER J. Can the same steam pretreatment conditions be used for the most softwood to achieve good, enzymatic hydrolysis and sugar yields?, 2010, 101(20): 7827-7833.
[32] 周丹丹, 侯庆喜, 刘苇, 冯清. 利用CaO/PAC选择性去除预水解液中木质素. 林产化学与工业, 2016, 36(5): 75-80.
ZHOU D D, HOU Q X, LIU W, FENG Q. Selectively removing lignin from pre-hydrolysis liquor by combined CaO/PAC method., 2016, 36(5): 75-80. (in Chinese)
[33] JÖNSSON L J, MARTÍN C, Pretreatment of lignocellulose: formation of inhibitory by-products and strategies for minimizing their effects., 2016, 199:103–112.
[34] CHEN L L, BERNHARD K, CHITHRA M, ROHIT A, HENRIK V S, MANFRED A, KENNETH P V, BLAKE A S, SEEMA S. Comparison of dilute acid and ionic liquid pretreatment of switchgrass: Biomass recalcitrance, delignification and enzymatic saccharification., 2010, 101: 4900-4906.
[35] 江滔, 路鹏, 李国学. 玉米秸秆稀酸水解糖化法影响因子的研究. 农业工程学报, 2008, 24(7):175-180.
JIANG T, LU P, LI G X. Influencing factors in saccharification of corn stover by dilute sulfuric acid hydrolyzing method., 2008, 24(7): 175-180. (in Chinese)
[36] 胡秋龙, 熊兴耀, 谭琳, 苏小军, 贺应龙, 刘祥华, 易锦琼. 木质纤维素生物质预处理技术的研究进展. 中国农学通报, 2011, 27(10): 1-7.
HU Q L, XIONG X Y, TAN L, SU X J, HE Y L, LIU X H, YI J Q. Advances in pretreatment technologies of lignocellulosic biomass.2011, 27(10): 1-7. (in Chinese)
[37] LI Q M, LI X J, JIANG Y L, XIONG X Y, HU Q L, TAN X H, WANG K Q, SU X J. Analysis of degradation products and structural characterization of giant reed and Chinese silvergrass pretreated by60Co-γ irradiation., 2016, 83: 307-315.
Effects of Dilute Sulfuric Acid Pretreatment on Chemical Composition and Characterization Structure of Hybrid Pennisetum () Lignocellulose
GAO FengQin, JING YuanYuan, DE Ying, WAN QiHao, LIU YingHao, TANA
(Grassland Research Institute, Chinese Academy of Agricultural Sciences, Hohhot 010010)
【】 Study the effects of H2SO4concentration, solid-liquid ratio, treatment time and temperature on lignocellulose degradation efficiency of hybrid pennisetum under dilute sulfuric acid pretreatment, analyze the mechanism of dilute sulfuric acid on lignocellulose degradation, and screen the best pretreatment process.【】 Four single factors: H2SO4concentration (0.5%, 1.0%, 1.5%, 2.0%, 2.5%), solid-liquid ratio (1﹕6, 1﹕8, 1﹕10, 1﹕12, 1﹕14), time (15, 30, 45, 60, 90 min) and temperature (80, 100, 110, 120, 125℃) were tested. Five levels of each factor were selected and repeated three times to analyze the effects of single factor on solid decomposition rate, cellulose degradation rate, hemicellulose degradation rate, lignin removal rate and hydrolyzed sugar. On the basis of single factor experiment, L8(24) orthogonal test with 4 factors and 2 levels was used to determine the main influencing factors, and SEM and XRD analysis were carried out for the hybrid pennisetum under the optimal processing conditions. 【】 The results of single factor test showed that the degradation rate of hemicellulose was higher than that of lignin under all factors. With the increase of H2SO4concentration, the degradation rate of cellulose and hemicellulose increased, and the lignin removal rate decreased; the yield of glucose produced by cellulose hydrolysis increased with the increase of concentration, but the content of xylose decreased gradually. The low concentration of H2SO4(0.5%-1.5%) promoted the degradation and digestion of solid substances of hybrid pennisetum, increased concentration (>1.5%) further did not significantly change the solid degradation. The influence of solid-liquid ratio on each index was small,and when the solid-liquid ratio increased to 1﹕10, the solid decomposition rate, hemicellulose and lignin removal reached the maximum. The pretreatment time had no obvious effect on solid decomposition rate, hemicellulose and lignin degradation, but promoted hemicellulose degradation and glucose production. Temperature has obvious effects on solid decomposition rate, degradation of cellulose, hemicellulose and lignin, and yield of hydrolyzed sugar, and 100℃ is an important critical value, and effective degradation of lignocellulose need temperature above 100℃. The orthogonal test results showed that the factors affecting hemicellulose degradation were temperature – concentration – time – solid - liquid ratio. After pretreatment with dilute sulfuric acid, the structure of lignocellulose collapsed, non-cellulose was removed, cellulose bundles were exposed (SEM), and the degree of crystallization and polymerization of cellulose was increased (XRD). 【】 Hemicellulose was mainly degraded by dilute sulfuric acid pretreatment, but lignin was poorly degraded. Temperature is the most important factor, followed by H2SO4concentration. Under the influence of four factors, the optimum technological conditions are as follows: concentration 1.5%, solid-liquid ratio 1﹕6, time 15 min, temperature 120℃.
hybrid pennisetum; lignocellulose; dilute sulfuric acid pretreatment; optimal conditions

10.3864/j.issn.0578-1752.2020.21.019
2019-05-22;
2020-09-16
国家自然科学基金项目(31802134)、内蒙古自治区科技计划项目(201802082)、中国农业科学院科技创新工程项目(CAAS-ASTIP-IGR 2015-02)
高凤芹,E-mail:gaofq1211@126.com。通信作者塔娜,E-mail:tana_1980@163.com
(责任编辑 林鉴非)

