基于血清NAG、NGAL、LFABP的风险评分模型对老年重度乙肝患者肝肾综合征的预测价值
杨鑫 刘小静 陈云茹 张曦 许娟
尽管我国乙肝患病率呈逐年下降趋势,但其整体流行状况仍然不容乐观,2009 至2013年我国乙肝发病率仍高达80/10 万,死亡率达0.05/10 万,其中肝炎引起的并发症是其主要致死原因[1]。肝肾综合征是重度肝炎发展到肝硬化阶段时出现的以肾功能损伤为主要表现的晚期并发症,在重症肝炎患者中发病率为35~40%,且其病死率高达41.5%[2-3]。而老年患者的肝肾综合征尤为需要警惕,这主要由于老年人感染乙肝病毒后更易发展为重度肝炎,且老年人由于其肾脏生理功能的下降,在重度肝炎中更易受到损害[4-5],此外,有研究显示老年人在抗乙肝病毒治疗过程中更易受到药物引起的肾功能损害[6]。尽管目前已有许多研究报道了肝肾综合征早期诊断标志物的研发进展,但这些指标还有待进一步验证,且对老年人肝肾综合征的预测指标尚未见报道。鉴于此,本研究拟探讨三种新型血清标志物N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D glucosaminidase,NAG)、中性粒细胞明胶酶相关脂质转运蛋白(Neutrophil Gelatinase-Associated Lipocalin,NGAL)及肝型脂肪酸结合蛋白(liver-type fatty acid binding protein,LFABP)对老年重度乙肝患者肝肾综合征的预测价值。
1 资料与方法
1.1 研究对象
选取2018年8月至2019年12月在本科就诊的重型乙肝患者150 名,且根据国际腹水俱乐部制定的诊断指南将其分为肝肾综合征患者44 名及重型乙肝患者106 名,重型肝炎患者纳入标准[7]:①根据我国慢性乙肝防治指南诊断为病毒性肝炎慢性乙型重度;②年龄>60 岁;③肝功能child-Pugh 分级B 以上。排除标准:①其他原因肝炎如胆汁淤积性肝炎或自身免疫性肝炎;②已出现肾功能不全;③使用影响肾功能的药物;④存在其他急慢性感染;⑤合并恶性肿瘤。该研究经医院伦理委员会批准,所有者均签署书面知情同意。
1.2 方法
1.2.1 血清分离及临床资料采集
所有受试者于入院次日清晨空腹采血5 mL,1 500 转/min 离心20 min 分离血清待检。采集患者临床资料包括性别、年龄、血常规、肝肾功能等。
1.2.2 ELISA 检测血清标志物
采用人血清NAG ELISA 试剂盒(上海康朗生物科技有限公司,批号B275503),人血清NGAL ELISA 试剂盒(Bio-Techne 公司,批号:F190418,产地中国上海,生产国美国),人血清LFABP ELISA试剂盒(Hycult 公司,批号:7629389,产地中国上海,生产国新西兰)及Multiskan™FC 酶标仪(美国赛默飞公司,产地中国上海)检测血清NAG、NGAL 及LFABP 水平,每个样品重复三次实验取其平均值。
1.3 统计学方法
使用SPSS 18.0 及GraphPad Prism6.0 软件进行统计学处理,计数资料以n(%)表示,采用χ2检验;计量资料以(±s)表示,两组间用t检验,多组间采用方差分析。采用二分类logistic 回归对候选诊断标志物构建回归模型及综合评分。采用受试者工作特征(Receiver operating characteristic,ROC)曲线分析诊断效能。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
肝肾综合征组患者的血肌酐、总胆红素、胱抑素C、NAG、NGAL、LFABP 均高于重度肝炎组,肝肾综合征组患者的血白蛋白、凝血酶原活动度均低于重度肝炎组,差异有统计学意义(P<0.05),两组患者年龄、性别比例、白细胞计数、血小板计数、球蛋白、丙氨酸转氨酶、天冬氨酸转氨酶比较,差异无统计学意义(P<0.05)。见表1。
表1 两组患者临床资料比较(±s)Table 1 Comparison of clinical data between 2 groups(±s)
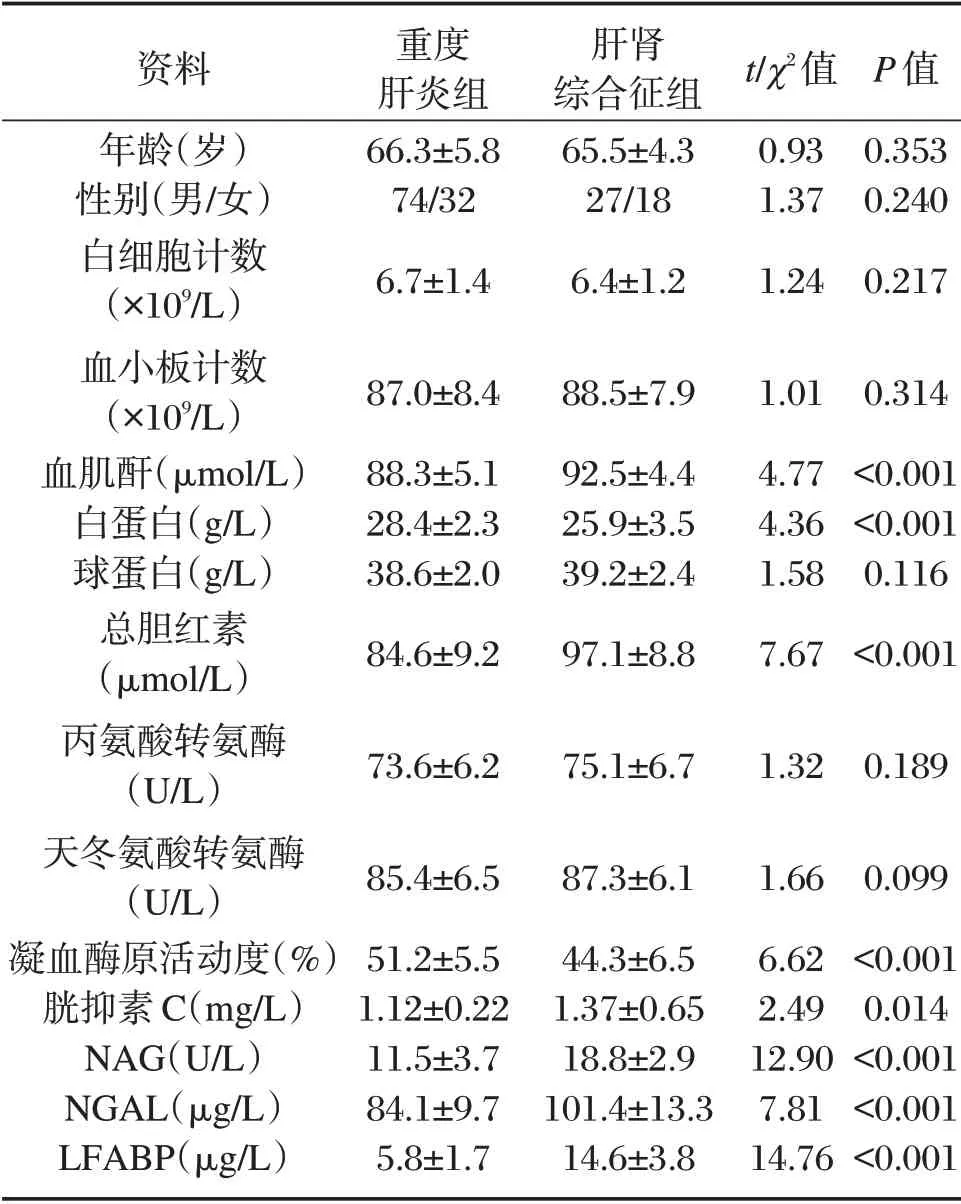
表1 两组患者临床资料比较(±s)Table 1 Comparison of clinical data between 2 groups(±s)
资料年龄(岁)性别(男/女)白细胞计数(×109/L)血小板计数(×109/L)血肌酐(μmol/L)白蛋白(g/L)球蛋白(g/L)总胆红素(μmol/L)丙氨酸转氨酶(U/L)天冬氨酸转氨酶(U/L)凝血酶原活动度(%)胱抑素C(mg/L)NAG(U/L)NGAL(μg/L)LFABP(μg/L)重度肝炎组66.3±5.8 74/32 6.7±1.4肝肾综合征组65.5±4.3 27/18 6.4±1.2 t/χ2值0.93 1.37 1.24 P 值0.353 0.240 0.217 87.0±8.4 88.3±5.1 28.4±2.3 38.6±2.0 84.6±9.2 88.5±7.9 92.5±4.4 25.9±3.5 39.2±2.4 97.1±8.8 1.01 4.77 4.36 1.58 7.67 0.314<0.001<0.001 0.116<0.001 73.6±6.2 75.1±6.7 1.32 0.189 85.4±6.5 51.2±5.5 1.12±0.22 11.5±3.7 84.1±9.7 5.8±1.7 87.3±6.1 44.3±6.5 1.37±0.65 18.8±2.9 101.4±13.3 14.6±3.8 1.66 6.62 2.49 12.90 7.81 14.76 0.099<0.001 0.014<0.001<0.001<0.001
2.2 各因素与肝肾综合征的logistic 回归分析
血白蛋白、凝血酶原活动度、胱抑素C、NAG、NGAL 和LFABP 与肝肾综合征相关,NAG、NGAL和LFABP 为肝肾综合征的危险因素(P<0.05)。见表2。
2.3 风险评分模型诊断肝肾综合征的ROC 曲线
基于三者构建多因素风险评分得到公式:风险评分= 14.35+0.56×NGAL 水平+0.50×LFABP水平+0.46×NAG 水平,NGAL、LFABP、NAG 诊断肝肾综合征的AUC 值分别为0.703(95%CI:0.606~0.799)、0.775(95%CI:0.688~0.861)、0.728(95%CI:0.643~0.812),而风险评分诊断肝肾综合征的AUC 值为0.817(95%CI:0.747~0.887),P<0.005。见图1。
2.4 风险评分模型对肝肾综合征的诊断效能
根据ROC 曲线确定的NGAL、LFABP、NAG及风险评分模型最佳灵敏度和特异度下截断值分别为93.76 μg/L、8.19 μg/L、14.19 U/L 和73.24。NGAL、LFABP、NAG 及风险评分模型诊断肝肾综合征的灵敏度、准确度。见表3。

表2 各因素与肝肾综合征的logistic 回归分析Table 2 Logistic regression analysis of candidate factors and hepatorenal syndrome

表3 风险评分模型对肝肾综合征的诊断效能Table 3 The diagnostic efficacy of risk scoring model for hepatorenal syndrome
3 讨论
重症肝炎患者体内血管舒张因子灭活减少,周围及内脏动脉扩张而肾血管收缩,肾血流量下降造成肾小球滤过率降低是引起肝肾综合征的主要原因。而与此同时,外周循环阻力下降引起有效循环血量减少也是造成肾血流量下降的原因之一。此外,肝病造成的贫血也会加重肾脏微循环缺血缺氧[8]。老年人有效循环血量降低,加之心脏泵血能力下降,肾血流量进一步减少,使得其更易发生肝肾综合征[9]。而当前针对肝肾综合征的发病机制已寻找到多种可能的预测指标,包括胱抑素C、β2-微球蛋白、高敏C 反应蛋白及肾脏损伤因子等[10-11]。
在本研究结果提示患者肝炎严重程度的指标,分别代表了患者肝细胞合成功能及凝血因子灭活功能[12],而血肌酐是提示患者肾功能敏感而特异的指标,尤其值得注意的是本研究纳入的三个新型诊断指标NAG、NGAL、LFABP,NAG 是种人体肾小管上皮细胞特有的一种酸性水解酶,当肾小管上皮细胞受到损害时,细胞内溶酶体膜破裂,大量NAG 释放入血[13]。而NGAL 及LFABP是分别由远曲肾小管和近端肾小管分泌的微量蛋白,在肾脏损伤时血清NGAL 及LFABP 显著升高,因此可用于评估肾功能损伤程度[14-15]。本研究首次通过构建风险评分来诊断肝肾综合征,结果发现NAG、NGAL、LFABP 三者对于肝肾综合征的诊断均有一定价值,而风险评分诊断肝肾综合征的AUC 值高于三个独立指标,可见我们的构建的模型相比三个独立指标而言明显有更高的诊断效能,进一步的诊断试验结果显示,三者对于肝肾综合征诊断的灵敏度均较在70%以上,但特异度欠佳,尤其是NGAL 仅有不足50%的特异度,而本研究构建的风险评分模型在最大限度保证敏感度的基础上较好地提高了诊断的特异度,大大提升了三个新型标志物的临床应用价值。
本研究的不足之处主要在于样本量仍显不足,后续需要进一步扩充样本量得到更为确凿的结论。其次,本研究为单中心研究,存在选择偏移,将来有待多中心合作验证本研究结论。再次,本研究由于样本量较小,未进一步设置验证集,有待扩充样本量后对该模型进行验证。
综上,基于血清NAG、NGAL、LFABP 的风险评分模型对老年重度乙肝患者肝肾综合征有较好诊断效能,有一定临床应用前景。