PCOS患者IL-17A、Betatrophin、可溶性CD68表达水平及与卵巢功能的关系
席彦东 沈自旺 白虹
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)是临床常见的女性内分泌疾病,发病率5%~10%[1]。研究指出,PCOS 可增加2 型糖尿病、心血管疾病、以及子宫内膜癌的发生风险,严重影响女性身心健康[2]。PCOS 相关病理生理机制研究较多,但目前尚无定论,其中慢性炎症因子与疾病的发生发展密切相关,白细胞介素-17A(Interleukin-17A,IL-17A)被证实在PCOS 患者体内表达增加,可促进疾病进展[3]。可溶性CD68(Soluble CD68,sCD68)作为单核/巨噬细胞的特异性表面分子标志物,在卵巢型子宫内膜异位症的发生发展中发挥重要作用[4]。此外,Betatrophin 是一种新发现的影响糖脂代谢的因子,被认为有调节脂代谢、改善糖耐量的双重作用,在PCOS 患者体内表达升高[5]。基于此,本研究尝试分析PCOS 患者选取IL-17A、Betatrophin、sCD68 表达水平及与卵巢功能的关系,旨在为临床治疗本病提供数据支持。
1 资料与方法
1.1 一般资料
选取2016年4月至2019年4月银川市第一人民医院妇科102 例PCOS 患者作为研究组,另选同期48 例健康体检者作为对照组。纳入标准:①研究组均符合PCOS 诊断标准[6],对照组均为体检结果正常者;②自主行为能力良好,能配合完成研究;③近2 个月内未使用过激素类药物、胰岛素和降脂类药物;④月经周期规律;⑤知晓本研究,已签署同意书。排除标准:①精神疾病患者;②恶性肿瘤患者;③血液系统疾病患者;④全身感染性疾病患者;⑤合并卵巢早衰、子宫畸形、宫腔粘连、甲状腺功能异常等疾病者;⑥严重心脑肝肾功能不全者。
1.2 方法
研究组均参照相关指南[7]行促排卵治疗,持续治疗3 个月后根据获卵数评估卵巢反应,控制性促超排卵周期卵数≤5 个为卵巢低反应,获卵数>5 个为卵巢正常反应。治疗前,于月经来潮后2~5 d,采集研究对象空腹静脉血6 mL,以3 500 rpm 转速离心处理5 min,取血清标本置于-70℃冷藏室待检,采用双抗体夹心酶联免疫吸附法检测血清IL-17A、Betatrophin、sCD68 水平,试剂盒分别购自苏州浩欧博生物医药有限公司、辽宁迈迪生物科技有限公司、湖南省丽拓生物科技有限公司,检测操作均按照试剂盒说明书进行。
1.3 观察指标
①研究组与对照组血清IL-17A、Betatrophin、sCD68 水平。②研究组不同卵巢反应患者临床资料及血清IL-17A、Betatrophin、sCD68 水平,临床资料包括年龄、初潮年龄、病程、结婚时间、性生活史、不孕年限、流产史、初潮月经紊乱、家族遗传史、BMI、胰岛素抵抗指数(Homa-insulin resistance,HOMA-IR)、血清黄体生成素(Luteinizing hormone,LH)/卵泡刺激素(Follicle stimulating hormone,FSH)、抗缪勒管激素(Anti-Müllerian hormone,AMH),HOMA-IR=空腹血糖×空腹胰岛素/22.5;取血清标本,采用化学发光免疫分析法检测血清LH 及FSH 水平,试剂盒购自深圳迈瑞生物医疗电子股份有限公司,计算LH/FSH 值;采用酶联免疫吸附法检测血清AMH 水平,试剂盒购自辽宁迈迪生物科技有限公司。③探究血清IL-17A、Betatrophin、sCD68、临床指标与卵巢反应性的相关性,及血清IL-17A、Betatrophin、sCD68 与临床指标的相关性。
1.4 统计学方法
采用SPSS 22.0 软件进行数据处理,计量资料以(±s)表示,采用t检验,计数资料以n(%)表示,采用χ2检验,通过Logistic 进行多因素回归分析,采用Pearson 进行相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
对比两组年龄、初潮年龄、性生活史、体质量指数(Body Mass Index,BMI)、吸烟和饮酒情况,比较,差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of 2 groups of general data[n(%),(±s)]

表1 两组一般资料比较[n(%),(±s)]Table 1 Comparison of 2 groups of general data[n(%),(±s)]
注:饮酒定义:每日饮白酒≥2 两或啤酒≥2 瓶,每周饮酒≥1 次;吸烟定义:每天抽烟≥1 支,连续吸烟时间>6月。
项目年龄(岁)初潮年龄(岁)性生活史(年)BMI(kg/m2)吸烟t/χ2值1.528 1.197 1.096 1.502 0.388 P 值0.129 0.233 0.275 0.135 0.533是否饮酒0.558 0.270是否研究组(n=102)31.15±4.35 13.48±1.61 5.39±1.09 25.91±1.77 26(25.49)76(74.51)20(19.61)82(80.39)对照组(n=48)29.86±5.71 13.15±1.49 5.61±1.26 25.46±1.58 10(20.83)38(79.17)7(14.58)41(85.42)
2.2 研究组与对照组血清IL-17A、Betatrophin、sCD68 水平
研究组血清IL-17A、Betatrophin、sCD68 水平较对照组高,差异有统计学意义(P<0.05),见表2。
表2 两组血清IL-17A、Betatrophin、sCD68 水平比较(±s)Table 2 Comparison of serum IL-17A,Betatrophin and sCD68 levels between the 2 groups(±s)
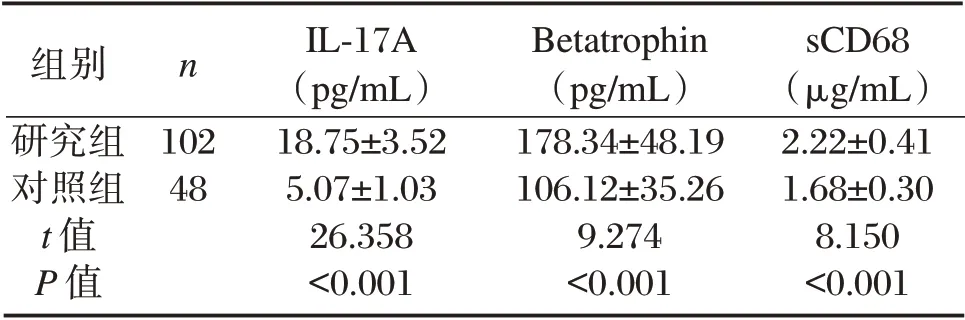
表2 两组血清IL-17A、Betatrophin、sCD68 水平比较(±s)Table 2 Comparison of serum IL-17A,Betatrophin and sCD68 levels between the 2 groups(±s)
组别研究组对照组t 值P 值n 102 48 IL-17A(pg/mL)18.75±3.52 5.07±1.03 26.358<0.001 Betatrophin(pg/mL)178.34±48.19 106.12±35.26 9.274<0.001 sCD68(μg/mL)2.22±0.41 1.68±0.30 8.150<0.001
2.3 不同卵巢反应患者临床资料
不同卵巢反应性患者HOMA-IR、血清LH/FSH、AMH 水平相比,差异有统计学意义(P<0.05),见表3。
表3 不同卵巢反应患者临床资料[n(%),(±s)]Table 3 Clinical data of different ovarian responses[n(%),(±s)]
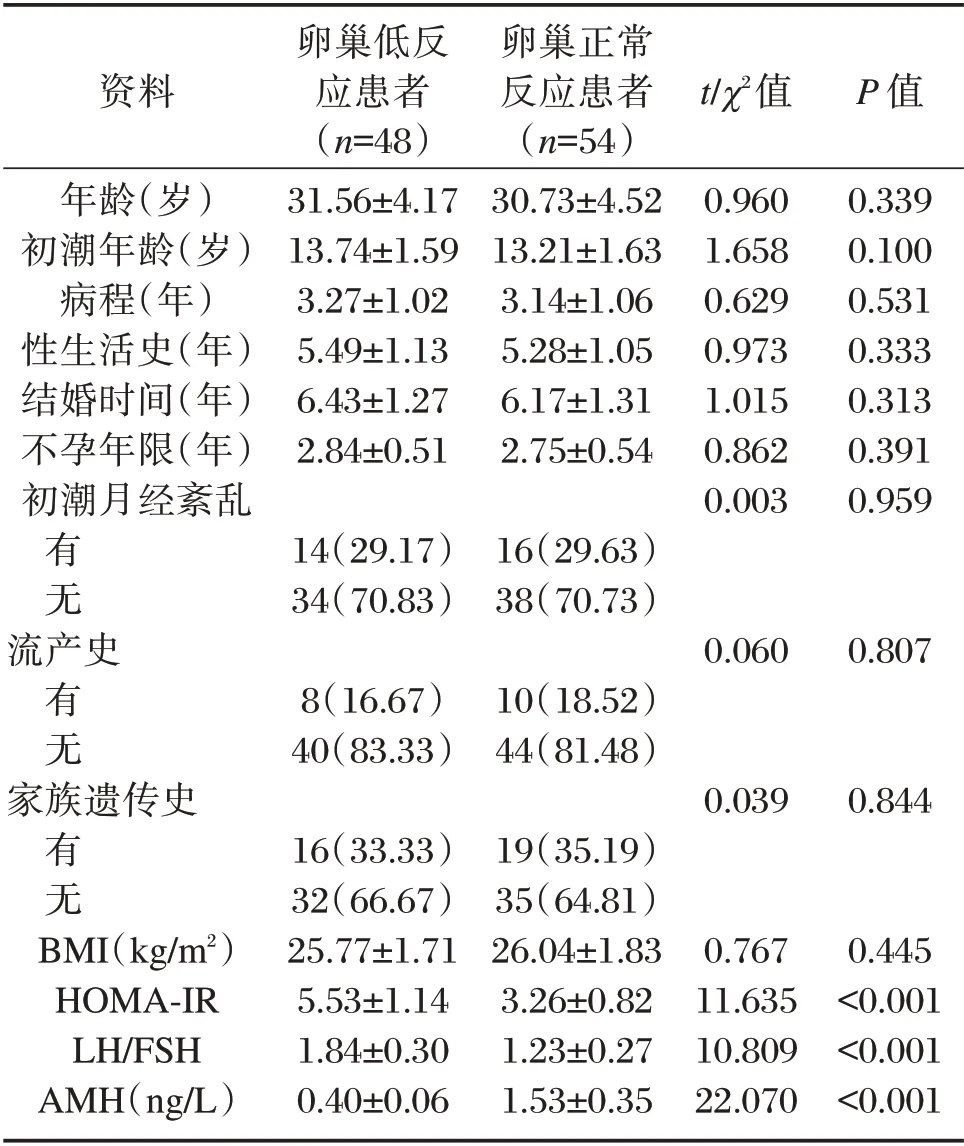
表3 不同卵巢反应患者临床资料[n(%),(±s)]Table 3 Clinical data of different ovarian responses[n(%),(±s)]
资料t/χ2值P 值年龄(岁)初潮年龄(岁)病程(年)性生活史(年)结婚时间(年)不孕年限(年)初潮月经紊乱0.960 1.658 0.629 0.973 1.015 0.862 0.003 0.339 0.100 0.531 0.333 0.313 0.391 0.959有无流产史0.060 0.807有无家族遗传史0.039 0.844有无BMI(kg/m2)HOMA-IR LH/FSH AMH(ng/L)卵巢低反应患者(n=48)31.56±4.17 13.74±1.59 3.27±1.02 5.49±1.13 6.43±1.27 2.84±0.51 14(29.17)34(70.83)8(16.67)40(83.33)16(33.33)32(66.67)25.77±1.71 5.53±1.14 1.84±0.30 0.40±0.06卵巢正常反应患者(n=54)30.73±4.52 13.21±1.63 3.14±1.06 5.28±1.05 6.17±1.31 2.75±0.54 16(29.63)38(70.73)10(18.52)44(81.48)19(35.19)35(64.81)26.04±1.83 3.26±0.82 1.23±0.27 1.53±0.35 0.767 11.635 10.809 22.070 0.445<0.001<0.001<0.001
2.4 不同卵巢反应患者血清IL-17A、Betatrophin、sCD 68 水平
卵巢低反应患者血清IL-17A、Betatrophin、sCD68 水平较卵巢正常反应患者高差异有统计学意义(P<0.05),见表4。
表4 不同卵巢反应患者血清IL-17A、Betatrophin、sCD68 水平比较(±s)Table 4 Comparison of serum IL-17A,Betatrophin and sCD68 levels in patients with different ovarian reactions(±s)
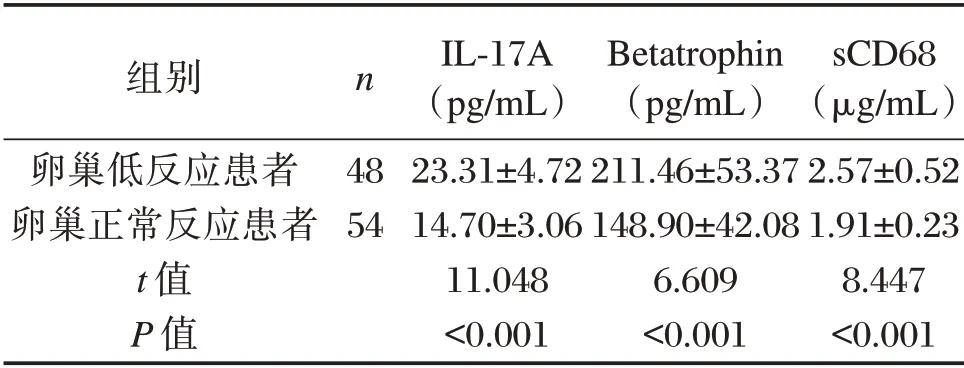
表4 不同卵巢反应患者血清IL-17A、Betatrophin、sCD68 水平比较(±s)Table 4 Comparison of serum IL-17A,Betatrophin and sCD68 levels in patients with different ovarian reactions(±s)
组别卵巢低反应患者卵巢正常反应患者t 值P 值n 48 54 IL-17A(pg/mL)23.31±4.72 14.70±3.06 11.048<0.001 Betatrophin(pg/mL)211.46±53.37 148.90±42.08 6.609<0.001 sCD68(μg/mL)2.57±0.52 1.91±0.23 8.447<0.001
2.5 血清IL-17A、Betatrophin、sCD68、临床指标与卵巢反应性的关系
Pearson 相关性分析显示,血清IL-17A、Betatrophin、sCD68、HOMA-IR、LH/FSH 与卵巢反应性呈负相关,AMH 与卵巢反应性呈正相关(P<0.05),见表5。

表5 血清IL-17A、Betatrophin、sCD68、临床指标与卵巢反应性的关系Table 5 Relationship between serum IL-17A,Betatrophin,sCD68,clinical indicators and ovarian reactivity
2.6 血清IL-17A、Betatrophin、sCD68 与临床指标的关系
Pearson 相关性分析,血清IL-17A(r=0.524、0.725、0.514)、Betatrophin(r=0.695、0.632、0.597)、sCD68(r=0.328、0.485、0.540)与HOMA-IR、LH/FSH、AMH 呈正相关(P<0.05),见图1。
2.7 多元线性逐步回归分析
多元线性逐步回归分析,将HOMA-IR、LH/FSH、AMH 等其他因素控制后,血清IL-17A、Betatrophin、sCD68 仍与卵巢反应性显著相关(P<0.05),见表6。
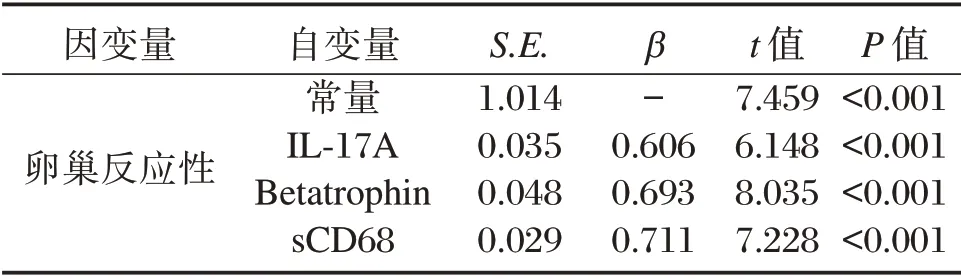
表6 多元线性逐步回归分析Table 6 Multiple linear stepwise regression analysis
3 讨论
PCOS 受基因遗传和环境因素的共同影响,发病机制复杂,文献报道证实,PCOS 患者多数处于一种低度慢性炎症状态,炎症与胰岛素抵抗相互影响,最终共同促进了PCOS 的发生与发展[8-9]。本研究发现,PCOS 患者血清IL-17A 表达水平明显高于健康体检者,提示PCOS 患者处于慢性炎症状态,与上述研究结论一致。IL-17A 水平升高可直接或间接诱导多种细胞因子、趋化因子、炎症因子和抗微生物蛋白识别介导自身免疫和慢性炎症反应,炎症反应增强可促进胰岛素抵抗,从而参与PCOS 的发生。研究指出,巨噬细胞广泛分布在女性生殖系统如胎盘、乳腺、子宫、卵巢等组织中,作为免疫系统中能够导致炎症的细胞,其可释放多种炎性因子[10]。CD68 主要在单核细胞、巨噬细胞、粒细胞等细胞中表达,被认为是巨噬细胞最可靠的标记物,广泛应用于检测人体组织中存在的巨噬细胞[11-12]。本研究发现,PCOS 患者血清sCD68水平处于高表达状态,提示血清sCD68 表达升高可能参与PCOS 的发生。本研究还发现,Betatrophin在PCOS 患者血清中呈异常高表达状态,也可能参与PCOS 的发生。Betatrophin 由Yi P 等[13]于2013年在胰岛素抵抗小鼠模型中首次发现并命名,认为胰岛素抵抗可诱导肝脏合成、分泌Betatrophin。且新近研究显示,Betatrophin 可能通过抑制脂肪酶活性,调节脂代谢,从而促进PCOS 患者体内的脂代谢紊乱,参与PCOS 的发生发展[14]。
本研究进一步通过相关性分析发现,血清IL-17A、Betatrophin、sCD68 与HOMA-IR、LH/FSH、AMH 呈正相关,其中HOMA-IR 是反映机体胰岛素抵抗的重要措施,LH/FSH、AMH 是反映卵巢功能的主要指标,因此我们认为通过检测血清IL-17A、Betatrophin、sCD68 表达情况可在一定程度上反映PCOS 患者胰岛素抵抗及卵巢功能,有助于判断患者病情。促排卵是临床治疗PCOS 的主要方法之一,治疗前需结合患者具体情况,如病情、卵巢储备功能等,制定治疗方案,以提高卵巢对治疗的反应性,保障卵子回收效率。本研究发现,PCOS 患者血清IL-17A、Betatrophin、sCD68、HOMA-IR、LH/FSH、AMH 均与卵巢反应性存在密切相关性,且在控制了HOMA-IR、LH/FSH、AMH等其他因素后,血清IL-17A、Betatrophin、sCD68 仍与卵巢反应性显著相关,提示血清IL-17A、Betatrophin、sCD68 表达水平升高反映出PCOS 患者存在卵巢低反应性,治疗效果可能较差,应积极调整治疗方案,以改善治疗效果。