抗tau 蛋白抗体基因疗法对慢性颅脑创伤的治疗作用研究
柴慈婧 涂悦 张启财 侯伊玲
慢性颅脑创伤(chronic traumatic encephalopathy,CTE)是由中枢神经系统(central nervous system,CNS)重复性创伤引起的继发性神经退行性疾病[1,2]。在临床上CTE 与行为认知和情绪变化有关,包括冲动、暴力、抑郁和烦躁不安,并最终导致认知和记忆障碍[2]。目前尚无用于CTE 的疗法,尽管抗tau 蛋白(tau protein,pTau) 抗体系统性给药治疗已在CTE小鼠模型上取得成功,但由于血-脑屏障限制了全身性给药抗体到达大脑的数量小于给药剂量的0.5%,导致这种策略在人类中不太可能成功[3,4]。Sigurdsson[5]在临床研究中发现抗pTau 系统性给药并不能有效地治疗阿尔茨海默病。为规避血-脑屏障,本研究假设将编码抗pTau 抗体基因的腺病毒相关病毒(adeno-associated virus,AAV)载体直接进行CNS 治疗,可以介导抗pTau 抗体在脑内的表达,从而通过抗pTau 抗体抑制CTE 患者pTau 的积累。
材料与方法
一、实验动物与主要材料
6 月龄野生型C57BL/6 雄性小鼠80 只,体质量(30.0±2.5)g,购自北京维通利华实验动物技术有限公司(SCXK-(军)2012-0004)。将实验小鼠置于动物房内分开的鼠笼中,饲养在清洁级动物房,控制室内温度(20±3)℃和湿度50%±20%,每日提供充足的水和食物。本研究按照国家卫生研究院指导进行护理和使用动物,并经过武警后勤学院附属医院动物伦理委员会批准(批号:201912004)。
编码抗pTau 单克隆PHF1 的AAVrh.10PHF1,编码抗pTau 单克隆抗体2B6 的AAVrh.102B6,编码抗pTau 单克隆IPN007 的AAVrh.10IPN,编码抗pTau 单克隆Cis-Tau33 的AAVrh.10CisTau,腺病毒相关病毒AAVrh.10 衣壳AAVrh.10Null (济南思科生物科技有限公司);兔抗小鼠pTau 单克隆抗体,兔抗小鼠β-actin 单克隆抗体(abcam 公司,美国);IHC抗原修复液(北京中杉金桥公司)。
二、小鼠CTE 模型及分组
1.CTE 模型制作:本研究参考Zhang 等[6]自制了一种皮质撞击器,通过撞击可以诱导大脑pTau 水平增加。实验开始第1 天,使用2%的异氟烷麻醉小鼠,备皮,将小鼠俯卧放置于立体定位框架内,头部固定在耳棒上,垫上2 cm 厚的E 型泡沫垫以造成加减速的伤害。每天更换泡沫垫,以确保所有冲击的数据相似。使撞击器尖端垂直于头骨,位于矢状平面和左眼半球的眼睛和耳朵之间的冠状线的交点相距左方3 mm,后方2.2 mm。将冲击执行器速度设置为3 m/s,停留时间100 ms,连续5 d,每天撞击2 次(间隔6 h)。每天撞击前都进行神经系统严重程度评分(neurological severity score,NSS),NSS>1 分的小鼠淘汰,给予安乐死。上述研究的实验过程中,没有小鼠的NSS 评分>1 分,或出现需要安乐死的严重并发症。
2.CTE 模型评估:随机选取24 只C57 小鼠按随机数字表法分为3 组,每组8 只,正常对照组(sham组)、CTE 4 周组和CTE 12 周组。其中sham 组小鼠不做撞击处理,安乐死取脑组织;CTE 4 周、12 周组小鼠皮质打击致伤法构建CTE 模型并于实验4 周和12 周安乐死取脑组织用于评估CTE 模型。
3.抗pTau 基因治疗:余56 只C57 小鼠按随机数字表法分为7 组,每组8 只,正常对照组(sham组),无载体基因对照组(noAAV 组),无编码基因对照组(AAVrh.10Null 组)、编码2B6 基因的抗pTau抗体组(AAVrh.102B6 组)、编码CisTau 基因的抗pTau 抗体组(AAVrh.10CisTau 组)、编码IPN007 基因的抗pTau 抗体组(AAVrh.10-IPN 组)和编码PHF1 基因的抗pTau 抗体组(AAVrh.10PHF1 组),其中sham 组小鼠不做撞击处理,其余6 组小鼠通过皮质撞击法构建CTE 模型并采用NSS 评估神经功能,6 组CTE 模型小鼠在实验第3 周时神经功能组间比较差异没有统计学意义(F=0.800,P=0.556)。在实验第3 周时sham 组与noAAV 组注射等量人工脑脊液,其余各组小鼠分别在海马区注射对应编码基因的表达载体。所有小鼠在实验第4 周时安乐死,取脑组织进行下一步研究。
三、AAVrh.10 载体制备
AAVrh.10 病毒衣壳包含5’到3’的AAV2 5’反向末端重复序列(inverted terminal repeat,ITR)、包装信号、CMV 增强子、鸡β-肌动蛋白启动子与剪接供体、兔β-球蛋白内含子与剪接受体、不同抗体的cDNA、后接兔β-球蛋白polyA 信号以及AAV2 3’ITR。通过参考相关文献,获得了PHF1、2B6、IPN007和CisTau 的cDNA 序列,合成每个序列并克隆到pUC57 载体中。将抗体的盒编码区和人IgG4 重链和人Ig Kappa 恒定区亚克隆到pAAV 质粒中进行载体生产。使用PEI 转染试剂将表达质粒和AAVrh.10 packaging-Ad 辅助杂交质粒pPAK-MArh.10 共转染到293T 细胞中[7,8]。转染后72 h,收获细胞并使用5 个冷冻/融化循环制备裂解物。以2000 g 离心15 min取上清,通过碘克沙醇梯度和阴离子交换色谱法从粗病毒裂解物中纯化载体,并用Bio-max 100K 膜浓缩器浓缩。在pH 7.4 的磷酸盐缓冲盐水中,-80℃储存。最终产生了5 个不同编码序列的载体,包括编码抗pTau 单克隆PHF1 的AAVrh.10PHF1,编码抗pTau 单克隆抗体2B6 的AAVrh.102B6,编码抗pTau单克隆IPN007 的AAVrh.10IPN007,编码抗Tau 单克隆Cis-Tau33 的AAVrh.10CisTau,AAVrh.10Null(与其他载体相同,但没有基因编码序列)[7,9-12]。
将纯化的AAVrh.10 载体在0.5%十二烷基硫酸钠、25 mmol/L 乙二胺四乙酸乙酯存在下,于70℃用蛋白酶K 消化1 h,然后在95℃灭活蛋白酶15 min。然后将该载体用作TaqMan 分析的模板,使用已知拷贝数的AAV 质粒DNA 标准品生成标准曲线评估载体浓度,最后通过蛋白质印迹分析在体外评估抗pTau 抗体结合pTau 的能力[13]。
四、AAVrh.10 抗pTau 载体的治疗
实验开始第3 周,将抗pTau AAV 载体[AAVrh.10Null 和AAVrh.10 anti-Tau (PHF1、2B6、IPN007、CisTau)]分别直接注射到CTE 小鼠双侧海马中。通过2%异氟烷吸入麻醉小鼠,并准备碘伏酒精消毒,准备手术。布比卡因(0.25%溶液)0.1 mL 局部麻醉,并立即腹腔注射丁丙诺啡(0.5 mg/kg)以进行镇痛。小鼠头部用耳棒固定,并固定在立体定位仪上,鼻锥维持麻醉。切开头部皮肤,除去骨膜,在颅骨上开一个小孔,与立体定位注射点相对应,以前囟为坐标原点,向小鼠双侧海马内注射,坐标如下:向外1.7 mm,向后1.2 mm,硬脑膜下方1.7 mm。将33 号针头的Hamilton 710 系列注射器(1~5 μL)固定在立体定向仪的注射泵上,针头缓慢进入目标结构,停留1 min,向双侧海马区分别注射载体(每个部位2 μL,速度0.5 μL/min),注射后,针头停留2 min 以减少回流,然后缓慢撤回。注射后,缝合皮肤,观察小鼠麻醉恢复及神经系统并发症。实验开始第4 周,将小鼠安乐死,灌注后取脑,左侧大脑进行Western 印迹分析,右侧大脑进行免疫荧光染色。
五、免疫荧光染色
在实验的各时间段将安乐死的小鼠取右侧大脑,然后在4%多聚甲醛固定。将脑标本进行处理并保存为石蜡块,切成5 μm 厚切片。将含有不同冠状切片的脑切片进行去石蜡化处理,在88℃下用IHC抗原修复液处理20 min,然后使用Super Block Blocking Buffer-Blotting PBS 缓冲系统封闭液4℃封闭过夜。一抗pTau 抗体与20%PBST(1∶1000)稀释孵育2 h,将切片在TBST 中洗涤4 次,并与20%TBST中按1∶1000 稀释的HRP 标记的链霉亲和素偶联孵育30 min。使用底物Im-mPACT 载体红色碱性磷酸酶底物检测免疫反应性,并在4',6-二脒基-2-苯基吲哚(4',6-Diamidino-2-phenylindole,DAPI)溶液中复染孵育2 min。将载玻片盖上盖玻片。使用莱卡TCS SP5 共焦成像系统检测CNS 样品中的pTau。通过在514 nm 处激发和在560 nm 处发射来对AP 基板进行可视化,并使用ImageJ 软件对获得的图像进行分析。测量每个冠状切片的阳性像素百分比,并标准化为相应冠状切片的阴性对照,定量数据表示为染色的总面积与测量的总面积的百分比。
六、Western blot 印迹分析
取小鼠左侧大脑,用1×RIPA 缓冲液超声处理脑组织终浓度为1∶100 的蛋白酶抑制剂混合物。将样品在4℃下以15 000 g 离心40 min,将上清液用于Western blot 研究。使用BCA 蛋白质测定试剂盒(上海碧云天生物技术公司)测量每个样品的总蛋白质量。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,半干转移至聚偏二氟乙烯膜。将膜在4℃下用含10%脱脂奶粉的TBST 缓冲盐水封闭1 h,然后在含一抗的10%脱脂奶粉的TBST 缓冲液过夜:兔抗pTau 13 抗体(1∶1000)兔抗β-actin 抗体(1∶1000)。TBST 冲洗4 次,然后将膜与辣根过氧化物酶偶联的IgG 抗兔(1∶10 000)二级抗体孵育2 h,TBST 冲洗4 次,ECL plus 用于信号检测,Image J 软件用于定量分析。
七、Morris 水迷宫实验
实验第24~28 天,通过Morris 水迷宫实验观察小鼠抗pTau 治疗后学习记忆功能的恢复情况。直径120 cm、高50 cm 的水迷宫,放满水,控制水温25℃左右。在第一象限面下1 cm 深设置平台。将小鼠分别从水池4 个象限放入水池中,开始计时,观察记录小鼠从不同象限放入后找到平台的时间,即逃避潜伏期时间。实验结果选择noAAV 组和AAVrh.10Null组作为对照组,选择效果最佳的治疗组作为水迷宫实验统计的数据。
八、统计学分析
采用SPSS17.0 软件处理实验数据,Graphpad prism 5 软件绘图,Western blot 及免疫荧光数据以均数±标准差()表示,两两比较行t 检验,组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
结果
一、小鼠CTE 模型评估结果
CTE 4 周组、CTE 12 周组小鼠脑组织pTau 蛋白的相对表达量较sham 组均明显增加,差异具有统计学意义(t=7.536,P<0.001;t=6.584,P<0.001),但是CTE 4 周组与CTE 12 周组之间差异没有统计学意义(t=0.223,P=0.827)(图1)。

图1 脑组织pTau 蛋白的相对表达量
二、抗pTau 抗体基因载体AAV 治疗抑制CT小鼠pTau 积累
与noAAV 组相比,sham 组pTau 蛋白相对水平明显降低,AAVrh.10PHF1 组和AAVrh.10IPN 组处理的小鼠均显示出明显的pTau 蛋白抑制,差异均具有统计学意义(t=8.306,P<0.001;t=6.763,P<0.001;t=5.297,P<0.001)。与noAAV 组相比,AAVrh.10Null组pTau 蛋白水平没有明显区别,AAVrh.102B6 组和AAVrh.10CisTau 组并不能显著降低pTau 水平,差异均不具有统计学意义(t=0.087,P=0.932;t=1.524,P=0.150;t=1.303,P=0.214)。AAVrh.10PHF1 组较AAVrh.10IPN 组治疗效果更好,差异具有统计学意义(t=2.379,P=0.032)。详细信息见图2。
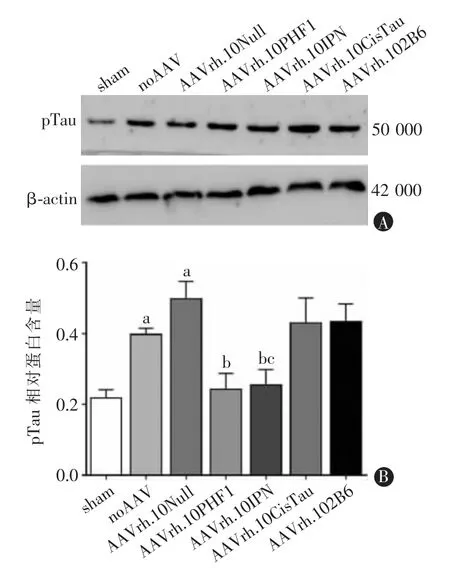
图2 抗pTau 抗体基因载体AAV 治疗后pTau 蛋白相对表达量
三、AAVrh.10PHF1 治疗显著抑制小鼠脑皮层中pTau 的水平
免疫荧光对照研究显示,AAVrh.10PHF1 处理显著降低了小鼠脑皮层中pTau 的水平,而AAVrh.10Null 组和noAAV 组在整个皮质中显示出大量的pTau 累积(图3A)。pTau 蛋白免疫荧光量化结果显示,AAVrh.10Null 组和noAAV 组pTau 蛋白水平较sham 组明显增多,差异均具有统计学意义(t=9.458,P<0.001;t=14.150,P<0.001);而AAVrh.10PHF1 组pTau 蛋白水平明显少于AAVrh.10Null 组和noAAV组,差异均具有统计学意义(t=6.983,P<0.001;t=9.648,P<0.001);AAVrh.10Null 组与noAAV 组相比差异无统计学意义(t=0.648,P=0.528),AAVrh.10PHF1 组与sham 组相比差异有统计学意义(t=5.201,P<0.001)(图3B)。
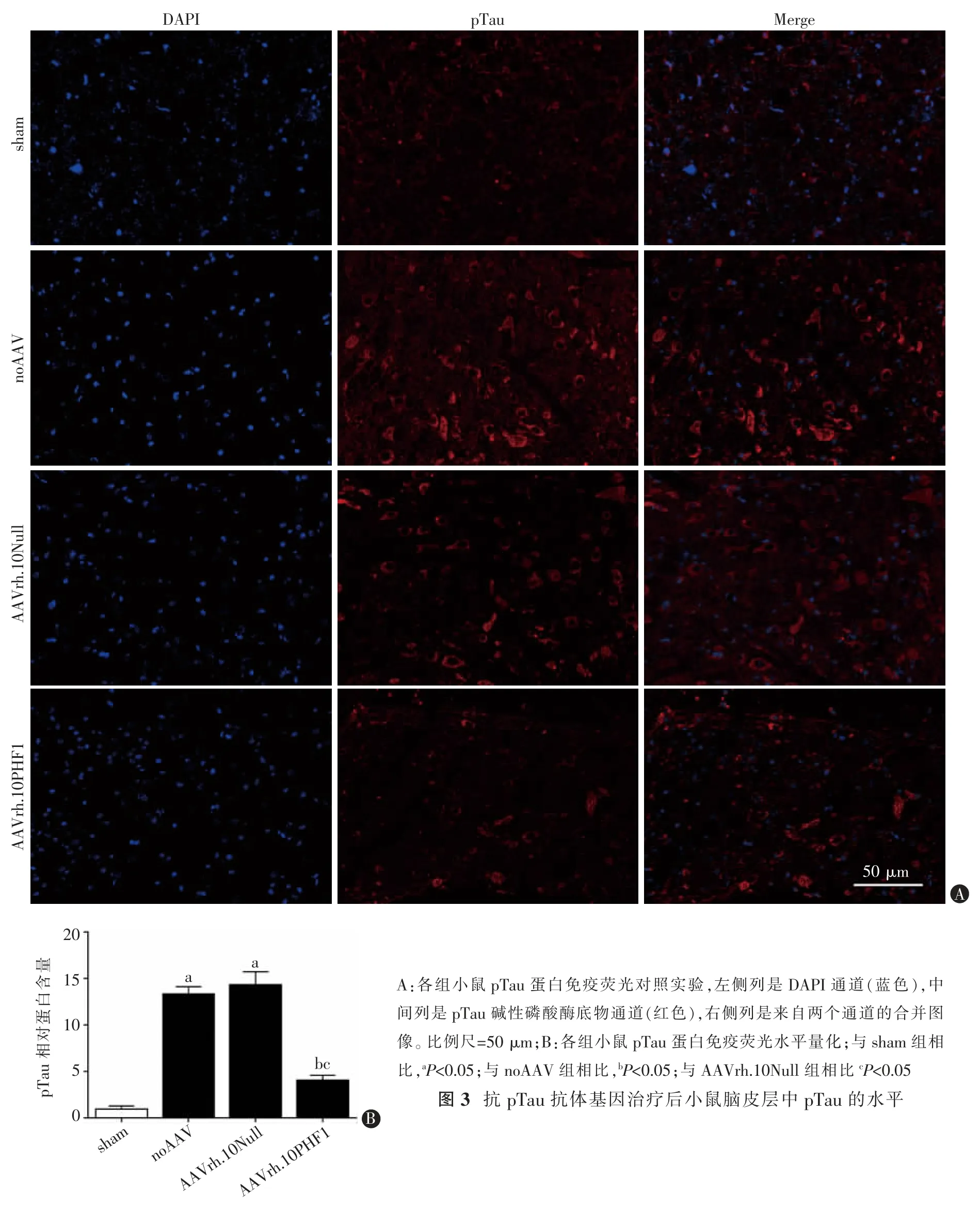
图3 抗pTau 抗体基因治疗后小鼠脑皮层中pTau 的水平
四、3 组小鼠水迷宫逃避潜伏期时间比较
3 组小鼠24、25、26 d 时逃避潜伏期时间差异无统计学意义(P>0.05),在27、28 d 时差异有统计学意义(P<0.05),AAVrh.10PHF1 组逃避潜伏期时间较noAAV 组和AAVrh.10Null 组更短,小鼠能够更快地找到平台(表1)。
讨论
CNS 反复创伤容易导致CTE,其是一种进行性的神经退行性疾病,以CNS 中pTau 水平升高为特征,目前尚无有效的治疗方法[14]。本研究推测在CNS中表达抗pTau 单克隆抗体的基因可起到清除pTau的作用,而且也能够消除CTE 发病机制中的中心病理生物学过程。本研究使用rh.10 血清型AAV 直接干预CNS,将抗pTau 单克隆编码序列转移至CNS,有效地清除了CNS 中的pTau,结果表明这是治疗该疾病的一种可能的、有效的治疗方法,而且这种方法避免了抗pTau 抗体全身给药被血-脑屏障限制进入大脑的影响[15]。
表1 3 组小鼠水迷宫逃避潜伏期比较(,s)

表1 3 组小鼠水迷宫逃避潜伏期比较(,s)
与noAAV 组相比,aP<0.05;与AAVrh.10Null 组相比,bP<0.05
CTE 发病机制的当前概念表明,重复性创伤会引起慢性炎症,继而介导tau 的磷酸化异常,从而导致tau 缠结和神经元的逐渐丧失[16,17]。目前已经有了几种治疗CTE 的研究策略,包括:(1)通过使用抑制性激酶防止其磷酸化来中断pTau 积累[18];(2)使用药物阻断引起炎症和炎症诱导的下游信号通路[19];(3)增加神经元微管的稳定度[20];(4)抗氧化剂在TBI事件发生后赋予神经保护作用[21];(5)用干细胞诱导CNS 修复[22];(6)采用高压氧疗法增加脑组织氧合[23]。Albayram 等[24]研究证明,在CTE 鼠模型中抗pTau单克隆抗体的全身给药抑制了CNS 中pTau 水平的升高。尽管Albayram 等[24]研究的数据对CNS 的抗体疗法具有重要意义,但是在人体研究中很可能只有不到0.5%的全身性治疗抗体能够到达CNS,这也是尝试用全身性抗pTau 单克隆抗体治疗阿尔茨海默病和CTE 的挑战[5,25]。
在考虑通过中断与CNS 致病过程的策略来治疗CTE 时,有可能会针对与重复性CNS 创伤相关的CNS 炎症,但是CNS 炎症过程非常复杂,尚不清楚哪种炎症成分占主导地位[16,26]。本研究对CTE 治疗的重点是针对慢性炎症以及pTau 的积累,pTau的积累是导致tau 缠结发展的主要过程,最终导致神经元失活和认知障碍[27,28]。但是,由于CTE 的炎症是慢性的并持续在创伤后很长的时间,需要持续的治疗才能起到有效的作用[29]。基于AAV 的基因疗法可以持续表达转载的基因,尽管可能无法解决上游炎症反应,但是抗pTau 的治疗方法却是目前有用方法。在本研究的CTE 小鼠模型中,重复性颅脑创伤后pTau 在神经元的积累最早在第4 周时就能够被检测到,并在此后的3 个月内一直处于较高水平。基于这种CTE 模型,本研究通过AAVrh.10 载体测试了4 种不同的抗pTau 单克隆抗体基因,直接通过载体将基因转移至CNS,并且发现,由AAVrh.10PHF1和AAVrh.10IPN 介导的抗tau 抗体的表达均显著降低了由TBI 导致的pTau 累积。PHF1 是靶向pTau 磷酸丝氨酸396 和404 的小鼠IgG1 抗体,而IPN 是通过靶向tau N 端的少量残基起作用的人源化IgG4抗体[9,30]。对于TBI 鼠模型,磷酸化tau 蛋白上的特异性抗体靶位点或抗体的同种型均不是疗效的决定因素。但是PHF1 表现出比IPN 更佳的疗效,因此本研究决定继续使用pTau 特异性PHF1 抗体进行进一步的研究。
AAVrh.10PHF1 疗法有潜力成为治疗CTE 早期的影响并逆转患者的神经病理学表现的方法。虽然通过直接在海马施用抗pTau 治疗载体对小鼠CTE模型进行了功效研究,但是由于CTE 患者已经遭受了脑部创伤,因此在脑实质性内递送AAV 载体可能会带来额外且不必要的风险。根据本研究对AAV 的CNS 基因治疗的研究,AAVrh.10 载体有可能可以通过脑池内途径安全给药,并在整个CNS 中广泛表达,这为临床CTE 治疗提供了新的方向。
利益冲突所有作者均声明不存在利益冲突

