创伤修复用丝素蛋白敷料的研究进展
吴建兵 夏娟


摘要: 敷料的出现为加快创伤修复过程、缓解病人疼痛带来了希望,然而敷料本身的材料来源、制备工艺、理化性能及与药物的相互作用对创伤修复的效果至关重要。丝素蛋白安全性高、生物相容性好、易塑形、可根据敷料的要求灵活设计丝素蛋白材料。文章比较了各类创伤修复用丝素蛋白敷料,包括丝素蛋白膜、水凝胶、支架、纳米纤维膜的性能特点、优势及在创伤治疗过程中存在的不足。另外,从细胞外基质的微环境出发,讨论了双层复合膜、纤维 凝胶,微球 支架等新型丝素蛋白复合敷料的研究进展,总结了其所存在的问题及需努力的方向。
关键词: 丝素蛋白;敷料;创伤;修复;组织工程
中图分类号: TS102.1
文献标志码: A
文章编号: 10017003(2020)10002905
引用页码: 101106
DOI: 10.3969/j.issn.1001 7003.2020.10.006(篇序)
Research progress of silk fibroin dressings for wound healing
WU Jianbing, XIA Juan
(School of Textile Garment and Design, Changshu Institute of Technology, Suzhou 215500, China)
Abstract:
The emergence of dressings brings hopes for speeding up the healing process and alleviating pains in patients. However, the material source, preparation process, physical and chemical properties of the dressing and interactions with drugs are very important to the effect of wound healing. Silk fibroin exhibits high safety, excellent biocompatibility, easiness for shaping, and silk fibroin materials can be flexibly designed according to dressing requirements. In this paper, all kinds of silk fibroin dressings for wound healing are compared in this paper, including property characteristics, advantages and defects of silk fibroin film, hydrogel, scaffold and nanofiber membrane. In addition, the research progress of new composite silk fibroin wound dressings involving double layer composite film, fiber gel and microsphere scaffold are discussed from the microenvironment of extracellular matrix, and the existing problems and effort directions are summarized.
Key words:
silk fibroin; dressing; wound; healing; tissue engineering
收稿日期: 20200303;
修回日期: 20200916
基金项目: 江苏省高等学校自然科学面上基金项目(19KJB430006);国家自然科学青年基金项目(51903019);大学生创新创业计划项目(XJDC2019313);常熟理工学院科研启动基金项目(KYZ2018028Q)
作者简介: 吴建兵(1990),男,讲师,主要从事丝蛋白生物医用材料的研究。
皮肤是人体抵御外界微生物入侵及细菌感染的第一道屏障。外力、高温、化学腐蚀及自身代谢疾病是皮肤创伤的主要原因,使人饱受痛苦折磨的同时增加医疗负担[1]。皮肤创伤治疗,尤其是慢性難愈性创伤,及时有效地愈合非常重要,而伤口修复涉及止血、炎症反应、细胞增殖分化和组织重塑四个阶段[2],如图1所示[3]。其中,止血和预防创面感染是皮肤创伤修复的首要前提。绷带、纱布、棉垫等传统敷料可作为伤口的物理保护层,然而该类敷料干燥、难以控制伤口微环境水分、易黏附在新生肉芽组织上,在更换时易发生损伤,造成疼痛,甚至会影响创伤愈合[4]。理想的敷料需满足保持创伤湿润的微环境要求外,还应具有抗菌性、透气性、吸附性和不易黏附等特性[5]。目前,药物递送系统敷料将活性物质(抗菌药物、生长因子)装载在不同形式的载体敷料中,通过细胞反应促进伤口愈合,是最具治疗潜力的生物活性敷料。药物递送系统敷料按其材料来源可分为天然、天然改性及合成三大类。天然高分子材料相比于其他两种的独特优势在于:首先,材料毒副作用小,使用安全性高;其次,材料本身易塑形,为开发满足创伤修复用的功能性敷料创造了有利的条件;最后,自身降解产物能够被细胞信号识别,作为细胞生长、增殖及组织再生的营养成分[6]。目前壳聚糖[7]、透明质酸[8]、海藻酸盐[9]、明胶[10]、胶原[11]、丝素蛋白[12]等,作为创伤修复用敷料材料来源而受到重点关注。
蚕丝富有光泽,手感细腻柔软,已经作为手术缝合线广泛应用在生物医学领域中,具有优异的可降解性和安全性。在过去的几十年中,各种蚕丝品种,包括丝素蛋白[12]、丝胶蛋白[13]、天然蜘蛛丝[14]和重组蚕丝蛋白[15]等已被广泛用于创伤修复用敷料的研究。蚕丝主要是由丝素蛋白和丝胶蛋白构成。丝素蛋白包含重链、轻链和P 25蛋白三种结构,其中重链内94%的氨基酸序列是由甘氨酸 丝氨酸 丙氨酸构成的高度重复的结晶区,是丝素蛋白形成稳定β折叠构象的根本原因[16]。脱胶纯化后的丝素蛋白水溶液的可塑性强,能形成薄膜、水凝胶、纳微米球、微胶囊、静电纺纳米纤维、多孔支架等材料[17]。丝素蛋白优异的细胞相容性对细胞迁移、增殖和血管生成有良好的促进作用,并受到了人们的广泛赞誉[12]。为了发挥丝素蛋白特有的生物学特性优势,近年来作为人工皮肤替代物和具有生物活性的伤口敷料已经被陆续开发,并成为创伤快速修复新的策略。
本文将综述各类创伤修复用丝素蛋白敷料的应用现状,以及从细胞外基质的微环境出发,开发加快创伤愈合的新型敷料的研究进展,着重讨论创伤修复用丝素蛋白敷料的优势、所存在的问题与未来需要努力的方向。
1 丝素蛋白敷料的研究现状
1.1 丝素蛋白膜
丝素蛋白膜的制备工艺简单(流延法、浇筑法),成膜大小、厚度和孔隙大小等性能参数易调控,可为灵活设计满足创伤修复用敷料的要求创造有利条件[17]。Liu等[18]验证了再生丝素蛋白膜对人VEGF基因的L 929细胞无毒性,并且对细胞粘连、生长和凋亡均没有不良作用,可作为人造皮肤替代品。尽管具备优良的细胞相容性,但是未能通过模拟动物创伤修复试验进一步验证丝素蛋白膜的有效性。另外,直接浇筑形成的丝素蛋白膜质坚、易脆且稳定性差,需通过后处理(水蒸气、甲醇)来解决,也可与其他材料混合制备成膜。Gu等[19]将壳聚糖与丝素蛋白通过藻酸盐二醛(ADA)交联制备得到吸水率和透气性均满足创伤敷料要求的共混膜。该研究尽管解决了单一丝素蛋白膜存在的问题,但是由于创伤敷料缺乏胶原形成所需的生长因子,不利于创伤修复,尤其是慢性难愈性伤口。对蚕腺进行基因改造,得到含有生长因子功能化的蚕丝,以此方法促进伤口愈合是可行的。Bienert等[20]将成纤维细胞生长因子(FGF)、表皮生长因子(EGF)、角质细胞生长因子(KGF)、血小板生长因子(PDGF)或血管内皮生长因子(VEGF)功能化的丝素蛋白膜与不含生长因子的丝素蛋白膜进行了比较,研究发现所有丝素蛋白膜均具有良好的细胞相容性。在体外伤口愈合试验中,与纯丝素蛋白膜、KGF或PDGF功能化的丝素蛋白膜相比,当用EGF、FGF或VEGF功能化的絲素蛋白膜覆盖时,伤口显示了更高的愈合能力。因此,通过基因工程方法制备生长因子功能化的丝素蛋白膜,有望成为未来创伤修复用敷料的备选品。
1.2 丝素蛋白水凝胶
丝素水凝胶是三维空间的水合网络结构,含水率极高(>95%),具有较高的分子通透性和弹性,利用涂布创面的方法,在创伤修复中有显著的优势。首先,可为细胞所需的氧气、营养成分及代谢产物提供交换场所;其次,作为最接近细胞外基质的微环境,有利于细胞迁移、生长和增殖;最后,环境湿润对新生肉芽组织无黏附作用,且易吸收坏死脱落的脓液和组织,减轻患者换药时的疼痛。丝素蛋白溶液可在剪切力(涡旋、震荡、超声)作用下自组装形成凝胶,制备工艺简单,为制备生物活性的伤口敷料创造了条件[17]。利用水凝胶模拟细胞外基质微环境,一直是促进创伤修复研究的关键策略。将成纤维细胞生长因子(FGF)脯氨酸(形成胶原蛋白所需要的氨基酸)与丝素蛋白溶液共混得到热稳定性优异,表面形态良好,溶胀保水性能突出,释放、降解速率可控,生物相容性优异的共混凝胶。相比于其他凝胶基质,具有生物活性的丝素凝胶在创伤组织再生和修复方面的优势突出[21 22]。然而该方法制备凝胶的弹性依然无法满足临床皮肤组织修复的要求。幸运的是,通过弱电场诱导形成的丝素蛋白凝胶已在神经、软骨和骨骼等组织工程修复中得到广泛应用[23]。基于该优势,Karahaliloglu[24]制备了含有姜黄素的丝素蛋白电凝胶(CUR SF e gel),其孔隙率达到80%,溶胀率超过100%,相比于纯丝素凝胶,CUR SF e gel能有效抑制细菌增殖,且对成纤维细胞无毒。因此,CUR SF e gel可以改善伤口愈合,有望用作伤口包扎材料。
1.3 丝素蛋白支架
绝大部分丝素支架可直接通过冷冻干燥的方法获得,孔径可由添加盐颗粒的大小等方法决定。与水凝胶一样,丝素支架也是三维网络结构,自身的多孔结构有利于气液体的交换,可为细胞生长提供空间。根据弹性蛋白是胶原蛋白的主要成分的特点,Vasconcelos等[25]利用天然生物交联剂京尼平将丝素蛋白与弹性蛋白交联冷冻干燥后,获得小孔径、低溶胀率、低释放速率和降解速率的多孔支架(SF/EL)。通过烧灼诱导标准化烧伤创面并评估其对伤口愈合的效果,发现丝素蛋白/弹性蛋白复合支架在创面中的上皮组织形成最快,伤口愈合同样最快。因为皮肤组织内蛋白质和多糖所含成分较多,有利于维持细胞的各项生理活动。为了进一步模拟细胞外基质微环境,Feng等[26]将魔芋葡甘露聚糖(KGM)通过物理交联的方式装载在丝素蛋白支架中(KGM/SF),可通过改变SF/KGM的混合比例来调控支架的多孔结构。令人欣慰的是该支架具有与天然皮肤组织相似的压缩模量,满足伤口处理时对敷料柔韧性的要求。因此,强大的吸水性能、持久的湿润环境、类似于皮肤组织的压缩模量和优异的细胞相容性,使得KGM/SF支架在敷料应用中具有巨大的潜力。加快创伤修复是敷料价值的体现,同样微生物入侵和细菌感染也无法忽视,也是创伤修复最大的挑战之一。支架敷料设计时应充分考虑最大程度减少伤口的细菌感染。Mehrabani等[27]成功地研制出不同含量纳米银颗粒的丝素蛋白/甲壳素纳米复合材料支架,研究发现纳米复合支架不仅具有良好的机械性能和高孔隙率,而且抗菌性和生物相容性优异,是伤口敷料的良好候选者。
1.4 丝素蛋白纳米纤维膜
将丝素蛋白经过变性剂处理(六氟异丙醇或甲酸)后得到纺丝液在静电纺丝喷头喷出即可获得纳米纤维膜,其理化性能(形态、直径、孔隙)等可通过电压、喷丝头孔径、纺丝液浓度、流动速度或喷头到接收器之间的距离调控。丝素纳米纤维膜的比表面积通常较大,孔隙率可控,具备优良的皮肤亲和力与良好的气液渗透性。Zhao等[28]制备了重组丝蛋白纳米纤维膜(pNSR 16),研究发现纤维平均直径影响因素分别为电压>流动速度>凝固距离;影响纤维均匀度因素分别是流速>凝固距离>电压。另外,电纺膜与流延膜的组成相同,但前者的孔隙率高于后者,达到84.85%,可为细胞气体交换、吸收营养物质和排出代谢产物提供空间。随后用电纺膜对Sprague Dawley大鼠进行创伤治疗,研究发现该创伤敷料能加速创面愈合和碱性成纤维细胞生长因子的表达。Zhang等[29]制备了具有大孔隙率和比表面积的静电纺丝素纳米纤维膜(ESF),然后利用聚多巴胺涂层(PDA)形成PESF膜,相比于ESF膜,PESF膜在膜的亲水性、蛋白质吸附能力及成纤维细胞的增殖等方面更优越。进一步体内组织学分析证实,与ESF膜和市售敷料(3 MTMTegadermTM)相比,PESF膜可在2周内更有效地促进大鼠皮肤伤口中羟脯氨酸(胶原蛋白成分)含量的增加,表明了PESF膜的伤口愈合效果增强。因此,PESF膜作为创伤敷料在创面治愈和皮肤再生中具备一定的使用价值。可将间充质干细胞(MSC)或表皮干细胞(ESC)作为皮肤伤口修复的细胞本源,以保留患者剩余的自体皮肤并减少伤口面积与疼痛。许多研究用MSC作为伤口愈合的治疗细胞,但用ESC进行治疗可以加快伤口修复。除添加治疗性细胞外,敷料的生物力学特性和表面形貌还影响伤口愈合的速度。丝素蛋白(SF)具备促进胶原蛋白再生以加速创面愈合的特性。Huang等[30]用亲水性聚乙烯醇(PVA)制成了丝素纳米纤维膜,再经甲醇处理得到PVA SF敷料(PFSM),可以模拟内源性细胞外基质的结构。在体内,PFSM/ESC在第三天显示肉芽组织再生,伤口闭合百分比为53.49%。因此,预先将干细胞分化成ESC并结合PFSM敷料能够在一定程度上加速体内伤口愈合的速度。Song等[31]将抗菌肽(Cys KR 12)包埋在静电纺丝素纳米纤维膜上,发现Cys KR 12在丝素纳米纤维膜上的包埋密度可以精确控制,且反应产率高。Cys KR 12包埋的丝素蛋白纳米纤维膜对四种病原细菌菌株(金黄色葡萄球菌、表皮葡萄球菌大肠杆菌和铜绿假单胞菌)均表现出抗菌活性。另外,它还促进了角质形成细胞和成纤维细胞的增殖,角质形成细胞的分化,并增强了细胞间的附着。Yang等[32]将具有抗炎、抗菌及促进组织生长功效的麦卢卡蜂蜜(MH)通过静电纺丝制备了包埋不同含量的MH丝素蛋白纳米纤维膜(MH/SF),MH的添加保持MH SF优异生物相容性的同时提高了其抗菌活性。此外动物试验数据表明,MH/SF复合纳米纤维膜在改善伤口愈合方面表现出优异的性能,可能是伤口包扎有前途的医用敷料。
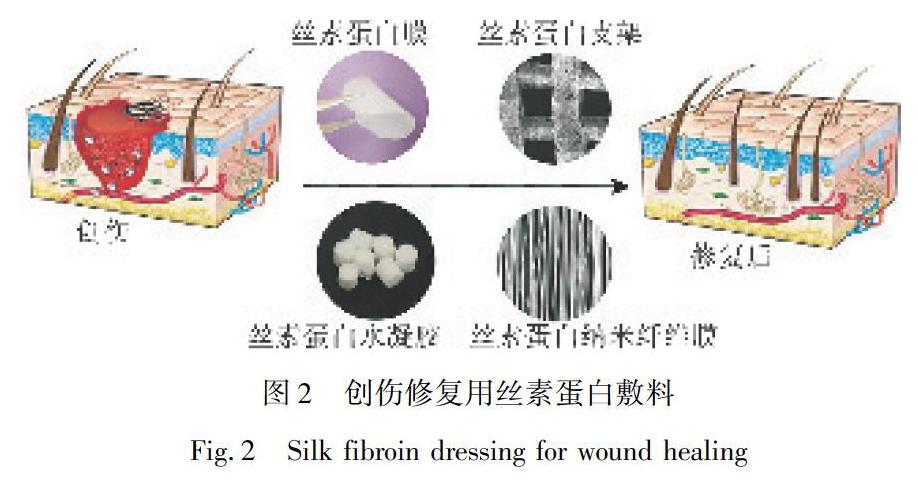
尽管上述的丝素蛋白材料在创伤修复中的应用取得了明显的突破,如图2所示,但是依然存在很多限制。例如,丝素蛋白膜难以清除伤口中坏死的组织和脓液,使得上皮组织再生受阻;丝素蛋白水凝胶的力学性能较差,降解的过程中易崩塌,可能会误认为伤口的再次感染;丝素蛋白支架除了黏附性能差以外,其降解速率与皮肤组织再生的速率也不协调;丝素蛋白纳米纤维膜在制备过程中需要添加剧毒的六氟异丙醇,存在毒性。另外,丝素蛋白具有大量的非极性氨基酸,单一的丝素敷料远不能满足创伤修复的要求,例如亲水性、抗菌性、材料本身的力学性能及难愈性创伤的持久性治疗等。伤口的性质和愈合过程非常复杂,具有生物活性的单层药物递送敷料远不能满足创伤修复的要求。双层复合敷料由两种材料组合而成,可实现多种功能,例如抗菌消炎的同时可快速吸收脓液,减少更换敷料的次数,促进创伤的高效修复。
2 新型丝素蛋白敷料的研究进展
2.1 雙层丝素蛋白复合膜敷料
如今新型的具有改进性能的伤口敷料正在开发中,其中不对称膜由于其模仿皮肤表皮和真皮层的两层结构而引起了越来越多的关注。为此,Miguel等[33]使用静电纺丝技术制备了新的不对称膜,如图3所示。顶层由丝素蛋白(SF)和聚己内酯制成,以再现表皮的致密性质和防水能力。另一方面,用丝素蛋白和负载有百里酚(THY)的透明质酸来制备真皮样底层。试验数据表明,所制备的静电纺不对称膜的孔隙率、润湿性、机械性能及生物相容性满足创伤修复的要求,真皮样底层含THY可改善其抗氧化和抗菌性能。因此,双层不对称丝素蛋白膜在伤口愈合中具备不言而喻的使用价值。
2.2 丝素蛋白纤维 凝胶复合敷料
羊水(AF)中含有高度丰富的多种治疗剂,可以促进细胞反应和伤口愈合[34]。纯丝素蛋白凝胶的弹性难以满足实际伤口敷料使用的要求。如何发挥AF与丝素蛋白凝胶的优势制备理想的新型生物活性伤口敷料引起研究人员的思考。Ghalei等[35]首先通过静电纺丝方法制备了丝素蛋白纤维,然后将其包埋在含有AF的藻酸盐水凝胶(ALG)中,从而提高凝胶的弹性。扫描电子显微镜图像显示,丝素蛋白纤维均匀分布在藻酸盐水凝胶中,且敷料的弹性模量与断裂伸长率可通过ALG/AF比例调控,ALG浓度的增加可延缓AF的体外释放。成纤维细胞体外培养结果表明,AF含量的增加有利于细胞增殖、扩散和分泌胶原蛋白。因此,新型的生物活性敷料在促进创面愈合中具备一定的利用价值。
2.3 丝素蛋白微球 支架复合敷料
慢性伤口愈合是组织工程和再生医学的难点。为了促进伤口愈合,不仅需要生物活性伤口敷料,而且生物活性能否长时间保持是伤口愈合的关键。将生长因子均匀包埋在丝素微球中,伴随着微球骨架逐渐降解的同时延缓生长因子的释放,从而实现慢性伤口的长效治疗。将具有生物活性胰岛素丝素微球与丝素支架复合对于慢性伤口的治疗是有优势的。基于此,Li等[36]对该设想进行验证,利用同轴电喷雾丝素蛋白水溶液制备包埋胰岛素的丝素蛋白微球。胰岛素的体外长效缓慢释放长达28 d,且从微球释放出的胰岛素依然可以维持原始的分子构象。通过人角质形成细胞和内皮细胞的细胞迁移试验,证实了从丝素微球释放的胰岛素依然保留了其天然的生物活性。此外,将胰岛素包封的微球装载到丝素蛋白支架中,制备生物活性伤口敷料,并且评估了敷料在大鼠的背侧全厚度伤口上的治疗效果。结果显示,包埋胰岛素丝素微球的生物活性创伤敷料可以加速伤口闭合、胶原蛋白沉积和血管形成,从而促进伤口愈合。因此,该新型丝素蛋白复合敷料为慢性伤口提供了新的治疗策略。
3 結 语
创伤修复用丝素蛋白敷料的研究已经取得了丰富的成果。不仅多种形态的丝素蛋白为创伤修复用敷料提供了丰富的材料选择,而且丝素蛋白的可塑性强,可构建模拟细胞外基质的微环境,保持生长因子的生物活性,促进不同细胞的附着、迁移、生长和增殖,加快创伤修复的进程。
肯定丝素蛋白敷料应用价值的同时,也应该清楚地认识到依然有很多问题亟待解决。例如:1)如何实现丝素蛋白敷料降解速率与皮肤组织再生速率的协调;2)如何针对创伤修复过程中的不同生理特点设计功能灵活的丝素蛋白敷料;3)如何弄清生物活性敷料的丝素蛋白在促进细胞分裂、迁移、增殖等生理过程方面的作用机制;4)如何开发新技术优化丝素蛋白敷料的理化性能实现创伤修复的安全性、适用性和高效性。
创伤修复是一个复杂的过程,需要不同的细胞、细胞外基质成分和生物活性分子相互作用才能完成。针对上述存在的问题,未来的研究一方面应该集中在根据伤口类型优化功能性敷料的理化性能和组成,充分研究其与创伤修复之间的生物学效应;另一方面,依然通过生物活性分子对丝素蛋白材料进行功能化,开发高效修复、降低瘢痕组织生成风险的创伤敷料,为创伤修复的临床应用治疗提供理论与材料支撑。
参考文献:
[1]CLARK R A, TONNESEN M G, GAILIT J, et al. Transient functional expression of alphaVbeta 3 on vascular cells during wound repair[J]. The American Journal of Pathology, 1996, 148(5): 1407 1421.
[2]VELNAR T, BAILEY T, SMRKOLIJ V. The wound healing process: an overview of the cellular and molecular mechanisms[J]. Journal of International Medical Research, 2009, 37(5): 1528 1542.
[3]LIN P H, SERMERSHEIM M, LI H, et al. Zinc in wound healing modulation[J]. Nutrients, 2017, 10(1): 1 20.
[4]PEREIRA R F, BARTOLO P J. Traditional therapies for skin wound healing[J]. Advances in Wound Care, 2016, 5(5): 208 229.
[5]MIR M, ALI M N, BARAKULLAH A, et al. Synthetic polymeric biomaterials for wound healing: a review[J]. Progress in Biomaterials, 2018, 7(1): 1 21.
[6]MOGOSANU G D, GRUMEZESCU A M. Natural and synthetic polymers for wounds and burns dressing[J]. International Journal of Pharmaceutics, 2014, 463(2): 127 136.
[7]LIU H, WANG C, LI C, et al. A functional chitosan based hydrogel as a wound dressing and drug delivery system in the treatment of wound healing[J]. RSC Advances, 2018, 8(14): 7533 7549.
[8]ZHU J, LI F, WANG X, et al. Hyaluronic acid and polyethylene glycol hybrid hydrogel encapsulating nanogel with hemostasis and sustainable antibacterial property for wound healing[J]. ACS Applied Materials & Interfaces, 2018, 10(16): 13304 13316.
[9]LU Y, HUANG C L, YU F, et al. Effect of calcium alginate dressing on the cytokine contents, collagen synthesis degradation balance and apoptosis gene expression in the wound after perianal abscess surgery[J]. Journal of Hainan Medical University, 2017, 23(18): 2514 2516.
[10]YOON D S, LEE Y, RYU H A, et al. Cell recruiting chemokine loaded sprayable gelatin hydrogel dressings for diabetic wound healing[J]. Acta Biomaterialia, 2016, 38: 59 68.
[11]CHOI S M, RYU H A, LEE K M, et al. Development of stabilized growth factor loaded hyaluronate collagen dressing(HCD) matrix for impaired wound healing[J]. Biomaterials Research, 2016, 20(9): 1 7.
[12]CHOUHAN D, CHAKRABORTY B, NANDI S K, et al. Role of non mulberry silk fibroin in deposition and regulation of extracellular matrix towards accelerated wound healing[J]. Acta Biomaterialia, 2017, 48: 157 174.
[13]ARAMWIT P, PALAPINYO S , SRICHANA T, et al. Silk sericin ameliorates wound healing and its clinical efficacy in burn wounds[J]. Archives of Dermatological Research, 2013, 305(7): 585 594.
[14]ZAHRA S, MOSTAFA M, ARMAN H, et al. Evaluation of wound dressing made from spider silk protein using in a rabbit model[J].The International Journal of Lower Extremity Wounds, 2018, 17(2): 71 77.
[15]LI Y, ZHAO L, WANG H, et al. Preparation of regenerated silk fibroin based heat management sponge for wound healing[J]. Journal of Applied Polymer Science, 2019, 136(44): 48173.
[16]MELKE J, MIAHA S, GHOSH S, et al. Silk fibroin as biomaterial for bone tissue engineering[J]. Acta Biomaterialia, 2016, 31: 1 16.
[17]ROCKWOOD D N, PREDA R C, YUCEL T, et al. Materials fabrication from Bombyx mori silk fibroin[J]. Nature Protocols, 2011, 6(10): 1612 1631.
[18]LIU T, MIAO J, SHENG W, et al. Cytocompatibility of regenerated silk fibroin film: a medical biomaterial applicable to wound healing[J]. Journal of Zhejiang University Science B(Biomedicine & Biotechnology), 2010, 11(1): 10 16.
[19]GU Z, XIE H X, HUANG C, et al. Preparation of chitosan/silk fibroin blending membrane fixed with alginate dialdehyde for wound dressing[J]. International Journal of Biological Macromolecules, 2013, 58: 121 126.
[20]BIENERT M, HOSS M, BARTNECK M, et al. Growth factor functionalized silk membranes support wound healing in vitro[J]. Biomedical Materials, 2017, 12(4): 045023.
[21]HE S, SHI D, HAN Z, et al. Heparinized silk fibroin hydrogels loading FGF1 promote the wound healing in rats with full thickness skin excision[J]. Biomedical Engineering Online, 2019, 18(1): 97.
[22]THANGAVEL P, RAMACHANDRAN B, KANNAN R, et al. Biomimetic hydrogel loaded with silk and l‐proline for tissue engineering and wound healing applications[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2017, 105(6): 1401 1408.
[23]KARAHALILOGLU Z, YALCIN E, DEMIRBILEK M, et al. Magnetic silk fibroin e gel scaffolds for bone tissue engineering applications[J]. Journal of Bioactive & Compatible Polymers, 2017, 32(6): 596 614.
[24]KARAHALILOGLU Z. Curcumin loaded silk fibroin e gel scaffolds for wound healing applications[J]. Materials Technology, 2018, 33(4): 276 287.
[25]VASCONCELOS A, GOMES A C, CAVACO PAULO A. Novel silk fibroin/elastin wound dressings[J]. Acta Biomaterialia, 2012, 8(8): 3049 3060.
[26]FENG Y, LI X, ZHANG Q, et al. Mechanically robust and flexible silk protein/polysaccharide composite sponges for wound dressing[J]. Carbohydrate Polymers, 2019, 216: 17 24.
[27]MEHRABANI M G, KARIMIAN R, MEHRAMOUZ B, et al. Preparation of biocompatible and biodegradable silk fibroin/chitin/silver nanoparticles 3D scaffolds as a bandage for antimicrobial wound dressing[J]. International Journal of Biological Macromolecules, 2018, 114: 961 971.
[28]ZHAO L, CHEN D, YAO Q, et al. Studies on the use of recombinant spider silk protein/polyvinyl alcohol electrospinning membrane as wound dressing[J]. International Journal of Nanomedicine, 2017, 12: 8103 8114.
[29]ZHANG Y, LU L, CHEN Y, et al. Polydopamine modification of silk fibroin membranes significantly promotes their wound healing effect[J]. Biomaterials Science, 2019, 7(12): 5232 5237.
[30]HUANG T Y, WANG G S, TSENG C C, et al. Epidermal cells differentiated from stem cells from human exfoliated deciduous teeth and seeded onto polyvinyl alcohol/silk fibroin nanofiber dressings accelerate wound repair[J]. Materials Science and Engineering: C, 2019, 104: 109986.
[31]SONG D W, KIM S H, KIM H H, et al. Multi biofunction of antimicrobial peptide immobilized silk fibroin nanofiber membrane: implications for wound healing[J]. Acta Biomaterialia, 2016, 39: 146 155.
[32]YANG X, FAN L, MA L, et al. Green electrospun Manuka honey/silk fibroin fibrous matrices as potential wound dressing[J]. Materials & Design, 2017, 119: 76 84.
[33]MIGUEL S P, SIMOES D, MOREIRA A F, et al. Production and characterization of electrospun silk fibroin based asymmetric membranes for wound dressing applications[J]. International Journal of Biological Macromolecules, 2019, 121: 524 535.
[34]LANG A K, SEARLE R F. The immunomodulatory activity of human amniotic fluid can be correlated with transforming growth factor beta 1(TGF β1) and β2 activity[J]. Clinical and Experimental Immunology, 1994, 97(1): 158 163.
[35]GHALEI S, NOURMOHAMMADI J, SOLOUK A, et al. Enhanced cellular response elicited by addition of amniotic fluid to alginate hydrogel electrospun silk fibroin fibers for potential wound dressing application[J]. Colloids and Surfaces B: Biointerfaces, 2018, 172: 82 89.
[36]LI X, LIU Y, ZHANG J, et al. Functionalized silk fibroin dressing with topical bioactive insulin release for accelerated chronic wound healing[J]. Materials Science and Engineering: C, 2017, 72: 394 404.

