lncRNA SNHG1结合miR-145促进胃癌细胞增殖的机制研究
周锋利, 褚以忞, 李 吉, 杨大明, 彭海霞, 徐 莹
(上海交通大学医学院附属同仁医院内窥镜室,上海 200336)
胃癌是我国发病率较高的恶性肿瘤[1]。目前,胃镜筛查尚未在我国全面推广,多数胃癌患者就医时已处于进展期,5年生存率低,预后往往不佳[2-3]。因此,深入研究胃癌的发病机制对提升临床治疗效果有重要的价值及意义。
随着肿瘤发病机制研究的不断丰富,以往曾被认为是无功能的非编码RNA在肿瘤发病机制中的作用逐渐被关注。长度大于200 nt的非编码RNA为长链非编码RNA(long noncoding RNA,lncRNA)。目前研究表明,肿瘤中有大量lncRNA的表达异于正常组织[4-5],在肿瘤的发生、发展起重要生物学作用[6],这使得lncRNA有作为肿瘤生物标志物和治疗靶标的潜力[7-8]。微小RNA(microRNA,miRNA)是一类长19~25 nt非编码蛋白的调控小RNA,近年来有大量研究表明,其对肿瘤细胞增殖、分化、凋亡、侵袭以及远处转移等均能产生影响,在肿瘤的诊断中一定的价值[8-12]。
lncRNA小核仁RNA宿主基因1(small nucleolar RNA host gene 1,SNHG1)在染色体上位于11q12.3。有研究结果显示,SNHG1水平在多种肿瘤中升高[13-16],并可调控肿瘤蛋白p53(tumor protein p53,TP53)、Y染色体性别决定区域盒转录因子9(sex determining region Y-box transcription factor 9,SOX9)、锌指E-盒结合同源异形盒1(zinc finger E-box binding homeobox 1,ZEB1)等及其所在信号通路[17]。有研究结果显示,SNHG1在胃癌中呈高表达[14],其表达水平与肿瘤TNM分期、淋巴结转移、生存期有一定关系[18]。微小RNA-145(microRNA-145,miR-145)在胃癌组织中呈低表达,过表达miR-145有抑制胃癌细胞增殖和迁移的作用[19-21]。SNHG1可通过海绵吸附miR-145,促进结肠癌细胞的增殖[22],但两者在胃癌中是否有相互作用,并影响胃癌细胞增殖仍有待进一步研究。鉴于SNHG1及miR-145在胃癌组织中的异常表达及对患者预后的影响[14,18],本研究拟探讨SNHG1与miR-145在胃癌发展中可能的作用机制。
1 材料和方法
1.1 材料与试剂
本研究使用的细胞株及pcDNA3.0空载质粒均由上海交通大学医学院生化系侯照远教授实验室惠赠;Dulbecco改良Eagle培养基(Dulbecco's modified Eagle medium,DMEM)、RPMI1640、胎牛血清(fetal bovine serum,FBS)均购自美国Gibco公司;CCK8试剂盒购自日本Dojindo公司;TRIzol试剂购自美国Invitrogen公司;双荧光素酶报告试剂盒及质粒载体购自美国Promega公司;β-连环蛋白(beta-catenin,CTNNB1)兔单克隆抗体、骨髓瘤病毒原癌基因(myelocytomatosis viral oncogene,MYC)蛋白兔单克隆抗体购自美国CST公司;β-肌动蛋白鼠单克隆抗体购自美国Proteintech公司;二抗购自美国Li-COR公司。
1.2 细胞培养与组织收集
人胃癌细胞SGC7901、BGC823用RPMI1640培养基培养,人肾上皮细胞HEK 293T、人正常胃黏膜细胞GES-1细胞用DMEM培养基培养,培养基中均含10% FBS、青霉素50 U/mL、链霉素50 μg/mL及L-谷氨酰胺20 mmol/L,于37℃、5% CO2培养箱中培养。收集上海交通大学医学院附属同仁医院2016年1月—2017年1月17例胃癌术后患者的胃癌组织及癌旁组织,17例患者中男12例、女5例;年龄≤60岁4例、>60岁13例;TNM分期为Ⅰ期+Ⅱ期7例、Ⅲ期+Ⅳ期10例;病理类型为腺癌13例、印戒细胞癌4例。
1.3 转染过表达SNHG1、miR-145及敲低SNHG1
将SNHG1互补DNA(complementary DNA,cDNA)序列(Ensembl:ENSG00000255717,MIM:603222)插入到pcDNA3.0空载质粒中,并按照文献[23]报道的方法进行质粒转染,在SGC7901、BGC823及GES-1中过表达SNHG1。人miR-145双链模拟体、SNHG1抑制剂及阴性对照(negative control,NC)由上海吉玛生物技术有限公司合成,N C双链信息:5'-UUCUCCGAACGUGUCACGUTT -3',5'-AC GUGACACGUUCGGAGAATT -3'。人miR-145双链模拟体:5'-GUCCAGUUUUCCCAGGAAU CCCU-3',5'-GGAUUCCUGGGAAAACUGGAC UU-3'。SNHG1-homo-128(si-SNHG1-1):5'-GCCAGCGUUACAGUAAUGUTT-3',5'-ACA UUACUGUAACGCUGGCTT-3';SNHG1-homo-582(si-SNHG1-2):5'-GGUUUGCUGUGUAU CACAUTT-3',5'-AUGUGAUACACAGCA AACCTT-3'。按说明书方法进行转染过表达miR-145及敲低SNHG1。
TRIzol法提取细胞和组织中的总RNA,逆转录后行实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,qRT-PCR)定量分析。以小核RNA U6(RNA U6 nuclear small,snRNA U6,U6)为miR-145的内参,以β-actin为SNHG1的内参。miR-145引物序列为:上游5'-CGACCGTCCAGTTTTCCCAGGA-3',下游5'-CTCAACTGGTGTCGTGGA-3'。U6引物序列为:上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3'。SNHG1引物序列为:上游5'-ACACTGGGAGCC AATGAAACA-3',下游5'-ACACGAAGTGG AGTTATGGGAAG-3'。β-actin引物序列为:上游5'-GTCACCAACTGGGACGACA-3',下游5'-CACAGCCTGGATAGCAACG-3'。转染、TRIzol法提取细胞RNA、逆转录后行qRT-PCR。所有实验均重复3次。
1.4 CCK8及免疫印迹法实验
CCK8实验中,将目的细胞以1 000个/孔接种于96孔板,每组设3个复孔;在培养的第2、24、48、72、96 h加入CCK8试剂10 μL/孔,孵育1 h后酶标仪测定450 nm吸光度。实验重复3次。免疫印迹法实验中,裂解细胞后,进行蛋白定量、等量蛋白电泳、转膜、封闭,孵育一抗、二抗后,用Odyssey Li-COR 9120荧光扫描仪(美国Li-COR公司)进行荧光显影并记录,实验重复3次。
1.5 荧光素酶报告基因实验
为验证SNHG1有与miR-145的结合位点,构建含有SNHG1预测与miR-145结合位点的片段的psiCHECK2TM质粒,构建方法参考文献[23]。24孔板培养293T细胞至密度70%~80%,不同量的miR-145或NC与psiCHECK2TM-SNHG1的报告基因质粒同时共转染,24 h后按说明书操作收集并裂解细胞,设置双报告基因程序;先在裂解液中加入LARII试剂检测萤火虫荧光素酶的活性;之后再加入Stop & Glo Reagent试剂检测海肾荧光素酶活性;计算萤火虫荧光素酶与海肾荧光素酶活性的比值,以此反映psiCHECK2TM-SNHG1的报告基因活性;将实验组比值除以miR-145 mimics 0 mg组比值,计算出psiCHECK2TM-SNHG1报告基因相对活性,实验重复3次。
1.6 生物信息学分析
使用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)分析SNHG1表达与胃癌生存期的关系。使用starBase v3.0数据库(http://starbase.sysu.edu.cn/index.php)分析胃癌组织与癌旁组织SNHG1的表达以及胃癌中SNHG1与miR-145、SNHG1与CTNNB1、SNHG1与MYC表达的相关性。采用TANRIC数据库(http://ibl.mdanderson.org)分析胃癌与SNHG1表达的相关性以及可能与SNHG1存在相互作用的miRNA。通过RNA22 v2 microRNA target detection(https://cm.jefferson.edu/rna22/)网站预测SNHG1与miR-145可能的结合位点。
1.7 统计学方法
使用SPSS 21.0软件进行统计分析。2个组间比较采用t检验,非正态分布数据采用中位数(M)[四分位数(P25~P75)]表示,组间比较采用非参数秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织中SNHG1的表达及其与患者总生存期(overall survival,OS)的关系
在Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)中使用数据集GSE14210(146例)、GSE15459(200例)、GSE22377(43例)、GSE29272(268例)、GSE51105(94例)进行生存分析。结果显示SNHG1高表达组(127例)中位OS为27.8个月,明显短于低表达组(221例,中位OS为35.9个月)[风险比(hazard ratio,HR)=1.4(1.06~1.83),P=0.015],见图1(a)。
通过starBase v3.0数据库(http://starbase.sysu.edu.cn/index.php)查找发现,375例胃癌组织SNHG1的相对表达量为3.25(2.60~3.80),明显高于32例正常胃组织[1.91(1.52~2.32),P=1.4×10-14,错误发现率(false discovery rate,FDR)=4.3×10-13],见图1(b)。

图1 SNHG1对胃癌OS期的影响及在胃癌及癌旁组织中的表达情况
对17例胃癌患者的胃癌组织及癌旁组织进行qRT-PCR检测,结果显示胃癌组织中SNHG1的相对表达量为25.35(4.51~65.12),明显高于癌旁组织[18.66(8.70~153.90)](P<0.05),见图1(c)。
2.2 SNHG1在胃癌细胞增殖中的作用
CCK8实验结果显示,培养48 h后,过表达SNHG1的胃癌细胞系SGC7901和BGC823的增殖速率快于转染pcDNA3.0空载质粒的胃癌细胞系SGC7901和BGC823(P<0.05),见图2(a)~(d)。
在胃癌细胞系SGC7901中敲低SNHG1的表达,采用CCK8实验检测细胞增殖速率。结果显示,与NC比较,培养48 h时转染siSNHG1-2的SGC7901细胞的增殖受抑制(P<0.05);培养72 h后,转染siSNHG1-1和siSNHG1-2的SGC7901细胞的增殖均受抑制(P<0.05)。见图2(e)、(f)。
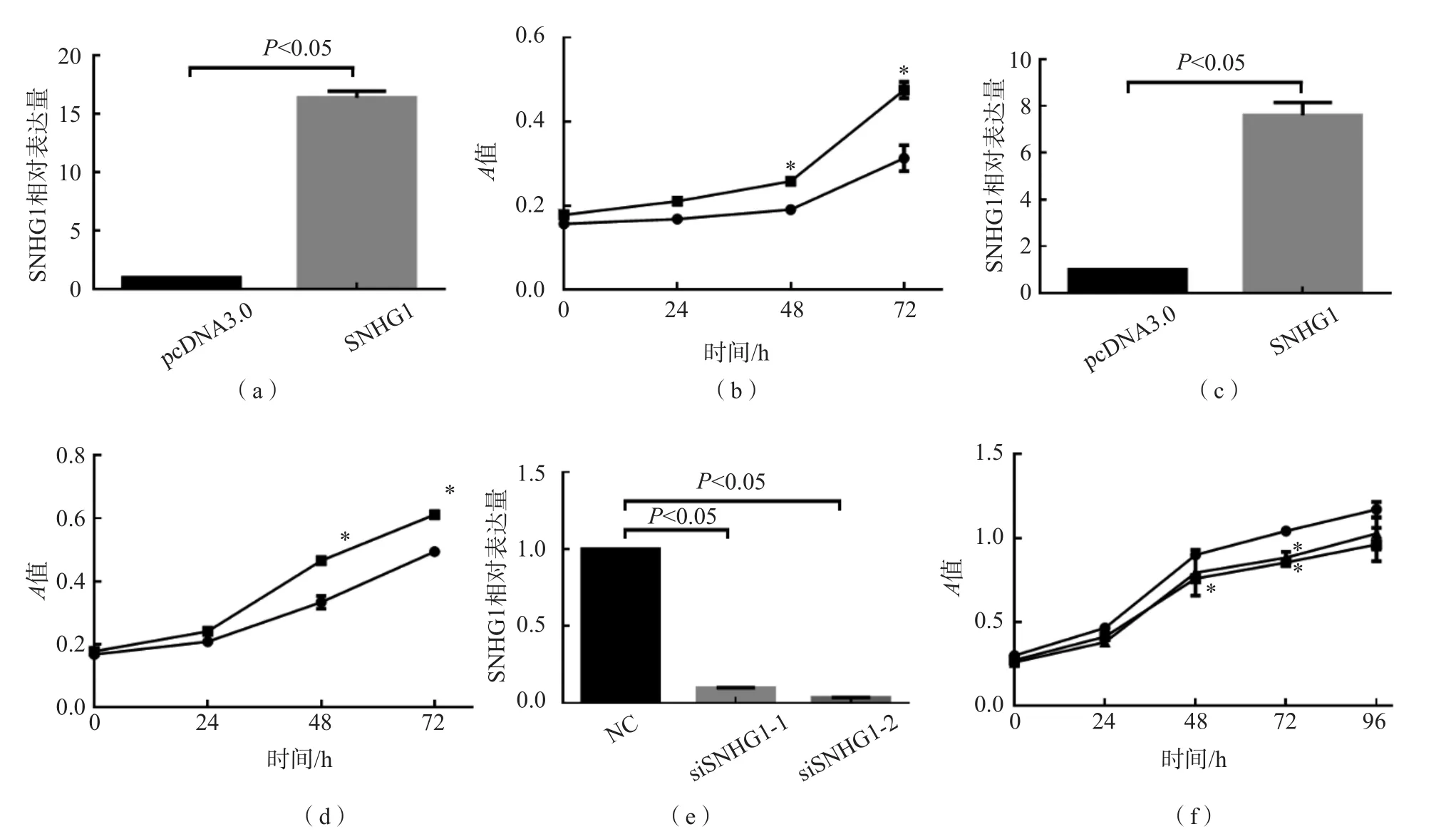
图2 SNHG1对胃癌细胞生长的影响
2.3 SNHG1与miR-145在胃癌细胞与组织中的相关性及特异性结合分析
利用生物信息学分析,通过TANRIC数据库(http://ibl.mdanderson.org) 分析胃癌中与SNHG1表达的相关性以及可能与SNHG1存在相互作用的miRNA。结果显示,miR-145与SNHG1呈明显负相关(r=-0.421,P=1.17×10-4),见表1。进一步分析starBase v3.0数据库中372例胃癌患者组织中miR-145与SNHG1的相关性,结果显示,两者亦呈负相关(r=-0.37,P=3.81×10-13),见图3(a)。
在GES-1和SGC7901细胞中分别过表达SNHG1并采用qRT-PCR检测。结果显示,随着SNHG1表达的升高,miR-145表达降低(P<0.05),见图3(b)、(c)。
通过RNA22 v2 microRNA target detection(https://cm.jefferson.edu/rna22/)网站预测到SNHG1与miR-145存在结合位点,见图3(d)。
荧光素酶报告基因实验结果显示,随着miR-145转染浓度的上升,SNHG1报告基因的相对活性呈浓度依赖性降低,见图3(e)。

表1 TANRIC数据库显示在胃癌中与SNHG1表达水平呈负相关的microRNA
2.4 SNHG1与miR-145结合对CTNNB1、MYC蛋白表达的影响
在starBase v3.0数据库中通过分析372例胃癌患者组织发现,SNHG1 mRNA表达与CTNNB1(r=0.12,P=0.025)及MYC(r=0.28,P=2.16×10-8)表达均呈正相关,见图4(a)、(b)。
将miR-145和SNHG1单独或共转染至GES-1细胞内,随后采用免疫印迹法检测CTNNB1和MYC蛋白的表达。结果显示,转染miR-145后,CTNNB1和MYC蛋白水平均明显降低;转染SNHG1后,CTNNB1和MYC蛋白水平明显升高;同时转染miR145和SNHG1后,miR-145下调CTNNB1和MYC蛋白的作用被明显抑制。见图4(c)~(f)。
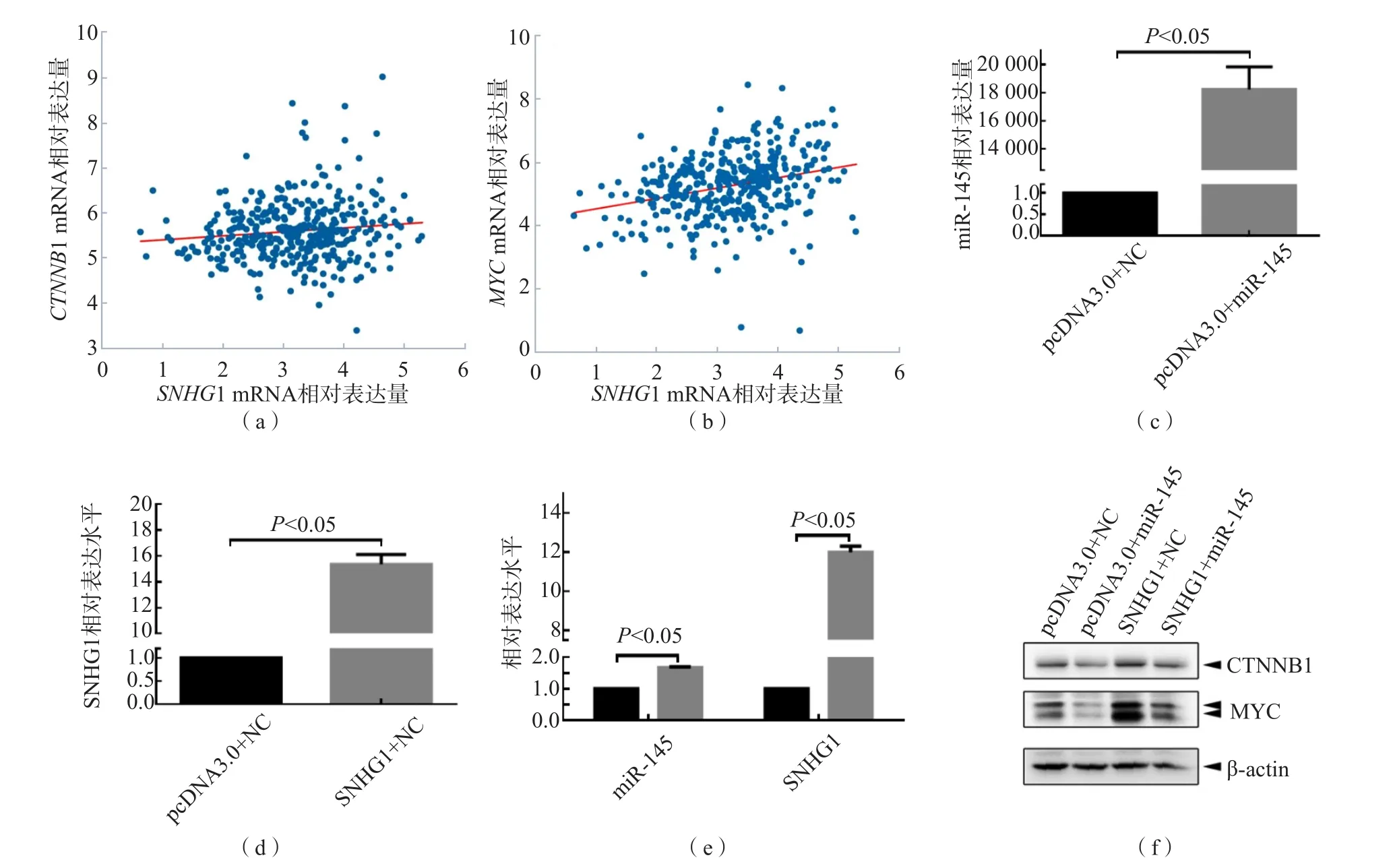
图4 SNHG1与miR-145结合对CTNNB1、MYC蛋白表达的影响
3 讨论
近年来,随着生活环境和饮食结构的改变,STAD发病率虽有所下降,但其死亡率仍居癌症死亡率的第3位,占总死亡人数的8.2%[24]。因此,探究胃癌发生、发展的机制,找到新的治疗靶点仍极为迫切。SNHG1是近年来新发现的一个lncRNA,目前发现其对多种肿瘤的发展及预后有关键作用,即可直接作用于信使RNA(messenger RNA,mRNA),也能通过海绵吸附miRNA,起到竞争性内源RNA(competing endogenous RNA,ceRNA)的作用,影响miRNA对下游靶基因的调控。例如,在结肠癌中通过影响p53通路促进细胞增殖[25],肝癌细胞中竞争性结合miR-195,封闭其活性,从而促进疾病发展[26],在肺腺癌中作用于ZEB1影响靶细胞的增殖、转移和侵袭等[27]。近来也有报道显示,SNHG1在胃癌中存在高表达,但其具体的分子作用机制尚未见详细阐述。褚以忞等[28]的研究结果显示,在胃癌及癌前病变组织中miR-145水平明显下降。miR-145可通过影响MYC水平来影响胃癌进展[21]。既往研究也证实,在卵巢癌、胃癌等多种肿瘤中MYC为miR-145的直接靶标[29-31]。同时,MYC也是T细胞因子的靶基因之一,受Wnt/β-catenin信号通路的激活调控[32-33]。
本研究首先通过Kaplan-Meier Plotter数据库发现,胃癌患者SNHG1表达与OS呈负相关,通过starBase v3.0数据库发现SNHG1在胃癌中高表达,与qRT-PCR的检测结果一致。本研究结果还显示,过表达SNHG1能促进胃癌细胞增殖,而敲低SNHG1则抑制胃癌细胞增殖。通过TANRIC、starBase v3.0数据库检索及细胞学实验证实SNHG1与miR-145表达呈负相关,使用RNA22 v2 microRNA target detection网站预测到SNHG1与miR-145存在结合位点,并通过荧光素酶报告基因实验证实两者能有效结合。通过starBase v3.0数据库分析胃癌患者组织发现,SNHG1表达与CTNNB1及MYC表达均呈正相关。分别过表达miR-145、SNHG1及同时过表达miR-145和SNHG1,发现miR-145可下调CTNNB1、MYC蛋白表达,SNHG1可促进CTNNB1、MYC蛋白表达,且SNHG1能抑制miR-145下调CTNNB1和MYC蛋白。由此可见,SNHG1在胃癌组织中呈高表达,且能结合miR-145,miR-145对SNHG1的影响呈浓度依赖性。原因可能是SNHG1或能通过海绵吸附miR-145,抑制miR-145对下游靶基因的作用,从而上调miR-145下游CTNNB1、MYC蛋白表达,促进胃癌细胞增殖。因此,SNHG1与miR-145的结合位点可能是胃癌的潜在治疗靶点。
由于本研究未用动物实验进一步阐明胃癌细胞中SNHG1和miR-145通过ceRNA上调CTNNB1、MYC蛋白表达的机制,因此SNHG1/miR-145/CTNNB1/MYC轴对胃癌发生、发展的影响还需进一步研究验证。

