成纤维细胞生长因子19 预测儿童脓毒症合并胃肠功能障碍的临床价值
唐晓梦 ,任玉倩,熊 熙 ,缪惠洁,邵卢晶 ,崔 云,张育才 ,王春霞
1. 上海交通大学附属儿童医院重症医学科,上海200062;2. 上海交通大学儿童感染免疫与重症医学研究院,上海200062
脓毒症是机体对感染免疫失调导致的危及生命的器官功能障碍。胃肠道在脓毒症病理发展中起着至关重要的作用。急性胃肠道损伤(acute gastrointestinal injury,AGI)是一种常见的脓毒症合并器官功能障碍[1]。肠道屏障损伤易导致肠道菌群异位,促进脓毒症多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的 发 生[2]。故尽早发现、尽早治疗AGI 对改善脓毒症预后至关重要。
AGI 的体征和临床症状包括肠鸣音异常、腹胀、腹痛、腹泻、便秘、恶心、呕吐、无法耐受的肠内营养和胃肠道出血等。欧洲重症监护医学会(The European Society of Intensive Care Medicine,ESICM)2012 年提出的AGI分级易受主观因素影响[3],临床应用受限。因此,开发早期AGI 预测生物标志物具有重要临床价值。成纤维细胞生长因子19 (fibroblast growth factor 19,FGF19) 由肠上皮细胞分泌,参与胆汁酸合成的反馈调节[4]。研究[5-6]表明,FGF19 水平降低与回肠切除、腹泻和疾病活动度有关,且FGF19 是反映克罗恩病患者回肠功能的生物标志物。目前,儿童脓毒症合并胃肠功能障碍尚无有效预测指标。本研究纳入2018 年1 月至2018 年12 月入儿童重症监护病房(pediatric intensive care unit,PICU)的脓毒症患儿,观察血清FGF19 水平,探讨血清FGF19 水平与胃肠功能障碍的关系,并与降钙素原(procalcitonin,PCT)等常规指标进行比较,以期为儿童脓毒症合并胃肠功能障碍的预测提供参考。
1 对象与方法
1.1 研究对象
前瞻性收集2018 年1 月至2018 年12 月期间诊断为脓毒症并入住上海交通大学附属儿童医院PICU 的患儿,根据有无胃肠功能障碍分为脓毒症未合并胃肠功能障碍组和脓毒症合并胃肠功能障碍组。儿童脓毒症的诊断参照2005 年《国际儿科脓毒症会议共识》[7]。纳入标准:① 年龄1 月龄至14 岁患儿。②入PICU 诊断为脓毒症患儿。③住PICU 大于72 h 的患儿。排除标准:①晚期肿瘤或预期寿命小于1 个月的患儿。②诊断为脓毒症超过24 h 的患儿。脓毒症合并主要器官功能障碍参考2005 年《国际儿科脓毒症会议共识》[7]和《2012 拯救脓毒症运动:严重脓毒症及脓毒性休克管理国际指南》儿科部分[8]。脓毒症相关胃肠功能障碍根据ESICM 2012 年提出的AGI 分级定义[3]。研究方案经上海交通大学附属儿童医院伦理委员会批准(批准号2018R039-F01),并按照赫尔辛基宣言规定的伦理标准进行。研究获得患儿监护人的知情同意并签署知情同意书。
1.2 治疗方法
依据2005 年《国际儿科脓毒症会议共识》[7]和《2012 拯救脓毒症运动:严重脓毒症及脓毒性休克管理国际指南》儿科部分[8],纳入研究的脓毒症患儿给予液体复苏、血管活性药物、抗生素和其他支持疗法。
1.3 血样采集
患儿入PICU 当刻,非抗凝条件下采集外周静脉血。离心后取血清,保存于-80 ℃备用。血清FGF19 采用酶联免疫吸附试验(ELISA)试剂盒(杭州联科生物技术股份有限公司)测定。
1.4 观察指标
预先建立病例报告表(case report form,CRF),收集患儿的年龄、性别、合并症、感染源、第三代小儿死亡危险评分(pediatric risk of mortality score Ⅲ,PRISM Ⅲ)、机械通气情况、血管活性药物使用情况等临床参数。实验室指标包括:①血常规指标,包括白细胞(white blood cell,WBC)、血小板(platelet,PLT)。②器官功能相关指标,包括总胆红素(total bilirubin,TBIL)、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、白蛋白(albumin,ALB)、 血 尿 素 氮(blood urea nitrogen,BUN)、 肌 酐(creatinine,Cr)、乳酸(lactate,Lac)、肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CK-MB)。③凝血功能指标,包括活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、国际标准化比(international normalized ratio,INR)、纤维蛋白原(fibrinogen,Fib)。④感染性指标,包括PCT、C 反应蛋白(C-reactive protein,CRP)。结局变量包括PICU 住院时长和PICU 病死率。实验指标收集时间为PICU 入院后24 h 内。
1.5 统计学分析
采 用STATA 15.0 MP (College Station,Texas,USA)软件进行统计学分析。定量资料采用Kolmogorov-Smirnov检验进行正态性分析,服从正态分布的定量资料以±s表示,组间差异比较采用t检验;非正态分布的定量资料以M(Q1,Q3)表示,组间差异比较采用非参数秩和检验。定性资料以n(%)表示,组间差异比较采用χ2检验。多因素Logistic 回归分析纳入FGF19 及其他单因素分析具有统计学意义的变量,分析脓毒症合并胃肠功能障碍的相关因素。采用受试者工作特征曲线(receiver operating characteristic curve,ROC 曲 线)分 析 并 评 估FGF19 及PCT 对脓毒症合并胃肠功能障碍的预测效能。P<0.05 表示差异有统计学意义。
2 结果
2.1 患儿的基线资料
共纳入101 例患儿,排除11 例血清FGF19 值缺失的患儿,对90 例患儿(男性51 例,女性39 例)进行进一步分析,其中位年龄为19.0 (5.0,60.0)月龄。儿童脓毒症PICU 病死率为12.2%(11/90)。根据有无胃肠功能障碍分为脓毒症未合并胃肠功能障碍组(n=58)和脓毒症合并胃肠功能障碍组(n=32)。在32 例合并胃肠功能障碍的脓毒症患儿中,从入PICU 到出现胃肠功能障碍的间隔时间为0(0,4.0)d,住PICU 期间胃肠功能障碍持续时间为4.0(3.0,8.0)d;胃肠功能障碍的临床表现主要包括:呕吐、腹胀、腹泻、肠鸣音弱或缺失、消化道出血、腹内压增高。2 组在PRISM Ⅲ,合并休克、急性肾损伤(acute kidney injury,AKI)、急性肝损伤(acute liver injury,ALI),感染部位,PICU 住院时长等方面差异有统计学意义(P<0.05)。此外,与脓毒症未合并胃肠功能障碍组相比,脓毒症合并胃肠功能障碍组的PICU 病死率呈上升趋势(18.8%vs8.6%,P=0.160),但差异无统计学意义(表1)。
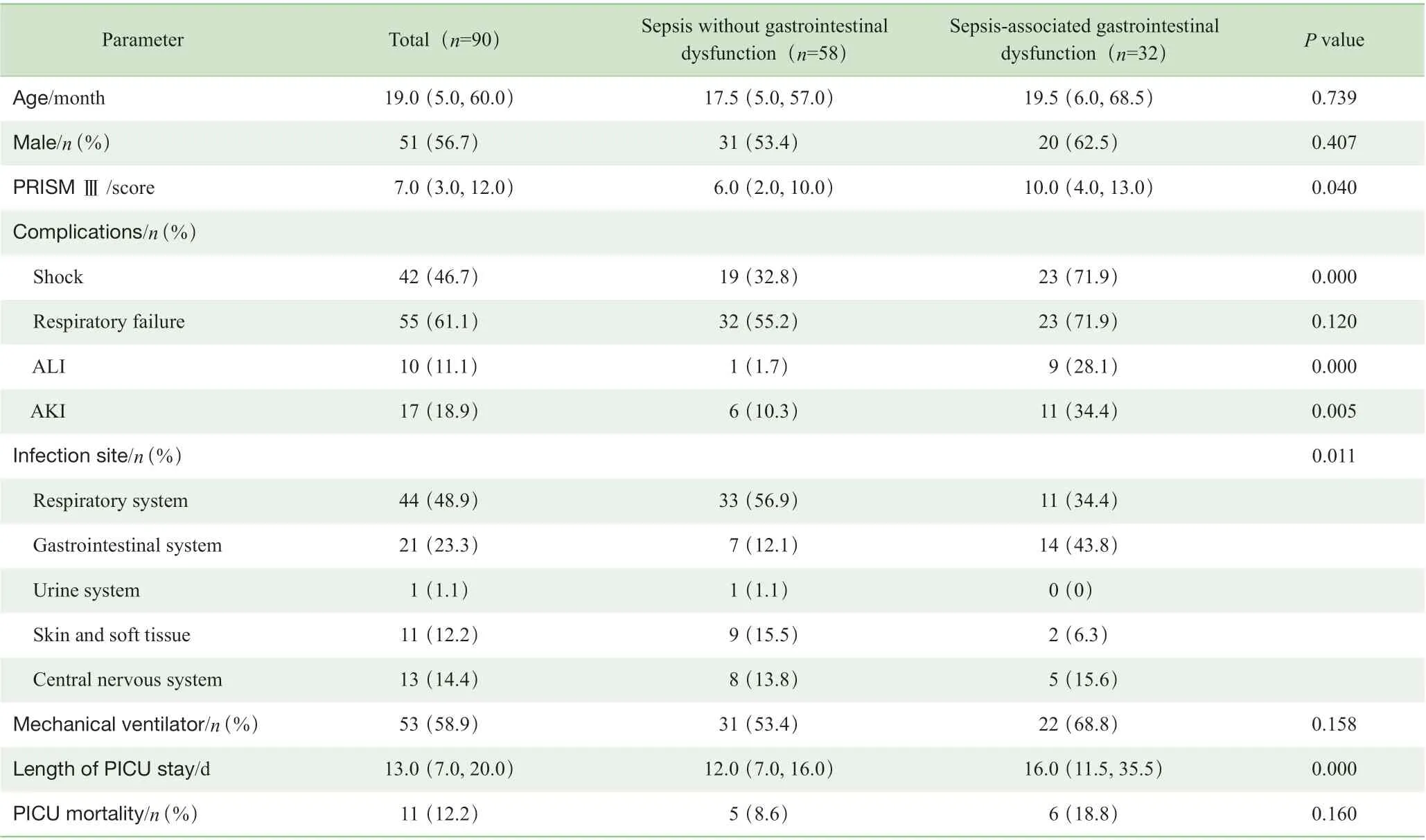
表1 脓毒症患儿基本资料Tab 1 Baseline characteristics of patients with sepsis
2.2 血清实验室指标与脓毒症胃肠功能障碍的关系
脓毒症合并胃肠功能障碍组患儿入PICU 时血清FGF19水平显著低于脓毒症未合并胃肠功能障碍组患儿[48.4 (27.7,95.6) μg/mLvs77.6 (45.8,151.2) μg/mL,P=0.046]。与 脓 毒症未合并胃肠功能障碍组相比,PCT 水平在脓毒症合并胃肠功能障碍组患儿中显著升高[4.5 (0.6,12.6) ng/mLvs0.5 (0.1,5.7) ng/mL,P=0.005],但ALB 水平在脓毒症合并胃肠功能障碍组患儿中显著降低[36.4 (28.3,40.3) g/Lvs39.6 (34.5,43.1) g/L,P=0.025];此外,脓毒症合并胃肠功能障碍组患儿血清Lac 水平呈上升趋势,但与未合并胃肠功能障碍组患儿差异无统计学意义(P=0.126)(表2)。
为深入探讨FGF19 水平与脓毒症相关器官功能障碍的关联,进一步开展针对不同器官功能障碍的亚组分析(表3)结果显示:FGF19 水平与脓毒症是否合并呼吸衰竭(P=0.707)、AKI(P=0.708)或ALI(P=0.659)无相关性;与是否合并胃肠功能障碍、是否合并休克显著相关(P=0.049,P=0.034)。此外,脓毒症患儿血清FGF19 浓度与年龄和性别无相关性(P=0.925,P=0.495)。

表2 脓毒症患儿是否合并胃肠功能障碍2 组间实验室指标比较Tab 2 Comparison of the laboratory indexes of septic patients with or without gastrointestinal dysfunction
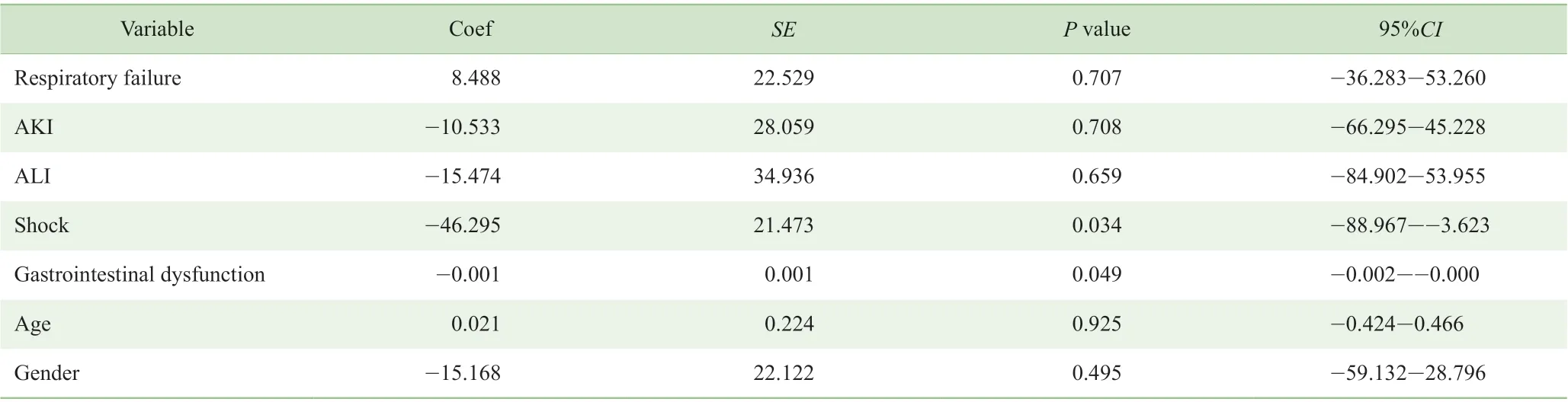
表3 血清FGF19 水平与不同器官损伤、年龄和性别之间的相关性分析Tab 3 Analysis of the association between serum FGF19 level and organ dysfunction, age and gender
将PCT 和FGF19 同时纳入多因素Logistic 回归分析,结果显示:PCT 与脓毒症合并胃肠功能障碍发生的比值比(odds ratio,OR)为1.047,95%CI为0.995 ~1.100(P=0.076);FGF19 与脓毒症合并胃肠功能障碍发生的OR值为0.993,95%CI为0.986 ~0.999(P=0.049);因此,低FGF19 水平是儿童脓毒症合并胃肠功能障碍的危险因素。
2.3 血清FGF19 作为脓毒症患儿合并胃肠功能障碍的预测指标
ROC 曲线分析结果显示,血清FGF19 预测脓毒症合并胃肠功能障碍的效能与PCT 相似。FGF19 预测脓毒症合并胃肠功能障碍的ROC 曲线下面积(area under ROC curve,AUC) 为0.636(95%CI0.515 ~0.757),PCT 对应 的AUC 为0.683(95%CI0.562 ~0.804),两 者 效 能差异无统计学意义(P=0.597)(图1)。当血清FGF19 水平cutoff 值为60 μg/mL 时,预测脓毒症合并胃肠功能障碍的敏感度为62.5%,特异度为55.2%;当血清PCT 水平cutoff 值为1.44 ng/mL 时,其敏感度为67.7%,特异度为70.9 %。

图1 ROC 曲线分析血清FGF19 和PCT 预测脓毒症合并胃肠功能障碍的效能Fig 1 ROC curve analysis for serum FGF19 and PCT in predicting gastrointestinal dysfunction in children with sepsis
3 讨论
本文讨论血清FGF19 水平与儿童脓毒症合并胃肠功能障碍的关系。通过对90 例脓毒症患儿入PICU 当刻的血清FGF19 水平与住PICU 期间是否发生胃肠功能障碍的关联进行分析发现,血清FGF19 可作为一种预测儿童脓毒症合并胃肠功能障碍的新型生物标志物,其阈值为60 μg/mL。
多项研究[9-11]表明,高达62%的患者在入重症监护病房(intensive care unit,ICU)后(最快1 d 内)出现至少1 种胃肠道症状。在本研究中,脓毒症患儿胃肠功能障碍的发生率为35.6%(32/90)。胃肠功能障碍与危重患者不良预后有关[10,12-14]。成人机械通气患者中,ICU 住院的第1日出现3 种或3 种以上的胃肠功能障碍症状,其病死率增加3 倍[15]。本研究中,合并胃肠功能障碍的脓毒症患儿的PICU 病死率为18.8%,比没有合并胃肠功能障碍的患儿要高(8.6%)。早期识别脓毒症合并胃肠功能障碍并给予及时干预治疗对改善脓毒症预后十分关键,而缺乏早期识别胃肠功能障碍的生物标志物严重阻碍了胃肠功能障碍领域的研究。
血清PCT 水平在脓毒症感染及其相关器官损伤中具有重要临床价值。研究证实,血清PCT 水平可用来区分上下消化道穿孔[16],与细菌负荷[17]、脓毒症严重程度[18]及预后[19-20]有关。PCT 对于诊断肠缺血[21]以及早期预测并及时诊断和治疗炎症性肠病具有临床意义[22-23];以上研究结果提示多种胃肠道功能障碍与血清PCT 水平变化有关。在本研究中,我们发现血清PCT 预测儿童脓毒症合并胃肠功能障碍,当cutoff 值为1.44 ng/mL 时,其敏感度为67.7%,特异度为70.9%;提示PCT 是预测儿童脓毒症合并胃肠功能障碍的有效生物标志物。鉴于PCT 是常规临床检测参数,在预测及识别儿童脓毒症合并胃肠功能障碍中的临床意义值得进一步关注。
脓毒症早期肠上皮细胞损伤影响肠源性因子的分泌。这些生物因子可能有助于重症监护医师在早期发现胃肠道功能障碍。在本研究中,FGF19 与脓毒症患儿的胃肠功能异常显著相关,这为胃肠功能障碍评估提供了新视角。此外,血清FGF19 对胃肠道功能障碍有一定的预测能力,cutoff 值为60 μg/mL 时,对应敏感度为62.5%,特异度为55.2%。鉴于FGF19 是一种肠道分泌蛋白,与作为感染指标的PCT 相比,推测FGF19 更具有指示肠道病变的优势。血清FGF19 作为胃肠功能障碍的新型生物标志物的潜在临床意义有待于在大样本人群中进一步验证。
本研究尚存在一些局限性。首先,FGF19 预测脓毒症合并胃肠功能障碍的AUC[0.636(95%CI0.515 ~0.757)]偏低,推测这一结果可能与本研究纳入的病例数量较少有关,也可能与脓毒症引发胃肠功能障碍的严重程度以及是否伴发病原体感染有关;其次,作为胃肠功能障碍的参考生物标志物,由于血液样本量的限制,肠上皮细胞损伤的可能标志物肠脂肪酸结合蛋白(intestinal fatty acid binding protein,I-FABP)没有被纳入分析;第三,未能对脓毒症合并胃肠功能障碍患儿的胃肠功能障碍严重程度和感染源进行亚组分析。虽然存在以上研究局限性,但是FGF19作为一种特异性的肠道分泌蛋白,其与脓毒症合并胃肠功能障碍之间的关联值得关注,有望成为一种新型的预测胃肠功能障碍的生物标志物。
综上,低血清FGF19 是儿童脓毒症合并胃肠功能障碍的风险因素,入PICU 时血清FGF19 水平可作为一种新型生物标志物用于预测评估脓毒症患儿住PICU 期间发生胃肠功能障碍的风险;当血清FGF19 浓度低于60 μg/mL,预示脓毒症患儿发生胃肠功能障碍风险增加。
参·考·文·献
[1] Yu Y, Yang YY, Bian YX, et al. Hydrogen gas protects against intestinal injury in wild type but not NRF2knockout mice with severe sepsis by regulating HO-1 and HMGB1 release[J]. Shock, 2017, 48(3): 364-370.
[2] Klingensmith NJ, Coopersmith CM. The gut as the motor of multiple organ dysfunction in critical illness[J]. Crit Care Clin, 2016, 32(2): 203-212.
[3] Reintam Blaser A, Malbrain MLNG, Starkopf J, et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems[J]. Intensive Care Med, 2012, 38(3): 384-394.
[4] Cicione C, Degirolamo C, Moschetta A. Emerging role of fibroblast growth factors 15/19 and 21 as metabolic integrators in the liver[J]. Hepatology, 2012, 56(6): 2404-2411.
[5] Iwamoto J, Saito Y, Honda A, et al. Bile acid malabsorption deactivates pregnane X receptor in patients with Crohn's disease[J]. Inflamm Bowel Dis, 2013, 19(6): 1278-1284.
[6] Nolan JD, Johnston IM, Pattni SS, et al. Diarrhea in Crohn's disease: investigating the role of the ileal hormone fibroblast growth factor 19[J]. J Crohns Colitis, 2015, 9(2): 125-131.
[7] Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics[J]. Pediatr Crit Care Med, 2005, 6(1): 2-8.
[8] Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228.
[9] Montejo JC. Enteral nutrition-related gastrointestinal complications in critically ill patients: a multicenter study. The Nutritional and Metabolic Working Group of the Spanish Society of Intensive Care Medicine and Coronary Units[J]. Crit Care Med, 1999, 27(8): 1447-1453.
[10] Mutlu GM, Mutlu EA, Factor P. GI complications in patients receiving mechanical ventilation[J]. Chest, 2001, 119(4): 1222-1241.
[11] Reintam A, Parm P, Kitus R, et al. Gastrointestinal symptoms in intensive care patients[J]. Acta Anaesthesiol Scand, 2009, 53(3): 318-324.
[12] Lebuffe G, Vallet B, Takala J, et al. A European, multicenter, observational study to assess the value of gastric-to-end tidal PCO2difference in predicting postoperative complications[J]. Anesth Analg, 2004, 99(1): 166-172.
[13] Lam SW, Nguyen NQ, Ching K, et al. Gastric feed intolerance is not increased in critically ill patients with type Ⅱ diabetes mellitus[J]. Intensive Care Med, 2007, 33(10): 1740-1745.
[14] Reintam A, Parm P, Kitus R, et al. Gastrointestinal failure score in critically ill patients: a prospective observational study[J]. Crit Care, 2008, 12(4): R90.
[15] Reintam Blaser A, Poeze M, Malbrain ML, et al. Gastrointestinal symptoms during the first week of intensive care are associated with poor outcome: a prospective multicentre study[J]. Intensive Care Med, 2013, 39(5): 899-909.
[16] Gao Y, Yu KJ, Kang K, et al. Procalcitionin as a diagnostic marker to distinguish upper and lower gastrointestinal perforation[J]. World J Gastroenterol, 2017, 23(24): 4422-4427.
[17] van Nieuwkoop C, Bonten TN, van't Wout JW, et al. Procalcitonin reflects bacteremia and bacterial load in urosepsis syndrome: a prospective observational study[J]. Crit Care, 2010, 14(6): 1-9.
[18] Jiang L, Feng B, Gao DN, et al. Plasma concentrations of copeptin, C-reactive protein and procalcitonin are positively correlated with APACHE Ⅱ scores in patients with sepsis[J]. J Int Med Res, 2015, 43(2): 188-195.
[19] Jain S, Sinha S, Sharma SK, et al. Procalcitonin as a prognostic marker for sepsis: a prospective observational study[J]. BMC Res Notes, 2014, 7(1): 1-7.
[20] Liu D, Su LX, Guan W, et al. Prognostic value of procalcitonin in pneumonia: a systematic review and meta-analysis[J]. Respirology, 2016, 21(2): 280-288.
[21] Cosse C, Sabbagh C, Kamel S, et al. Procalcitonin and intestinal ischemia: a review of the literature[J]. World J Gastroenterol, 2014, 20(47): 17773-17778.
[22] Lippi G, Sanchis-Gomar F. Procalcitonin in inflammatory bowel disease: drawbacks and opportunities[J]. World J Gastroenterol, 2017, 23(47): 8283-8290.
[23] 汪莉, 倪申旺, 朱克然, 等. C-反应蛋白、降钙素原在新生儿坏死性小肠结肠炎患儿的水平变化及临床意义[J]. 中国当代儿科杂志, 2018, 20(10): 825-830.

