额叶-边缘系统功能连接特征对精神病临床高危综合征患者 转归的预测作用
朱田园,沈梦婷,徐丽华,张天宏,张建业,王继军,唐莺莹#
1.上海交通大学医学院附属精神卫生中心脑电影像研究室,上海 200030;2.上海交通大学医学院附属精神卫生中心放射科,上海 200030
精神分裂症是一种重性精神障碍,在我国终身患病率为0.7%,多起病于青春期或成年早期,具有高致残率、高自杀率的特点,使得精神分裂症成为重要的公共卫生问题[1]。近年对精神分裂症的病因学研究焦点前移至前驱期,即精神病临床高危综合征(clinical high-risk for psychosis,CHR);CHR 人群尚未发病,但已经出现精神病性症状、神经认知和社会认知功能损伤等[2]。探索CHR人群的脑结构或功能变异,并长程随访其与精神分裂症发作的关系,将有助于阐明精神分裂症的生物学病因。
精神分裂症患者存在显著的社会认知功能损伤,且损伤越严重,预后越差[3]。因此,与处理社会应激相关的额叶-边缘系统很可能与精神分裂症的发作和进展相关[4]。尽管精神分裂症患者的额叶-边缘系统的结构和功能异常已被报道,如额叶皮层、海马、杏仁核等灰质体积显著减少,连接额叶-边缘系统的钩状束、扣带回等白质完整性降低,默认网络与凸显网络等功能连接异常等,但额叶-边缘系统异常在精神分裂症发作中的作用常被忽略。仅Anticevic等[5]首次将精神分裂症首发患者、慢性患者、遗传高危被试和健康对照人群纳入横断面研究,发现眶额-杏仁核连接在首发患者和慢性患者中均显著降低,而遗传高危被试与健康对照之间无明显差异,提示眶额-杏仁核连接很可能与初次发病有关。本研究通过长程随访大样本CHR 被试,探索额叶-边缘系统功能连接特征在预测CHR 患者转化为精神分裂症中的作用。
1 对象与方法
1.1 研究对象
本研究数据来源于上海精神病临床高危队列研究(ShangHai At-Risk for Psychosis Program,SHARP)[6],共纳入CHR 患者164 例和健康对照组89 例。本研究方案经上海市精神卫生中心伦理委员会批准,并获得所有研究对象的书面知情同意。
CHR 患者在上海市精神卫生中心精神科门诊和上海市心理咨询中心门诊募集,纳入标准:①符合精神病高危综合征定式访谈(Structured Interview for Prodromal Syndromes,SIPS)和精神病高危症状量表(Scale of Prodromal Symptoms,SOPS)中文版的诊断标准[7]。② 年龄15 ~45 岁。③智商>69。④近3 个月内无美国《精神障碍诊断与统计手册(第四版)》(Diagnostic and Statistical Manual of Mental Disorders,4th ed. DSM- Ⅳ)中的物质相关障碍。⑤无DSM- Ⅳ轴Ⅰ精神障碍或相应既往史。⑥入组时尚未接受抗精神病药物治疗。本研究对CHR 组自然随访,由门诊医师根据患者症状及严重程度判断是否需服用抗精神病药物治疗。
根据随访1 年后的SIPS 评分将患者分为:①转化(CHR-C)组,1 年随访时SIPS 评分中至少有1 项阳性症状评分达到6 分,符合转化为精神分裂症发作标准[8]。② 症状(CHR-S)组,1 年随访时仍符合CHR 诊断标准。③缓解(CHR-R)组,1 年随访时症状缓解,不再符合CHR 诊断标准。
健康对照组在社区和互联网通过广告募集,纳入标准:①经SIPS/SOPS 筛查排除精神障碍。②年龄15 ~45 岁。 ③智商>69。④既往无精神障碍史或精神病性障碍家族史。⑤无DSM- Ⅳ中的物质相关障碍。
2 组对象的排除标准:①有感觉运动障碍、神经疾病或其他可能影响脑功能的躯体疾病。②有幽闭恐惧症无法接受磁共振扫描者。
1.2 磁共振影像采集
2 组对象基线入组时采集磁共振影像数据,在上海市精神卫生中心放射科完成,采用西门子3T 磁共振系统(Verio 型号)和32 通道头线圈扫描,获得结构像和静息态功能性磁共振成像(functional MRI,fMRI)。
结构像采集参数:使用MP-RAGE 序列,重复时间(time of repeatation,TR) =2 300 ms,回波时间(echo time,TE) =2.96 ms,翻转角为9°,FoV(field of view)=256 mm× 256 mm,体素大小为1 mm×1 mm×1 mm,矢状位连续扫描192 层,约9 min。
静息态fMRI 采集参数:使用EPI 序列,TR=2 500 ms,TE=30 ms,翻转角为90°,FoV=224 mm×224 mm,包含 149 个TR,体素大小为3.5 mm×3.5 mm×3.5 mm,轴状位连续扫描37 层,约6 min。在静息态fMRI 采集开始前,要求被试保持睁眼,不思考特定的事情。
1.3 磁共振影像分析
静息态fMRI 影像数据处理使用CONN 软件(18.b 版本)[9],预处理包括头动校正、对齐、标准化、平滑等步骤。使用CONN 软件中内嵌的ART(artifact detection tools)方法检测头动、生理信号等伪迹,对个体结构像进行分割生成灰质、白质和脑脊液模板。之后采用线性回归去除来自白质和脑脊液的BOLD 信号影响、来自头动的影响、ART 方法检测到的伪迹影响。最后进行带通滤波(0.01 ~0.08 Hz)。
预处理后的fMRI 数据采用感兴趣区(region of interest,ROI)分析,ROI 由Harvard-Oxford 皮层和皮层下结构脑图谱确定,分别选择:①主动加工网络的3 个ROI,内侧前额叶(media prefrontal cortex,mPFC)和双侧海马。②情绪加工网络的4 个ROI,双侧眶额皮层(orbitofrontal cortex,OFC)和双侧杏仁核。分别提取获得各ROI 内的BOLD 时序信号,计算ROI 和ROI 间的功能连接。
1.4 统计学分析
采用SPSS 20.0 软件进行统计分析,人口学中的定量资料用±s表示,额叶-边缘系统脑区间的功能连接指标用±表示。人口学变量中年龄、受教育年限首先用Kolmogorov-Smirnov 检验检测数据正态性,因年龄和教育程度不符合正态分布,故组间比较采用Mann-WhitneyU检验,CHR 亚组间比较采用Kruskal-WallisH检验。定性资料用频数表示,组间比较采用χ2检验。CHR 亚组的SIPS 各项评分符合正态分布,故采用单因素方差分析。计算出的ROI 间的功能连接进行2 个阶段的统计分析:① 采用双因素方差分析比较CHR 组与健康对照组在不同脑区间功能连接的组间差异,组内因素脑区包括额叶-边缘系统脑区间的12 对功能连接(mPFC-双侧海马、mPFC-双侧杏仁核、双侧OFC-双侧海马、双侧OFC-双侧杏仁核)。②采用双因素方差分析比较3 个CHR 亚组和健康对照组在不同脑区间功能连接的组间差异。当存在显著的组别和脑区交互效应时,进一步采用简单效应分析。功能连接与SIPS 各症状维度评分相关性采用Pearson 相关分析。P<0.05 认为具有统计学意义。
2 结果
2.1 人口学和临床特征
CHR 组平均年龄为(18.71±4.85)岁,男82 例、女82 例,受教育年限为(10.47±2.73)年,未治疗期为(5.53±4.34)个月;年龄、性别和受教育年限与健康对照组差异均无统计学意义(均P>0.05)(表1)。164 例CHR患者中149 例(90.86%)完成了1 年的随访,其中转化为精神分裂症发作的占16.11%(24/149)。CHR 患者3 个亚组间的人口学及临床特征如表2 所示,年龄、受教育年限和SIPS 各症状维度评分间差异均无统计学意义(均P>0.05);CHR-C 组中男性比例较高,为70.83%,但亚组间差异无统计学意义(P=0.055)。
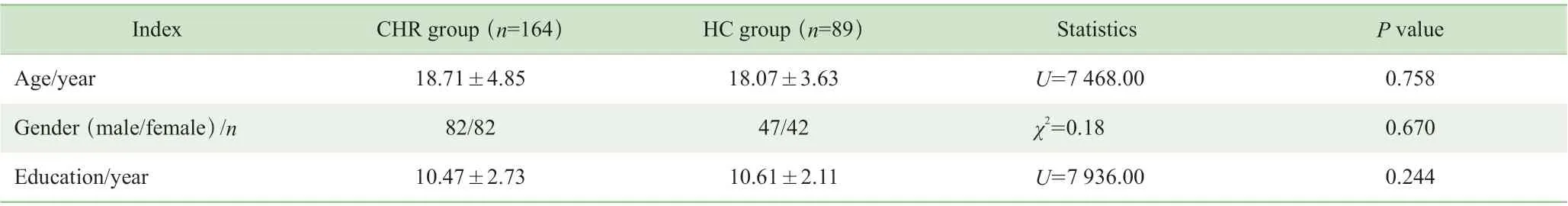
表1 CHR 组与健康对照组的人口学特征比较Tab 1 Comparisons of demographic characteristics between CHR group and healthy control (HC) group
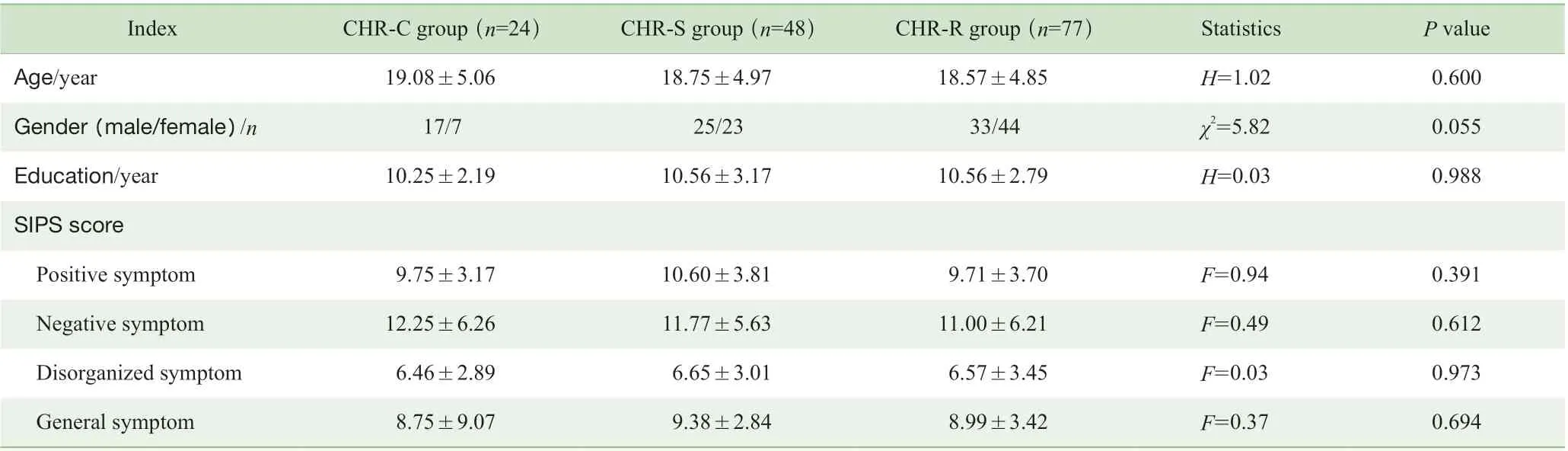
表2 CHR-C 组、CHR-S 组和CHR-R 组的人口学和临床特征比较Tab 2 Comparisons of demographic and clinical characteristics among CHR-C, CHR-S and CHR-R groups
2.2 CHR 组与健康对照组脑功能连接的差异
额叶-边缘系统脑功能连接的组别主效应不显著(F=2.56,P=0.110),脑 区 主 效 应 显 著(F=13.38,P=0.000),组别与脑区的交互作用显著(F=2.03,P=0.020)。后续简单效应分析结果如表3 所示:CHR 组左侧OFC 与左侧海马的功能连接强度小于健康对照组(P=0.002);左侧OFC 与右侧海马功能连接强度小于健康对照组,但差异无统计学意义(P=0.056);mPFC 与右侧杏仁核的功能连接强度大于健康对照组(P=0.021)。其他脑区功能连接在2 组间差异均无统计学意义(P>0.05)。
表3 CHR 组与健康对照组存在差异的脑功能连接(±)Tab 3 Different function connectivities between CHR group and HC group (±)
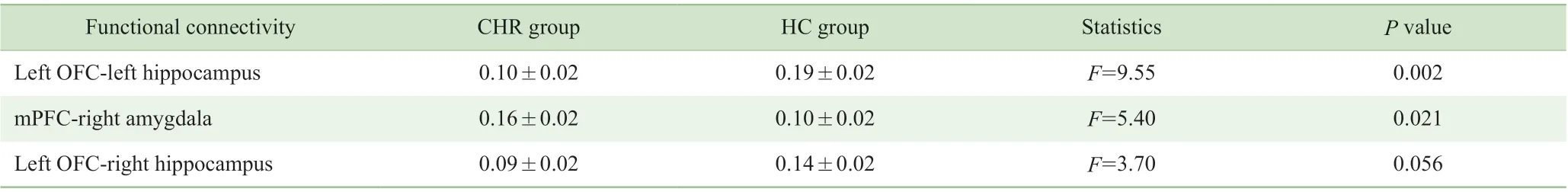
表3 CHR 组与健康对照组存在差异的脑功能连接(±)Tab 3 Different function connectivities between CHR group and HC group (±)
Functional connectivity CHR group HC group Statistics P value Left OFC-left hippocampus 0.10±0.02 0.19±0.02 F=9.55 0.002 mPFC-right amygdala 0.16±0.02 0.10±0.02 F=5.40 0.021 Left OFC-right hippocampus 0.09±0.02 0.14±0.02 F=3.70 0.056
2.3 3 个CHR 亚组的脑功能连接差异
将CHR 组根据1 年后的转归分为3 个亚组,额叶-边缘系统的脑功能连接存在显著的亚组与脑区交互作用(F=1.44,P=0.049)。后续简单效应分析(图1)提示:① 左侧OFC 与左侧(P=0.001)、右侧杏仁核(P=0.000)的功能连接强度在CHR 亚组间差异有统计学意义,CHR-C组显著低于其他3 组(均P<0.05)。②右侧OFC 与左侧(P=0.009)、右侧杏仁核(P=0.013)的功能连接强度也存在类似的亚组间差异。③左侧OFC 与左侧(P=0.023)、右侧海马(P=0.018)的功能连接强度也在CHR 亚组间差异有统计学意义,但表现有所不同,3 个CHR 亚组的左侧OFC-左侧海马功能连接强度均显著低于健康对照组(均P<0.05),而左侧OFC-右侧海马的功能连接强度以CHR-S 组最低,且显著低于健康对照组和CHR-R 组(均P<0.05)。④mPFC 与边缘系统脑区、右侧OFC 与双侧海马间功能连接强度在3 个CHR 亚组和健康对照组间差异均无统计学意义(均P>0.05)。
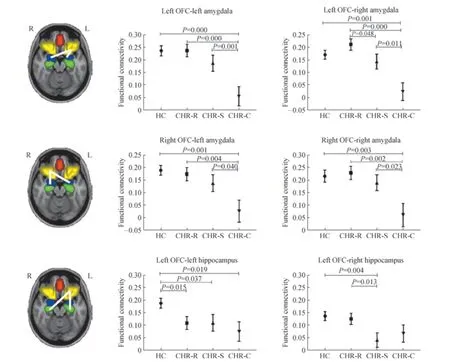
图1 3 个CHR 亚组及健康对照组的脑区功能连接差异Fig 1 Functional connectivity difference among three CHR subgroups and HC group
2.4 额叶-边缘系统脑功能连接与症状的相关性
采用Pearson 相关性检验,分析3 个CHR 亚组的额叶-边缘系统脑功能连接与其基线SIPS 评分中阳性症状、阴性症状、解体症状、一般症状评分的关系。结果发现,CHR-C 组左侧OFC-双侧海马及右侧OFC-左侧海马功能连接强度与阳性症状评分呈负相关(均P<0.05),左侧OFC-右侧杏仁核与阴性症状评分呈正相关(均P<0.05)。CHR-S 组和CHR-R 组的脑功能连接强度与症状间未发现显著相关性。
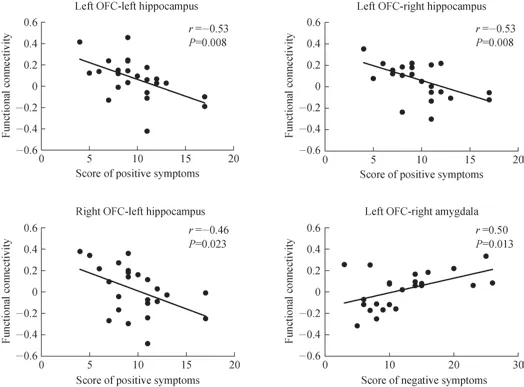
图2 CHR-C 组额叶-边缘系统功能与临床症状的相关性Fig 2 Correlations between the fronto-limbic functional connectivity and the severity of positive and negative symptoms in CHR-C group
3 讨论
精神分裂症的病因机制复杂,神经发育假说认为胚胎期或青春期的神经发育异常,使得患者具有易患性,进入青春期或成年早期后,不良社会应激会诱发精神病发作。本研究探索精神病CHR 患者处理社会应激相关的额叶-边缘系统的脑网络功能连接特征,揭示OFC-海马功能连接和OFC-杏仁核功能连接在精神病性症状产生和全面暴发中的不同作用。
对CHR 组进行1 年随访后,16.11%的患者转化为精神分裂症发作,51.68%精神病性症状缓解,32.21%仍符合CHR 诊断标准,这与以往研究[10]发现的CHR 患者1 年 转化率为15%~20%一致,其精神分裂症发病率远高于一般人群。但3 个CHR 亚组的患者在基线时表现出同样的弱化精神病性症状,阳性、阴性症状总分无显著差别,却发展为不同的临床结局,提示基于临床症状识别出的CHR 人群异质性高,结合生物学特征可能进一步提高精神分裂症早期识别的准确率[11]。北美精神病临床高危队列研究[12]前期发现额叶灰质体积减小、第三脑室增大的CHR 患者转化为精神分裂症发作的风险更高;欧洲精神病临床高危队列研究[13]发现转化为精神分裂症发作的CHR患者基线时左侧额叶白质完整性损伤比未转化的CHR 患者严重。因此,表现出类似症状的CHR 患者,其脑结构或功能活动可能存在不同变异,导致其临床结局的差异。
OFC-杏仁核的功能连接特征对CHR 患者是否会转化为精神分裂症发作敏感。CHR-C 组在基线时OFC-杏仁核功能连接强度显著降低,而CHR-R 组的OFC-杏仁核功能连接强度与健康对照组无显著差异,较低的OFC-杏仁核功能连接特征可能提示更高的发病风险。OFC 和杏仁核是处理社会应激的起始站,当外界社会刺激具有威胁时,海马会向杏仁核传递环境的细节信息,OFC 皮层则会调节杏仁核的输出从而调节恐惧反应和情绪表达[14]。Lederbogen 等[15]的研究发现慢性社会应激会改变被试的杏仁核活动,降低杏仁核-前额叶的功能连接。Wojtalik等[16]的meta 分析也发现,精神分裂症患者杏仁核、mPFC和前扣带回越活跃,患者的整体功能评分和社会功能评分越高。Mukherjee 等[17]采用社会认知下的fMRI 研究发现,精神分裂症患者杏仁核和脑岛活动减弱,与精神分裂症社会认知功能损伤有关,而额叶、内侧顶叶活动激活可能是一个补偿机制。Anticevic 等[5]的研究中只在精神分裂症首发和慢性患者中观察到OFC-杏仁核功能连接强度降低,而无精神病性症状的精神分裂症亲属无显著异常。因此,OFC-杏仁核功能连接异常的CHR 患者应对社会应激的情绪处理能力受损可能更为严重,之后转化为精神分裂症的风险越高。
CHR 患者的OFC-海马功能连接与OFC-杏仁核有不同的变异特征,OFC-杏仁核异常仅在CHR-C 组显著降低,而左侧眶额-海马功能连接强度在3 个CHR 亚组均较健康对照组显著降低。海马神经回路损伤可能导致记忆固化功能受损,与患者的妄想、幻觉等阳性症状的产生相关[18]。van Erp 等[19]的meta 分析发现精神分裂症患者皮层下结构体积降低最显著的为双侧海马。海马体积与功能结局关系密切,且受病程影响,首发患者效应比慢性患者更强[16]。我们研究进一步发现,CHR-C 组左侧OFC-双侧海马、右侧OFC-左侧海马的功能连接降低与阳性症状的严重程度呈负相关。因此,OFC-海马功能连接异常从CHR 到发病均存在,很可能是精神分裂症发病的必要条件但非充分条件,不能作为精神分裂症发病的预测 指标。
综上所述,额叶-边缘系统在精神分裂症症状产生和进展中可能起关键作用,且OFC-杏仁核和OFC-海马功能连接的作用又有所不同。已出现弱化阳性症状的CHR患者整体表现出OFC-海马功能连接低下,但之后进展为精神分裂症发作的CHR 患者基线时可能同时存在OFC-杏仁核功能连接低下,导致CHR 患者处理社会应激的能力损伤。本研究有2 点不足之处:①本研究采用自然随访,大部分CHR 患者完成基线评估后会服用小剂量抗精神病药物,不能排除药物干预对1 年随访时患者临床结局的影响。目前有一定证据支持小剂量抗精神病药物对CHR 患者可能短期有效,降低精神分裂症转化率[20],但未能在1 年以上的长期随访中观察到这一现象;而我们的前期研究[21]发现,症状严重的CHR 患者是否接受抗精神病药物干预并不影响其转化率。②本研究中未采用社会认知行为学评估,无法直接检测OFC-杏仁核功能连接与CHR 患者社会认知功能的关系。今后进一步增加社会认知功能评估和长程随访,将为明确额叶-边缘系统在精神分裂症发病机制中的作用提供更充分的证据,也为开发精神分裂症的早期干预手段提供新线索。
参·考·文·献
[1] Huang YQ, Wang Y, Wang H, et al. Prevalence of mental disorders in China: a cross-sectional epidemiological study[J]. Lancet Psychiatry, 2019, 6(3): 211-224.
[2] Cannon TD. How schizophrenia develops: cognitive and brain mechanisms underlying onset of psychosis[J]. Trends Cogn Sci, 2015, 19(12): 744-756.
[3] Zhang TH, Cui HR, Tang YY, et al. Correlation of social cognition and neurocognition on psychotic outcome: a naturalistic follow-up study of subjects with attenuated psychosis syndrome[J]. Sci Rep, 2016, 6: 35017.
[4] Reinwald JR, Becker R, Mallien AS, et al. Neural mechanisms of early-life social stress as a developmental risk factor for severe psychiatric disorders[J]. Biol Psychiatry, 2018, 84(2): 116-128.
[5] Anticevic A, Tang Y, Cho YT, et al. Amygdala connectivity differs among chronic, early course, and individuals at risk for developing schizophrenia[J]. Schizophr Bull, 2014, 40(5): 1105-1116.
[6] Zhang TH, Li HJ, Tang YY, et al. Validating the predictive accuracy of the NAPLS-2 psychosis risk calculator in a clinical high-risk sample from the SHARP (ShangHai At Risk for Psychosis) program[J]. Am J Psychiatry, 2018, 175(9): 906-908.
[7] 郑丽娜, 王继军, 张天宏, 等. 中文版精神病高危症状量表的信度和效度[J].中国心理卫生杂志, 2012, 26(8): 571-576.
[8] Zhang TH, Li HJ, Woodberry KA, et al. Prodromal psychosis detection in a counseling center population in China: an epidemiological and clinical study[J]. Schizophr Res, 2014, 152(2-3): 391-399.
[9] Whitfield-Gabrieli S, Nieto-Castanon A. Conn: a functional connectivity toolbox for correlated and anticorrelated brain networks[J].Brain Connect, 2012, 2(3): 125-141.
[10] Fusar-Poli P, Cappucciati M, Borgwardt S, et al. Heterogeneity of psychosis risk within individuals at clinical high risk: a meta-analytical stratification[J]. JAMA Psychiatry, 2016, 73(2): 113-120.
[11] Cannon TD, Yu CH, Addington J, et al. An individualized risk calculator for research in prodromal psychosis[J]. Am J Psychiatry, 2016, 173(10): 980-988.
[12] Cannon TD, Chung Y, He G, et al. Progressive reduction in cortical thickness as psychosis develops: a multisite longitudinal neuroimaging study of youth at elevated clinical risk[J]. Biol Psychiatry, 2015, 77(2): 147-157.
[13] Carletti F, Woolley JB, Bhattacharyya S, et al. Alterations in white matter evident before the onset of psychosis[J]. Schizophr Bull, 2012, 38(6): 1170-1179.
[14] Meyer-Lindenberg A, Tost H. Neural mechanisms of social risk for psychiatric disorders[J]. Nat Neurosci, 2012, 15(5): 663-668.
[15] Lederbogen F, Kirsch P, Haddad L, et al. City living and urban upbringing affect neural social stress processing in humans[J]. Nature, 2011, 474(7352): 498-501.
[16] Wojtalik JA, Smith MJ, Keshavan MS, et al. A systematic and meta-analytic review of neural correlates of functional outcome in schizophrenia[J]. Schizophr Bull, 2017, 43(6): 1329-1347.
[17] Mukherjee P, Whalley HC, McKirdy JW, et al. Altered amygdala connectivity within the social brain in schizophrenia[J]. Schizophr Bull, 2014, 40(1): 152-160.
[18] Goff DC, Zeng B, Ardekani BA, et al. Association of hippocampal atrophy with duration of untreated psychosis and molecular biomarkers during initial antipsychotic treatment of first-episode psychosis[J].JAMA Psychiatry, 2018, 75(4): 370-378.
[19] van Erp TGM, Hibar DP, Rasmussen JM, et al. Subcortical brain volume abnormalities in 2 028 individuals with schizophrenia and 2540 healthy controlsviathe ENIGMA consortium[J]. Mol Psychiatry, 2016, 21(4): 547-553.
[20] Fusar-Poli P, Davies C, Solmi M, et al. Preventive treatments for psychosis: umbrella review (just the evidence)[J]. Front Psychiatry, 2019, 10: 764.
[21] Zhang TH, Xu LH, Tang XC, et al. Real-world effectiveness of antipsychotic treatment in psychosis prevention in a 3-year cohort of 517 individuals at clinical high risk from the SHARP (ShangHai At Risk for Psychosis)[J]. Aust N Z J Psychiatry, 2020, 54(7): 696-706.

