强直性脊柱炎发病机制中的细胞自噬
唐乙萍,董曾荣,青玉凤
强直性脊柱炎(ankylosing spondylitis, AS) 是一种免疫相关的炎症反应性疾病,病变主要累及中轴骨及骶髂关节。AS起病隐匿,进展缓慢,常于青年时期起病,疾病发展到后期可出现关节的强直和纤维化最终导致残疾,给患者个人、家庭及社会带来极大负担。根据目前的研究,AS发病与遗传、免疫、环境等因素密切相关,且普遍认为遗传因素起主导作用,但其具体的发病机制仍不清楚[1]。
细胞自噬(autophagy)是细胞内物质分解代谢的重要过程,一方面,参与机体中最基础的生化反应;另一方面,自噬的失调也影响着许多疾病的发生发展,例如:肿瘤、神经退行性变和心血管疾病等[2-4]。随着人们对细胞自噬研究的深入,其与AS发病的相关性也得到了越来越多的关注。近年来,有研究团队发现AS患者体内存在自噬相关基因(autophagy-related gene, ATG)的异常表达[5],这对AS发病机制的研究提供了新的思路。本文对近年来自噬在AS发病机制的最新研究作一综述。
1 细胞自噬
细胞自噬是细胞循环利用自身物质的重要过程。20世纪60年代前后人们发现了“自噬”,之后的几十年里,自噬相关的研究没有明显突破,直至20世纪90年代,大隅良典发现了第一个自噬相关基因, 人们对自噬的研究才步入了新的阶段。
1.1 细胞自噬的分类
根据底物进入溶酶体的方式,细胞自噬分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)。巨自噬是细胞自噬的主要方式,在胞质中形成自噬体(autophagosome),包裹底物后与溶酶体融合,在多种水解酶的作用下将底物降解;微自噬是溶酶体自身吞噬底物后,直接进行降解;CMA是由同源热休克蛋白70分子伴侣识别含有类似于KFERQ(赖氨酸-苯丙氨酸-谷氨酸-精氨酸-谷氨酰胺)的五肽序列的可溶性蛋白质,并通过溶酶体膜受体溶酶体相关膜蛋白2A型转运穿过溶酶体膜,最终底物在溶酶体内被降解[6]。本文主要围绕巨自噬进行展开,以下所提到的自噬无特殊说明均指巨自噬。
1.2 自噬的形成
通常情况下,细胞保持着较低的自噬水平,以维持细胞内稳态。当细胞处于饥饿、缺氧等状态时,自噬将迅速被激活,从而起到保护细胞,增强细胞对环境的适应能力的作用。自噬作用的步骤可分为: 起始、延伸成核、成熟和降解(图1),全程由自噬相关基因及其编码的蛋白严格调控[7]。
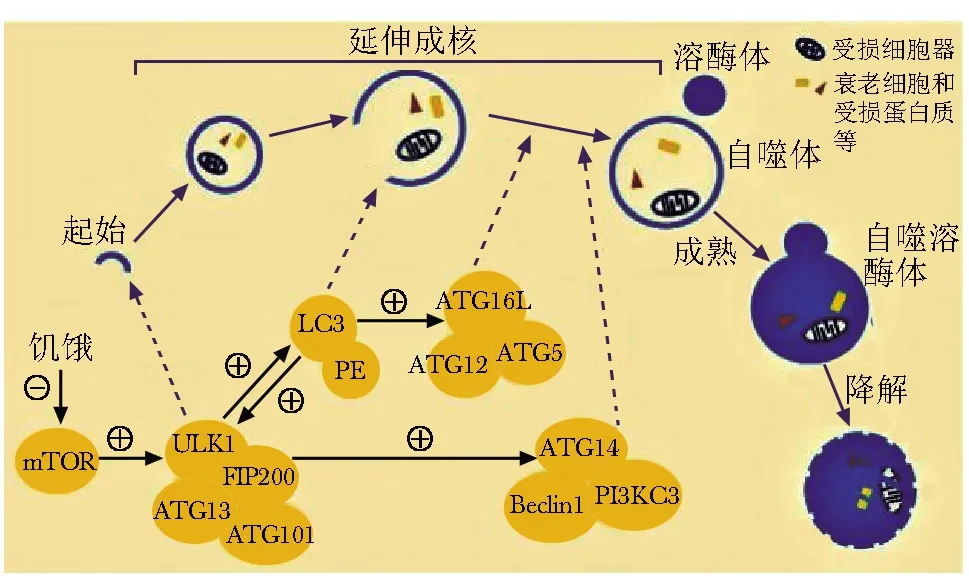
图 1 自噬的形成Fig 1 Formation of autophagy
细胞缺乏营养时,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的活性受到抑制,使unc51样自噬激活激酶1(unc-51-like kinases 1, ULK1)和ATG13磷酸化,并与ATG101、200 kD的粘着斑激酶家族相互作用蛋白(focal adhesion kinase family interacting protein of 200 kD, FIP200)共同构成蛋白质复合物,诱导自噬的起始[8-9];ULK1复合物与ATG14-Ⅲ型磷脂酰肌醇-3激酶(class Ⅲ phosphoinositide 3-kinase, PIK3C3)复合物相互作用,促使ATG14磷酸化,形成ATG14-PIK3C3-Beclin1复合物[10],该复合物将募集ATG12、ATG5、ATG16L1、微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, LC3) 等物质[9],并在泛素激活酶E1和泛素结合酶E2的催化下形成ATG12-ATG5-ATG16L1复合物,ATG16L1复合物将发挥泛素连接酶E3的作用使LC3与磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)结合[11],促进自噬体的延伸成核[12]。此后,在一系列自噬相关蛋白的调控下形成成熟的自噬体[13-14],并与溶酶体结合为自噬溶酶体,对包裹的底物进行代谢、降解,并转运至细胞质,进行新一轮的利用[15]。
2 细胞自噬与自身免疫性疾病的关系
越来越多的研究表明,自噬参与调节机体的固有免疫和获得性免疫[16]。生理情况下,树突状细胞、巨噬细胞等识别并呈递抗原,激活细胞表面Toll样受体、NOD样受体等模式识别受体,触发LC3介导的自噬并清除病原体[17]。在主要组织相容性复合体(major histocompatibility complex, MHC)呈递抗原的过程中,自噬可参与抗原的呈递加工,同时自噬体可与MHC Ⅱ类分子融合,对自噬体内的物质进行处理[18]。此外,细胞自噬还参与胸腺选择、T细胞活化、B细胞发育等活动。自噬表达异常时,可引起机体内免疫调节的紊乱,参与自身免疫性疾病的发病。有研究发现自噬相关基因免疫相关鸟苷三磷酸酶基因(immunity-related GTPase family M, IRGM)多态性与炎症性肠病(inflammatory bowel disease, IBD)、系统性红斑狼疮(systemic lupus erythematosus, SLE)以及自身免疫性甲状腺疾病[19]的易感性相关,还有研究表明ATG5是SLE、类风湿关节炎的易感性基因[20]。此外,在银屑病、多发性硬化等自身免疫性疾病中也观察到自噬相关基因的异常表达[21]。在自身免疫性疾病中,异常的自噬往往导致机体清除凋亡细胞障碍,抗原呈递异常以及自身抗体产生异常,最终参与自身免疫性疾病的发病[17]。
3 细胞自噬与AS发生发展的关系
细胞自噬不仅对维持机体内环境的稳态起着重要作用, 还与许多疾病的病理过程有着密不可分的联系。随着人们对自噬研究的深入,越来越多的研究团队发现了自噬与AS发病的相关性。
3.1 自噬相关基因与AS易感性的联系
为寻找AS与细胞自噬的联系,有研究团队将自噬基因单核苷酸多态性(single nucleotide polymorphism, SNP)与AS的相关性进行了分析。该团队主要针对中国汉族AS人群的情况,分别对IRGM、ATG16L1和ULK1进行了相关实验。
在基于IBD与AS有相似遗传特性的认识上, 发现,在女性AS中已验证的IBD相关的自噬基因IRGM多态性中rs495884CC基因型较CT+TT(OR=0.514,95%CI= 0.301~0.876,P=0.014)和CT(OR=0.518,95%CI=0.297~0.902,P= 0.020)的携带者罹患AS的风险显着降低;同时还发现了与女性相关的危险性单倍型rs4958846C-rs10065172C(OR=2.093,95%CI=1.301~3.368)和保护性单倍型rs4958846T-rs10065172C(OR=0.652,95%CI=0.441~0.964),提示自噬基因IRGM与中国汉族女性AS的易感性相关[22]。随后该团队对ULK1和ATG16L1基因SNP进行了分析。在5个ULK1基因SNP中发现rs9652059 (OR=0.796,95%CI=0.638~0.994,P=0.044)等位基因C变异为T时可以增加AS易感性,rs9652059C-rs4964879G(OR=0.834,95%CI=0.706-0.985,P=0.0328),rs9652059C-rs11616018T(OR=0.846,95%CI=0.717~1.000,P=0.0493)和rs9652059T-rs11616018T(OR=1.440,95%CI=0.999~2.076,P=0.0498)的单倍型可能与AS相关[23]。而在ATG16L1基因SNP的分析中发现未经Bonferroni校正前,中国汉族女性中,rs4663421(OR=0.391,95%CI=0.175~0.876,P=0.019)和rs6758317(OR=0.499,95%CI=0.263~0.949,P=0.032)会降低AS的患病风险,ATG16L1基因的TT单倍型(OR=2.003,95%CI=1.053~3.808,P=0.032)会增加风险,提示ATG16L1可能与女性AS易感性相关[24]。
目前在AS易感性的研究中,主要对象是中国汉族人群,其他族群的研究还未见到相关报道,且在已有的研究中,提示与女性AS相关的SNP更有统计学意义,这也提示我们AS发病中的性别差异可能与自噬相关。
3.2 自噬相关基因在AS中的表达
研究表明, 自噬相关基因在AS患者中存在不同程度的异常表达。Park等[5]通过测定LC3,beclin1和ATG5的mRNA在AS组及健康对照组外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中的表达水平,发现这3种mRNA在AS患者的PBMC中的表达较健康对照组显著降低,且其与TNF-α,IL-17和IL-23等炎症指标的血清浓度以及影像学所示的脊柱损伤程度呈负相关。Wang等[25]在研究miRNA-199a-5p和自噬相关基因的表达关系中也观察到了LC3,beclin1和ATG5的mRNA在AS组PBMC中的表达较健康对照组显著降低。此外还发现AS患者miR-199a-5p在T细胞中表达下调,伴随着自噬水平的抑制和促炎细胞因子的释放增加,且与放射学严重程度呈负相关。通过二者的研究,可见在患者PBMCs和T细胞中存在自噬缺陷或表达不足,提示自噬在AS的发生发展中起到一定作用。
不同于Park和Wang等人的发现,Ciccia等[26]在慢性AS患者的回肠中检测到LC3Ⅱ,ATG5和ATG12的上调, 但同时也观察到CMA标志物HSPA8和HSP90AA1在AS患者的肠道显著下调(P<0.000 1)。为进一步确认自噬基因的差异表达,该团队在蛋白表达水平也进行了相应的实验,其结果之前的结论一致,认为在AS患者体内存在自噬的激活。在Ciccia等发表其实验结果后不久,Neerinckx等[27]对其提出了疑问,在Neerinckx 等人的研究中,自噬相关基因在AS患者的滑膜组织中未发现与正常人有统计学意义的差异,而在PBMC中是下调的表现,并无自噬激活的证据。对于双方实验观察完全相反的情况,Neerinckx等认为自噬相关基因在AS的表达中可能具有组织特异性。之后,Ciccia等[28]针对该情况,提出自噬激活可能是与肠道微生物群有关,自噬相关基因可能受到特定肠道微生物群的调节。
通过以上的研究,可以发现自噬在AS患者中存在不同程度的表达异常,且该表达可能具有组织特异性。
3.3 自噬参与AS发病的机制研究
有证据表明细菌感染可能在AS发生发展中起重要作用,基于这一认识,有团队发现在AS患者和健康者的间充质干细胞(mesenchymal stem cell, MSC)中自噬的表达无明显差异,但用脂多糖(lipopolysaccharide, LPS)刺激后,AS患者间充质干细胞(ankylosing spondylitis mesenchymal stem cell, ASMSC)中LPS诱导的自噬受损。在其进一步的研究中发现,ASMSC中Beclin1磷酸化被抑制,导致肿瘤坏死因子受体相关因子4(tumor necrosis factor receptor-associated factor 4, TRAF4)表达增加,进而损害细胞的自噬[29]。
在Zhai等[30]的研究中,AS外周血非经典单核细胞中的肿瘤坏死因子α诱导蛋白3(tumor necrosis factor-alpha-induced protein 3, TNFAIP3)表达减少。正常单核细胞中,TNFAIP3诱导自噬,在LPS诱导炎性小体激活的早期阶段抑制炎性小体的形成,阻止炎症的浸润,即在LPS刺激后,TNFAIP3和含有mTOR相互作用蛋白的DEP结构域(DEP domain containing mTOR-interacting protein, DEPTOR)相互作用,共同促进自噬激活,以防止NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)炎性小体形成,而在AS非经典单核细胞中,TNFAIP3和DEPTOR缺乏,导致自噬水平下降,使NLRP3分泌增加,促进炎症浸润。
已知AS发病是遗传、感染、免疫等多方因素共同作用,而自噬作为其中一环可能参与到各个因素的作用中,进而影响AS的发生发展。
4 总结和展望
自噬作为一种调节细胞稳态的重要机制,参与了AS的发生发展。AS患者的组织细胞在疾病进展中往往伴随自噬相关基因异常表达,自噬功能的下调可能会加重AS的炎症浸润及脊柱损伤。在AS患者细胞中,自噬相关基因的表达存在组织特异性,可能是由于自噬在不同组织中存在多种的表达路径,不同的自噬相关基因参与不同组织的表达,也有可能与肠道微生物群有关。随着研究的继续深入,自噬在AS的发病机制中的作用及作用方式将越来越清楚。未来,对于不同患者不同的炎症表现,不同的组织受累情况,可以针对性地使用靶向药物将细胞自噬水平上调或下调,从而达到缓解症状,控制疾病进展的目的。也可以进一步研究自噬在AS中的作用及其组织特异性,深入到其分子机制进行研究,寻找相关通路,最终达到靶向治疗的目的。相信自噬在AS未来的研究中会有所突破,并给AS患者带来新的福音。

