右美托咪定减轻兔脊髓缺血再灌注损伤的机制研究*
樊晓娜,刘娇,池卉,袁芬,胡霁
(华中科技大学同济医学院附属梨园医院 麻醉科,湖北 武汉 430077)
α2肾上腺素受体激动剂——右美托咪定(Dexmedetomidine, Dex),因其优越的抗焦虑及镇静作用,被广泛应用于临床麻醉和重症监护[1]。此外,它对神经系统的保护作用,在体内外动物模型中均已得到证实[2-3]。研究表明,在脊髓缺血前及缺血期给予实验动物Dex,可显著增加其脊髓神经元的存活率[4]。然而,当Dex 被持续应用至再灌注期间时,其效应及效应机制如何,尚未明确。信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种调节编码参与多种过程的蛋白质基因表达的转录因子,包括炎症、凋亡、血管生成、细胞信号转导和细胞应激反应等[4]。研究表明,Janus 激酶2(Janus kinase 2, JAK2)/STAT3 信号通路的激活,能够通过其抗凋亡及抗炎等作用机制,保护器官组织免受缺血再灌注(ischemia reperfusion, I/R)损伤[6-7]。在小鼠脊髓缺血再灌注损伤(spinal cord ischemiareperfusion injury, SCIRI)模型中,OSUKA 等[8]也认为磷酸化的STAT3 可通过转运至细胞核,刺激相关基因转录,减轻神经组织损伤。而Dex 对JAK2/STAT3通路的这种激活作用,在脑保护相关机制研究中已经得到证实[9]。那么,Dex对SCIRI的减轻作用是否与其激活JAK2/STAT3 信号通路,进而调节下游信号分子的表达,以抑制脊髓炎症及神经细胞凋亡有关,未有相关研究报道。本研究将通过复制兔SCIRI模型,探讨Dex 对SCIRI 的作用及机制。
1 材料与方法
1.1 主要试剂与仪器
兔抗p-JAK2(美国Biocompare 公司),p-STAT3(中国博奥森生物技术有限公司),活化型半胱天冬酶-3(Cleaved Caspase-3)(英国Abcam 公司),肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)(美国Lsbio 公司)抗体,山羊抗兔二抗、RIPA 总蛋白裂解液、SDS-PAGE 凝胶制备试剂盒、磷酸化蛋白酶抑制剂、BCA 蛋白浓度测定试剂盒、5×蛋白上样缓冲液(南非Aspen 公司),原位末端转移酶标记(TUNEL)试剂盒(瑞士Roche 公司),DAPI 染液(中国阿斯本生物技术有限公司)。超净工作台(中国苏净安泰空气技术有限公司),酶标仪(美国Diatek 公司),普通光学显微镜、倒置显微镜(日本Olympus 公司),成像系统(美国Q-Imaging 公司)。
1.2 实验动物及模型复制方法
健康成年新西兰大耳白兔78 只,体重2.0 ~2.2kg(湖北逸挚诚生物科技有限公司提供)。兔左耳缘静脉穿刺置管后,用戊巴比妥钠静脉注射(30mg/kg)麻醉。根据其生命体征和肌肉松弛情况,静脉滴注1%戊巴比妥钠维持麻醉。应确保动物能自主呼吸,并用电热毯保温使直肠温度保持在(38.5±0.5)℃。术中监测中心动脉血压、心率和血氧饱和度。采用改良的Zivin 方法复制SCIRI 模型[10]。首先,将动物置于仰卧位,剃毛和消毒后,行胸腹正中切口。然后在肾动脉水平分离腹主动脉,并在距左肾动脉入口0.5cm 远的腹主动脉上放置动脉夹以诱导缺血。30min 后移除动脉夹。仔细检查动脉壁及脏器无损伤后,关闭腹腔。手术后,所有实验动物肌内注射庆大霉素4 万u 以防止感染,送回笼子喂养。实验程序符合华中科技大学同济医学院动物实验伦理准则(2018-0630)。
1.3 实验分组及过程
1.3.1 实验一为测定Dex 未干预情况下,SCIRI 过程中JAK2/STAT3 信号通路蛋白表达情况,将42 只新西兰大耳白兔随机分为假手术组(0 h 组)、再灌注后3 h、6 h、12 h、24 h、36 h 及48h 组,每组6 只。按1.2中方法复制SCIRI 模型,于再灌注后相应时间点,兔耳缘静脉注入空气20ml 处死各组实验兔,同1.7 中所述实验方法,取脊髓组织检测p-JAK2、p-STAT3 的表达。
1.3.2 实验二将36 只新西兰大耳白兔随机分为假手术组(Sham 组)、缺血再灌注损伤组(I/R 组)和Dex 干预组(Dex+I/R 组),每组12 只。Dex+I/R 组:按1.2 中方法复制SCIRI 模型,于缺血前30 min 将Dex 以10μg/(kg·h)的剂量从兔左耳缘静脉泵入,持续时间至再灌注后1h。I/R 组:按1.2 中方法复制SCIRI 模型,于缺血前30min 从兔左耳缘静脉泵入与Dex 等体积的生理盐水,直至再灌注后1h。Sham 组:按1.2 中方法,分离出腹主动脉,但不夹闭;与I/R 组相同,从兔左耳缘静脉泵入生理盐水。各组的研究时间点为再灌注损伤后48h,其中6 只用于血-脑屏障通透性检测,另外6 只用于其他相关检测。
1.4 神经运动功能评分
再灌注后48h,由1 位不清楚实验设计与分组的康复科医师,采用改良的Tarlov评分法[11],对实验兔(均为实验二动物)后肢运动功能进行评分。评分标准:0 分,无可觉察的后肢活动;1 分,有可觉察的关节自主活动;2 分,后肢可自由活动但无法站立;3 分,后肢可站立但不能正常行走;4 分,神经功能正常。
1.5 苏木精-伊红染色观察各组脊髓组织中神经元形态
运动功能评估完成后,采用随机数字表法,每组取6 只实验兔,经耳缘静脉内注入空气20ml 处死,取L4~6段新鲜脊髓一部分固定于4%多聚甲醛中,梯度酒精脱水后行石蜡包埋。修整好的蜡块置于石蜡切片机上切片,厚4μm。石蜡切片脱蜡至水后,进行苏木精-伊红(HE)染色,在光学显微镜下观察脊髓组织病理改变。
1.6 TUNEL 法及DAPI 染色检测神经细胞凋亡
石蜡切片脱蜡至水后,切片稍甩干,用免疫组织化学笔在组织周围画圈(防止液体流走),滴加蛋白酶K 工作液覆盖圈内组织,37℃孵育15min。加破膜工作液覆盖组织,常温下孵育10min。取TUNEL 试剂盒内适量试剂1(TdT)和试剂2(dUTP)按1 ∶9混合,覆盖圈内组织,切片平放于湿盒内,37℃水浴锅孵育60min。洗涤,滴加适量DAPI 染液至切片,室温避光孵育5min。洗涤,滴加抗荧光淬灭封片剂封片,荧光显微镜下观察并拍照。荧光显微镜下呈绿色荧光者即为凋亡神经细胞。随机选取5 个视野,计数各组凋亡神经细胞数目。
1.7 Western blotting 法检测相关蛋白表达
取脊髓的另一部分,提取总蛋白,BCA 蛋白浓度测定试剂盒测定样品蛋白浓度;制备12% SDSPAGE 凝胶,取蛋白样品进行上样、电泳;电泳完毕转至PVDF 膜,将转好的膜加入封闭液室温封闭1h;除去封闭液,加入稀释好的一抗p-JAK2(1 ∶500)、p-STAT3(1 ∶500)、Cleaved Caspased-3(1 ∶1000)、TNF-α(1 ∶500)及IL-6(1 ∶500)4℃过夜;洗涤后加入HRP 标记的二抗(1 ∶10000)室温孵育30min。滴加新鲜配制的ECL 混合溶液,暗室中曝光、显影。Alpha Ease FC 软件处理系统分析目标条带的灰度值,以目标条带与GAPDH 条带灰度值的比值表示目的蛋白的相对表达量。
1.8 伊文思蓝检测血-脑屏障的渗透性
对各组剩余6 只实验动物,于再灌注48h 后将2%伊文思蓝(10ml/kg)经耳缘静脉缓慢匀速注入。1h 后再次麻醉动物,打开胸腔暴露心脏,经升主动脉灌注生理盐水500ml/kg。取脊髓组织,一部分置入4%多聚甲醛内固定,沉糖,置入-20℃冷冻切片机上连续切片(10μm),于荧光显微镜绿色荧光激发模式下观察(伊文思蓝在绿色荧光激发下呈红色)。另一部分脊髓称重后浸泡于4ml 甲酰胺溶液中,60℃避光水浴24h 后离心取上清液,用酶标仪(632nm 处)检测光密度(OD)值。由绘制的标准曲线计算脊髓组织中伊文思蓝含量。
1.9 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用Tukey 法,P<0.05 为差异有统计学意义。
2 结果
2.1 SCIRI 过程中p-JAK2 和p-STAT3 表达情况
再灌注后3h、6h、12h、24h、36h 和48h组,脊髓组织中p-JAK2 的相对表达量分别为(0.079±0.039)、(0.137±0.060)、(0.305±0.041)、(0.440±0.054)、(0.197±0.063)和(0.112±0.042),0h 组表达量为(0.050±0.022),7 组比较,经方差分析,差异有统计学意义(F=50.656,P=0.000);再灌注后3h、6h、12h、24h、36h和48h组,脊髓组织中p-STAT3的相对表达量分别为(0.110±0.034)、(0.242±0.053)、(0.449±0.051)、(0.574±0.053)、(0.299±0.040)和(0.149±0.036),0h 组表达量为(0.089±0.031),7 组比较,经方差分析,差异有统计学意义(F=102.635,P=0.000)。与0h 组比较,再灌注后6h,脊髓组织中p-JAK2、p-STAT3 的表达升高(P<0.05);再灌注后24h 到达峰值(P<0.05);再灌注后48h,其表达与0h 组比较,差异无统计学意义(P>0.05)。见图1。
2.2 Dex 对SCIRI 后运动功能的影响
再灌注后48 h,各组Tarlov 评分结果分别为:Sham 组(4.000±0.000)、I/R 组(1.500±0.904)、Dex+I/R 组(2.917±0.668),经方差分析,差异有统计学意义(F=48.145,P=0.000)。Sham 组均无运动功能障碍;I/R 组评分低于Sham 组(P<0.05),其运动功能严重受损;与I/R 组比较,Dex+I/R 组评分提高(P<0.05),其运动功能障碍得到改善。见图2。
2.3 各组脊髓组织神经元形态
再灌注后48h,Sham 组脊髓组织结构完整,正常神经元数量较多;神经元呈清晰的多边形结构,胞浆均质红染;胞核形态正常、核仁明显。I/R 组脊髓组织结构被严重破坏,残存的正常神经元数量少,细胞间可见大量空泡形成;神经元多边形结构消失;胞核大量溶解。Dex+I/R 组脊髓组织结构基本完整,细胞间空泡较少,正常神经元较I/R 组多;神经元多边形结构基本存在;胞核形态大致正常,病理变化轻于I/R组。见图3。
2.4 各组脊髓组织凋亡神经细胞比较
再灌注后48h,各组凋亡神经细胞计数结果:Sham 组(2.933±1.799)%、I/R 组(39.967±10.918)%、Dex+I/R 组(12.867±3.501)%,经方差分析,差异有统计学意义(F=245.495,P=0.000)。进一步两两比较,I/R 组高于Sham 组(P<0.05),Dex+I/R 组低于I/R 组(P<0.05)。见图4。

图1 各组脊髓组织中p-JAK2、p-STAT3 蛋白表达

图2 各组神经功能评分
2.5 伊文思蓝在各组脊髓组织中的渗透情况
再灌注后48 h,Sham 组脊髓组织中几乎未见红色荧光,I/R 组红色荧光显著增强,而Dex+I/R 组红色荧光较I/R 组明显减弱。各组脊髓组织中伊文思蓝的渗透量分别为:Sham 组(1.757±1.162)μg/g、I/R 组(15.985±2.556)μg/g、Dex+I/R 组(8.868±2.365)μg/g,经方差分析,差异有统计学意义(F=67.597,P=0.000)。I/R 组脊髓组织中的伊文思蓝含量高于Sham组(P<0.05),血-脑屏障渗透性增强;与I/R 组比较,Dex+I/R 组的伊文思蓝含量减少(P<0.05),血-脑屏障渗透性降低。见图5。
2.6 Dex 对p-JAK2、p-STAT3、Cleaved Caspase-3、TNF-α、IL-6 蛋白相对表达的影响

图3 各组脊髓组织病理学结果 (HE 染色×100)

图4 各组脊髓组织凋亡神经细胞比较 (×100)

图5 再灌注48 h 后各组脊髓组织中伊文思蓝含量比较 (×200)
再灌注后48 h,各组脊髓组织中p-JAK2 蛋白相对表达量分别为:Sham 组(0.056±0.027)、I/R 组(0.113±0.046)、Dex+I/R 组(0.451±0.055),经方差分析,差异有统计学意义(F=139.649,P=0.000);各组p-STAT3蛋白相对表达量分别为:Sham 组(0.092±0.028)、I/R 组(0.142±0.044)、Dex+I/R 组(0.583±0.048),经方差分析,差异有统计学意义(F=261.611,P=0.000)。I/R 组p-JAK2、p-STAT3 蛋白相对表达量与Sham 组比较,差异无统计学意义(P>0.05);而Dex+I/R 组p-JAK2、p-STAT3 蛋白相对表达量较I/R组升高(P<0.05)。见图6。
再灌注后48 h,各组Cleaved Caspase-3 蛋白相对表达量分别为:Sham 组(0.054±0.026)、I/R 组(0.320±0.043)、Dex+I/R 组(0.155±0.025),经方差分析,差异有统计学意义(F=102.559,P=0.000);各组TNF-α 蛋白相对表达量分别为:Sham 组(0.061±0.033)、I/R 组(0.534±0.072)、Dex+I/R 组(0.248±0.074),经方差分析,差异有统计学意义(F=87.413,P=0.000);各组IL-6 蛋白相对表达量分别为:Sham组(0.148±0.040)、I/R 组(0.489±0.071)、Dex+I/R组(0.288±0.055),经方差分析,差异有统计学意义(F=54.199,P=0.000)。I/R 组Cleaved Caspase-3、TNF-α 及IL-6 蛋白相对表达量较Sham 组升高(P<0.05);而Dex+I/R 组Cleaved Caspase-3、TNF-α 及IL-6 蛋白相对表达量较I/R 组降低(P<0.05)。见图7、8。
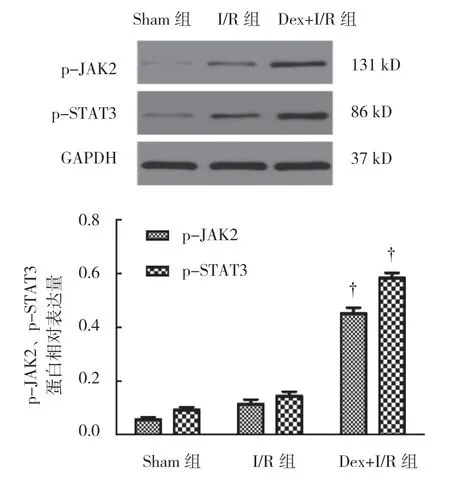
图6 各组脊髓组织中p-JAK2、p-STAT3 蛋白表达

图7 各组脊髓组织中Cleaved Caspase-3 蛋白表达

图8 各组脊髓组织中TNF-α 和IL-6 蛋白表达
3 讨论
SCIRI 作为胸腹主动脉术后最严重的并发症之一,可导致患者严重和长期的残疾。因此,改善这种破坏性状况的新举措具有十分重要的临床意义。本研究结果表明,Dex 在缺血前30min 直至再灌注后短期内(1h),能够改善新西兰大耳白兔SCIRI 后神经功能障碍,并减轻其脊髓组织学损伤。
在SCIRI 过程中,导致神经元丢失的病理生理学机制十分复杂。因此,揭示其潜在过程是实施新型神经保护疗法的关键。SCIRI 产生的主要原因是:术中脊髓组织缺血以及血流再恢复后,氧自由基大量生成、促炎因子释放和线粒体衰竭等造成“二次损伤”[12-14]。在这一过程中,促凋亡信号诱导的运动神经元延迟和选择性死亡,以及炎症导致的血-脑屏障结构的破坏,是脊髓不可逆损伤的关键。其中,细胞凋亡被认为是SCIRI 后神经元的主要死亡方式[15]。而血-脑屏障的完整性对维持中枢神经系统稳态和内环境稳定至关重要[16]。再灌注早期,血-脑屏障的破裂和出血导致免疫细胞(如中性粒细胞和巨噬细胞)浸润,引发炎症级联反应,进一步加重组织损伤[17]。因此,对血-脑屏障破坏的早期干预,可有效预防SCIRI。本研究结果显示,SCIRI 过程中,Dex 可减少凋亡神经细胞数,并降低血-脑屏障的渗透性。因此,在研究剂量内,对凋亡的抑制和血-脑屏障结构完整性的维持,可能是Dex 发挥其神经保护效应的关键。
JAK2/STAT3 信号通路的活化在老鼠器官的I/R损伤中发挥关键性的保护作用[18-19]。Caspase-3 是细胞凋亡信号的主要执行者,可由外源及内源性途径激活[20]。在体外通过氧糖剥夺模拟I/R 损伤发现,激活的JAK2/STAT3 信号通路,可通过提高Bcl-2/Bax 比值,从而降低Cleaved Caspase-3 水平,保护HT22 神经细胞免受凋亡[21]。该调节作用在心肌I/R 损伤的体外研究中,同样得到证实[22]。此外,活化的STAT3 还通过抑制下游炎症因子TNF-α、IL-6 的表达,减轻I/R损伤[7,23]。通过实验一,本研究发现,再灌注短期内,JAK2/STAT3 保护性通路被激活,但这种激活作用并未维持,这可能是导致SCIRI 加重的关键,OSUKA 等[8]的研究结果也证实了这一点。而Dex 能够激活JAK2/STAT3 信号通路,并抑制炎症因子(TNF-α、IL-6)及凋亡蛋白(Cleaved Caspase-3)的表达。因此,Dex可减轻SCIRI 的潜在机制可能与其激活JAK2/STAT3信号通路,从而对炎症与凋亡进行调控有关。
综上所述,在脊髓缺血前,直至再灌注短期内连续给予Dex,可作为一种相对安全的神经保护策略,应用于SCIRI 的预防及治疗过程。此外,对JAK2/STAT3 信号通路的调节,可能为进一步寻找新的脊髓神经保护策略提供分子靶点。再者,若Dex 以低剂量的镇静浓度持续应用于再灌注后48 h,是否能提供更稳定及有效的神经保护作用,值得探讨。

