栀子苷通过抑制TLR4/NF-κB信号通路减轻睡眠剥夺大鼠认知功能障碍*
赖根祥, 朱桂东, 何慧明
(1丽水市第二人民医院精神科,2丽水学院医学与健康学院科研办,浙江丽水323000)
睡眠剥夺是指机体因各种因素导致部分或全部正常睡眠量丧失的状态,睡眠剥夺可通过改变认知、感觉、精神活动等严重影响患者心理及生理健康。我国约80%疾病与睡眠质量障碍有关[1-3]。因此,研究睡眠剥夺对机体的影响机制及防治措施已成为近来研究热点之一。研究表明,认知功能障碍与海马炎症有关,Toll 样受体4/核因子κB(Toll-like receptor-4/nuclear factor-κB,TLR4/NF-κB)信号通路激活可参与细胞免疫应答、炎症反应及抗凋亡相关基因转录,与海马级联炎症反应密切相关[4]。栀子苷(geniposide,Gen)是从茜草科植物栀子干燥果实中提取的活性物质,具有抗炎、抗氧化、清热利湿、泻火除烦、凉血解毒和降血糖等多种药理活性[5-6]。有研究报道Gen 可通过抑制NF-κB p65 通路抑制炎症反应减轻脑损伤[7],从而改善糖尿病大鼠的认知功能障碍[8],但目前尚未发现有关于Gen改善睡眠剥夺大鼠认知障碍及机制的研究,因此,本研究建立完全睡眠剥夺大鼠模型,探讨Gen 对其认知障碍的影响及可能作用机制,以期为睡眠障碍患者的治疗提供新思路。
材料和方法
1 实验动物
8 周龄雄性清洁级Wistar 大鼠120 只,体质量210~230 g,购自扬州大学,动物生产许可证号为SCXK(苏)2018-0005。于本院实验动物房自由饮水、采食,室温23~25℃,12 h/12 h 光照、黑暗交替,适应性饲养1周。本研究经过伦理学认证。
2 主要试剂和仪器
栀子苷购自北京索宝莱生物科技有限公司;大鼠S100B ELISA 试剂盒、大鼠神经元特异性烯醇化酶(neuron-specific enolase,NSE)ELISA 试剂盒、大鼠白细胞介素 1β(interleukin-1β,IL-1β)ELISA 试剂盒、大鼠IL-6 ELISA 试剂盒、大鼠肿瘤坏死因子α(tumor necrosis factorα,TNF-α)ELISA 试剂盒、兔源TLR4 Ⅰ抗、NF-κB p65 Ⅰ抗、GAPDH Ⅰ抗和山羊抗兔IgGⅡ抗均购自Abcam。MODEL550 型酶标仪购自Thermo;Morris 水迷宫实验装置购自上海吉量软件科技有限公司;电泳仪购自Bio-Rad等。
3 方法
3.1 动物分组及睡眠剥夺模型的建立 120 只Wistar 大鼠随机分为正常对照(normal control,NC)组、模型(model,M)组、Gen 低剂量(low-dose Gen,Gen-L)组、Gen 中剂量(middle-dose Gen,Gen-M)组、Gen高剂量(high-dose Gen,Gen-H)组及 Gen-H+LPS(TLR4通路激活剂)组,每组20只。动物行为学实验结束后,考虑到后续实验方法、取材样本量和取材部位等问题,采用随机数字表法对每组20 只大鼠进行随机分组,每组5 只,分别用来进行HE 染色、RT-qPCR检测、Western blot检测和ELISA检测。
Gen-L、Gen-M和Gen-H 组分别给予 Gen 5 g/kg、10 g/kg和20 g/kg[8]灌胃,Gen-H+LPS 组大鼠每天尾静脉注射 0.4 mg/kg LPS(持续 7 d)激活 TLR4 通路[9]后给予Gen 20 g/kg 灌胃,NC 组和M 组给予等量生理盐水,每天灌胃1次,持续7 d。之后,M组、Gen-L组、Gen-M组和Gen-H组、Gen-H+LPS组采用改良小平台水环境法制备大鼠剥夺睡眠模型[10],制作30 cm×30 cm×30 cm 睡眠剥夺箱,中间放置直径7 cm,高8 cm圆形平台,平台周围注满水,水位低于平台1 cm,大鼠可在平台上自由饮水、采食,每天换水1 次,若其睡眠,则因肌肉松弛垂头触水而醒,大鼠只能重振精神爬上平台,这样反复多次达到剥夺睡眠的效果,进行72 h连续睡眠剥夺。
3.2 Morris 水迷宫实验 造模成功后,将各组15 只大鼠进行Morris 水迷宫适应性训练,水迷宫由黑色水池组成,水池为直径1.5 m 圆柱形,高50 cm。池内放有直径10 cm 的可移动实心平台隐藏于第一象限中间隔板下2 cm,水温保持19~21℃。将大鼠分别从各个象限面朝池壁放入水中,每天4 次,每次120 s,连续训练4 d,120 s 内找到平台的大鼠,找到平台时自动停止记录时间,让大鼠停留在平台上20 s;120 s 内仍未找到平台的大鼠,用导向杆将大鼠将引导至平台,时间记为120 s。检测实验:第5天拆除平台,从原放置平台对角方向将大鼠面朝池壁放入水中,计算并跟踪大鼠爬至平台上或达到预先设置的训练时长及计算大鼠寻找平台耗费的时间(即逃避潜伏期);若最终大鼠仍未找到平台,则逃避潜伏期记为60 s,重复4次求平均值。
3.3 Y 迷宫实验 Y 迷宫制作材质为聚氯乙烯板,呈“Y”形,将黑色胶纸贴于迷宫内外壁。迷宫分别由3 个臂隔离分为Ⅰ区、Ⅱ区和Ⅲ区3 个工作区,臂尺寸:长30 cm、宽8 cm、高15 cm,呈120°的夹角,三臂相交区域为隔离区。实验开始,随机选定1个Y迷宫臂为起始臂,整个过程黑色隔板挡住3 个臂末端,观察大鼠8 min 内进入各臂情况。连续3 次均进入不同的工作区,记正确1 次,否则视为错误。行为正确率(%)=正确次数/总检测次数×100%。
3.4 血清S100B 和NSE 水平的检测 各组大鼠采用2%戊巴比妥钠腹腔麻醉处死后采集腹主动脉血,离心后保留血清置于-80℃备用。采用ELLSA 法检测血清S100B 和NSE 的水平,具体步骤严格按照试剂盒说明书进行。
3.5 海马 IL-1β、IL-6和TNF-α 含量的检测 随机选取各组5 只大鼠麻醉处死,断头取脑,采集海马组织,迅速置于液氮中保存备用。制备海马组织匀浆液,采用ELLSA 法检测各组大鼠海马组织匀浆中IL-1β,IL-6 和TNF-α 含量,具体操作严格按照试剂盒说明书进行。
3.6 HE 染色 随机选取5 只大鼠采集海马组织CA3 区于4%多聚甲醛中固定,石蜡包埋组织,以6 μm 厚度进行切片保存备用。进行HE 染色,光镜下观察海马神经元形态学变化。
3.7 海马 TLR4 及 NF-κB p65 mRNA 水平的检测提取各组5 只大鼠海马组织总RNA,反转录得到cDNA,置于-20℃保存备用。采用RT-qPCR 检测TLR4及 NF-κB p65 的 mRNA 表达水平,反应条件为:95℃30 s;95℃ 5 s,60℃ 34 s,40 个循环,具体操作严格按照试剂盒说明书进行。TLR4 的上游引物序列为5′-CTCTCTACCTTAATATGA-3′,下游引物序列为5′-CCGATGTTAGAATAGGTTAGAAAG-3′;NF- κB p65 的上游引物序列为5′-ATGTGCATCGGCAAGTGG-3′,下游引物序列为 5′-CAGAAGTTGAGTTTCGGGTAG-3′;内参照GAPDH 的上游引物序列为5′-ACCACCATGGAGAAGGCTGG-3′,下游引物序列为5′-CTCAGTGTAGCCCAGGATGC-3′。采用 2-ΔΔCt法分析TLR4及NF-κB p65的mRNA相对表达水平。
3.8 海马TLR4 和NF-κB p65 蛋白表达量的检测采用 Western blot 检测海马组织 TLR4 及 NF-κB p65的蛋白表达量。蛋白提取试剂盒提取各组剩余5 只大鼠海马组织总蛋白,BCA 法测定蛋白质浓度,进行SDS-PAGE,并转膜、封闭,分别添加TLR4(1∶300)、NF-κB p65(1∶500)和 GAPDH(1∶2 000)抗体,4℃孵育过夜,添加Ⅱ抗IgG(1∶5 000)室温避光孵育1 h,增强化学发光法显影,蛋白条带灰度值用ImageJ 软件分析。
4 统计学处理
采用SPSS 25.0软件进行统计学分析,计量数据采用均数±标准差(mean±SD)表示,多组比较采用单因素方差分析,进一步两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠Morris水迷宫实验结果的比较
与NC 组比较,M 组大鼠逃避潜伏期显著延长(P<0.01);与M 组比较,Gen-L、Gen-M和Gen-H 组大鼠逃避潜伏期依次缩短(P<0.01);与Gen-H 组比较,Gen-H+LPS 组大鼠逃避潜伏期显著延长(P<0.01),见图1。

Figure 1.Compared results of Morris water maze experiment in each group.Mean±SD. n=20.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图1 各组大鼠Morris水迷宫实验结果的比较
2 各组大鼠Y迷宫行为学指标的比较
与NC 组比较,M 组大鼠行为正确率显著降低(P<0.01);与M 组比较,Gen-L、Gen-M和Gen-H 组大鼠行为正确率依次增加(P<0.01);与Gen-H 组比较,Gen-H+LPS 组大鼠行为正确率显著降低(P<0.01),见图2。

Figure 2.Comparison of behavioral indexes of Y maze in each group.Mean±SD. n=20.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图2 各组大鼠Y迷宫行为学指标的比较
3 各组大鼠海马神经元形态学的变化
NC 组大鼠海马神经元形态正常,胞核呈蓝染,核仁明显;M 组和Gen-H+LPS 组大鼠海马神经元细胞核固缩深染,细胞变形、凋亡明显;Gen-L、Gen-M和Gen-H组神经元形态病变减轻,见图3。
4 各组大鼠血清S100B和NSE蛋白水平的比较
与 NC 组比较,M 组大鼠海马 S100B和NSE 蛋白表达量显著增加(P<0.01);与M 组比较,Gen-L、Gen-M和Gen-H 组大鼠海马 S100B和NSE 蛋白表达量依次降低(P<0.01);与Gen-H 组比较,Gen-H+LPS 组大鼠海马S100B 和NSE 蛋白表达量显著增加(P<0.01),见图4。
5 各组大鼠海马 IL-1β、IL-6和TNF-α 含量的比较
与 NC 组比较,M 组大鼠海马 IL-1β、IL-6和TNF-α 含量显著增加(P<0.01);与M 组比较,Gen-L、Gen-M和Gen-H 组大鼠海马 IL-1β、IL-6和TNF-α 含量依次降低(P<0.05);与Gen-H 组比较,Gen-H+LPS 组大鼠海马 IL-1β、IL-6和TNF-α 含量显著增加(P<0.01),见图5。

Figure 3.Morphological changes of hippocampal neurons in each group(HE staining,×200).图3 各组大鼠海马神经元形态学变化
6 各组大鼠海马 TLR4 及 NF-κB p65 的 mRNA 水平比较
与 NC 组比较,M 组大鼠海马 TLR4 及 NF-κB p65 mRNA 水平显著增加(P<0.01);与 M 组比较,Gen-L、Gen-M和Gen-H 组大鼠海马 TLR4 及 NF-κB p65 mRNA 水平依次降低(P<0.01);与 Gen-H 组比较 ,Gen-H+LPS组大鼠海马TLR4及NF-κB p65 mRNA水平显著增加(P<0.01),见图6。

Figure 4.Comparison of serum S100B and NSE protein levels in each group.Mean±SD. n=20.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图4 各组大鼠血清S100B、NSE蛋白表达水平比较

Figure 5.Comparison of IL-1β,IL-6 and TNF-α contents in hippocampus of rats in each group.Mean ± SD. n=5.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图5 各组大鼠海马IL-1β、IL-6和TNF-α含量比较
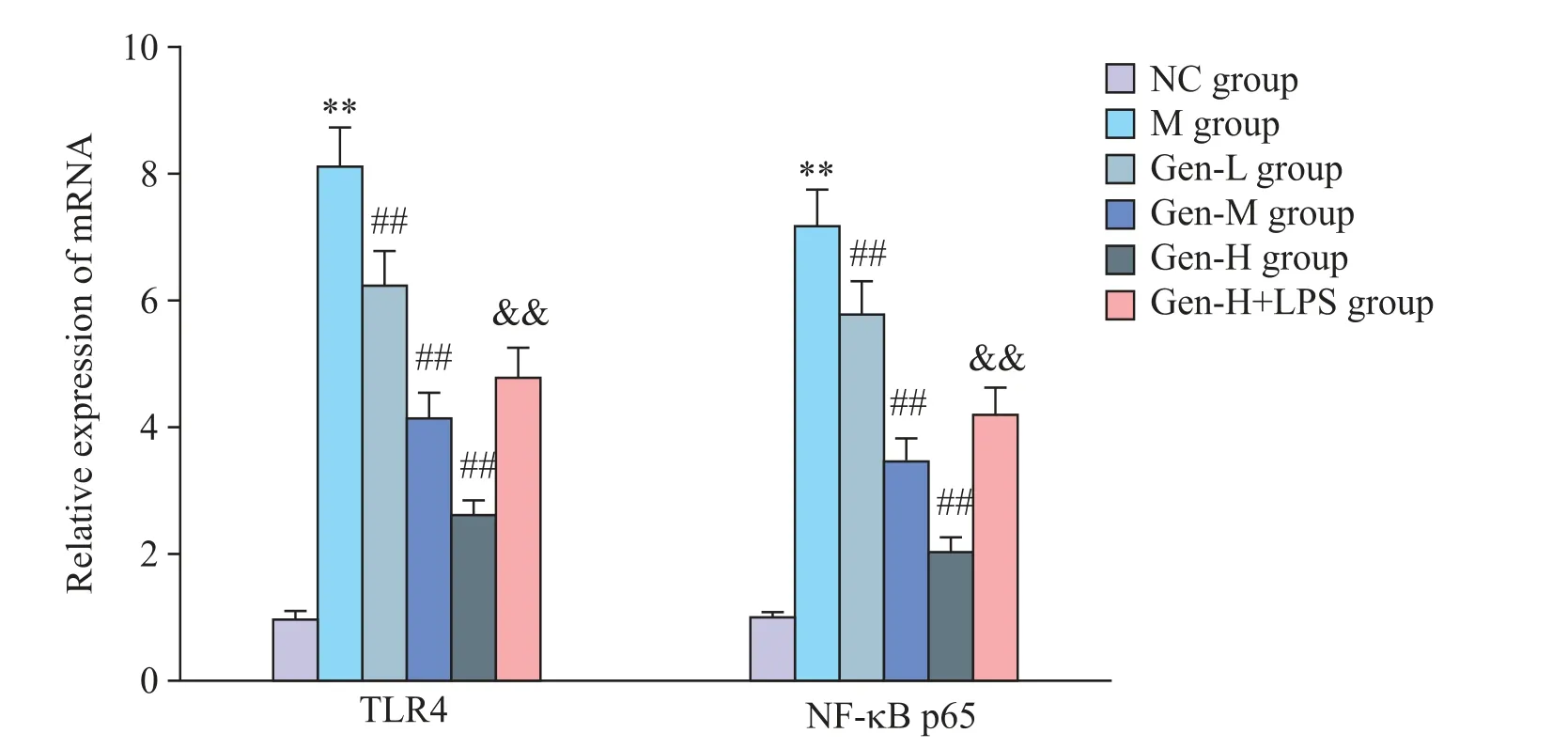
Figure 6.Comparison of mRNA levels of TLR4 and NF-κB p65 in hippocampus of rats in each group.Mean±SD. n=5.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图6 各组大鼠海马TLR4及NF-κB p65 mRNA水平比较
7 各组大鼠海马TLR4 和NF-κB p65 蛋白表达量的比较
与 NC 组比较,M 组大鼠海马 TLR4 及 NF-κB p65蛋白表达量显著增加(P<0.01);与M组比较,Gen-L、Gen-M和Gen-H 组大鼠海马 TLR4 及 NF-κB p65 蛋白表达量依次降低(P<0.01);与Gen-H 组比较,Gen-H+LPS 组大鼠海马 TLR4 及 NF-κB p65 蛋白表达量显著增加(P<0.01),见图7。
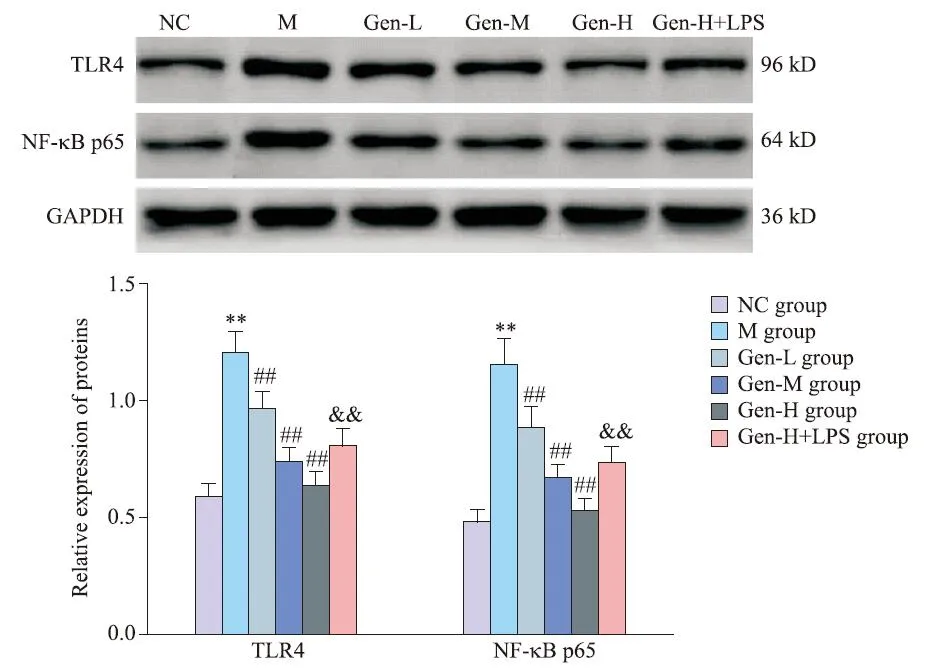
Figure 7.Comparison of protein expression of TLR4 and NF-κB p65 in hippocampus of rats in each group.Mean±SD. n=5.**P<0.01 vs NC group;##P<0.01 vs M group;&&P<0.01 vs Gen-H group.图7 各组大鼠海马TLR4和NF-κB p65蛋白表达量比较
讨 论
小平台水环境法是对大鼠进行睡眠剥夺处理的常用方法,此法可完全剥夺大鼠快波睡眠,且可阻止慢波睡眠和异相睡眠的发生,简单可靠。研究显示,睡眠具有抗氧化应激作用,睡眠剥夺可导致人体记忆力下降,情绪行为异常及脑海马组织应激损伤及炎症反应等[11-14]。崔建梅等[15]研究报道,睡眠剥夺可引起海马神经元损害,与对照组比较,睡眠剥夺模型大鼠工作记忆错误次数、参考记忆错误次数显著增加,正确反应次数减少、完成八臂迷宫时间显著延长。本研究结果发现,与NC 组比较,M 组大鼠逃避潜伏期显著延长、行为正确率显著降低,海马神经元损伤明显,血清S100B、NSE 蛋白表达显著增加。S100B 蛋白是由神经系统星形胶质细胞分泌的一种钙结合蛋白,主要存在于脑组织,可参与神经元信息传递,脑损伤时可释放入血;NSE 存在于神经元、神经外胚层细胞和红细胞中,血清NSE 水平是一种与脑损伤程度相关的诊断和预后指标;血清S100B 和NSE 蛋白含量增加,提示存在神经元、星形胶质细胞、神经末梢等脑微结构损伤,与失眠症严重程度或/认知功能障碍有关[16-17]。本研究结果表明睡眠剥夺后大鼠出现认知功能障碍,证实睡眠剥夺大鼠模型制备成功,可用于后续实验。本研究结果还发现,与模型组比较,Gen呈剂量依赖性缩短大鼠逃避潜伏期、增加其行为正确率,与陈晓燕等[8]研究报道的Gen 可有效改善糖尿病模型大鼠认知障碍的结果一致,提示Gen 可能对睡眠剥夺大鼠认知障碍具有一定改善作用。
栀子为茜草科植物,其重要成分为Gen,具有消炎、抗氧化和降血糖等作用。许玲夏等[6]研究报道,Gen 可降低非酒精性脂肪性肝炎大鼠肝组织IL-1β、IL-6 和TNF-α 等炎症因子水平,改善肠粘膜组织结构。孙源博等[18]研究报道,Gen 可通过抑制 TGF-β1/Smad 信号通路,降低炎症因子 IL-1β和TNF-α 释放、减轻氧化应激反应,改善肾间质纤维化。本研究结果发现,与 NC 组比较,M 组大鼠海马 IL-1β、IL-6、TNF-α 含量显著增加,IL-1β、IL-6 和TNF-α 是常见促炎因子,提示睡眠剥夺大鼠海马组织存在炎症反应。与M 组比较,Gen 可呈剂量依赖性下调海马IL-1β、IL-6和TNF-α 含量,提示 Gen 可能通过减少海马 IL-1β、IL-6 和TNF-α 等促炎症因子合成与释放,改善睡眠剥夺大鼠认知功能障碍。
TLR 可特异性识别病原相关分子模式,通过跨膜结构将病原相关分子刺激信号转入细胞中,导致NF-κB 等诱导因子活化,介导 IL-1、IL-6 及 TNF-α 等炎症介质基因表达,导致炎症介质合成及释放,诱导炎症反应及启动病原微生物的固有和获得性免疫[19-20]。王羲凤等[21]研究报道,睡眠剥夺可导致老龄大鼠血脑屏障通透性增加,激活海马TLR4/NF-κB信号通路诱发炎症反应,降低认知功能。Liu 等[22]研究报道,Gen 通过抑制 BTK/TLR4/NF-κB 通路,减少海马IL-6 及TNF-α 等炎症因子释放,改善糖尿病大鼠认知功能障碍。本研究结果发现,与正常对照组比较,模型组大鼠海马 TLR4、NF-κB p65 的 mRNA 及蛋白表达量显著增加;与模型组比较,Gen 呈剂量依赖性降低睡眠剥夺大鼠海马TLR4 及NF-κB p65 的mRNA 及蛋白表达量,可能因为睡眠剥夺后异常慢波放电导致大脑网络抑制或受损,进而激活氧化应激、炎症反应等,导致海马区突触稳态破坏等原因会引起大鼠认知障碍[23],其中TLR4/NF-κB 是炎症调控中最关键和最常见的通路,而Gen 改善睡眠剥夺大鼠认知功能可能与抑制TLR4/NF-κB p65 通路,减少其下游炎症因子分泌有关,但关于Gen 作用TLR4/NF-κB p65 通路的直接靶点有待进一步深入探究。LPS 是TLR4 信号通路的激活剂,本研究发现对Gen-H组大鼠进行尾静脉注射LPS后,结果发现睡眠剥夺大鼠逃避潜伏期显著延长、行为正确率显著降低,海马神经元损伤明显,血清S100B 和NSE 的水平、海马IL-1β、IL-6和TNF-α 的含量及 TLR4、NF-κB p65 的mRNA 及蛋白表达量显著增加,提示LPS 激活TLR4通路可逆转Gen 减轻认知功能障碍的作用,再次印证 Gen 是通过抑制 TLR4/NF-κB p65 通路,减轻海马炎症反应,从而改善睡眠剥夺大鼠认知功能障碍的。
综上所述,栀子苷可通过抑制TLR4/NF-κB p65信号通路,减轻海马炎症反应,从而改善睡眠剥夺大鼠认知功能障碍,可对临床睡眠障碍治疗提供新的思路,具有一定临床应用价值。但关于Gen 临床用药的安全剂量、作用TLR4/NF-κB p65 通路的直接靶点及是否涉及其他信号通路参与有待进一步验证。

