过表达转录因子BACH2对人急性淋巴细胞白血病T淋巴细胞活力及凋亡的影响*
王旭颖, 荆明箴, 付 荣, 余 谨, 杨 茹
(武汉血液中心,湖北武汉430030)
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是一种常见的儿童血液系统恶性肿瘤,约占儿童恶性肿瘤的 1/8 531,年发病率为 4/10 万[1]。尽管近年来ALL 患者的生存率得到了显著提高,但复发仍是导致儿童患病死亡的最常见原因之一[2-3],成人ALL 的难治与复发更是临床上难以攻克的问题[4]。化疗是治疗ALL 的主要方法之一,但化疗药物耐药的产生,成为限制ALL 患者临床疗效的主要障碍,因此,寻找治疗ALL 的相关靶点对ALL 治疗新策略的发现具有重要的研究意义[5]。
BTB 与 CNC 同源基因 2(BTB and CNC homology 2,BACH2)是一种具有碱性亮氨酸拉链结构的转录因子,主要在T 细胞、B 细胞和神经细胞等细胞中表达,参与了淋巴细胞的生成与功能调控过程,与多种免疫相关性疾病的发生与发展有关[6-7]。BACH2 作为转录抑制因子,在ALL 患者骨髓中的表达低于正常人骨髓,且BACH2 低表达与白血病细胞的恶性生物学行为及较差的临床预后相关[8]。但BACH2在急性T 淋巴细胞白血病肿瘤细胞中的研究却少有报道。本项工作探讨BACH2在ALL T 淋巴细胞CCRFCEM 与正常人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中的表达差异,并检测BACH2 过表达对CCRF-CEM 细胞活力及凋亡的影响,以期为BACH2 在急性T 淋巴细胞白血病中的研究提供参考资料。
材料和方法
1 材料
人急性淋巴细胞白血病T 淋巴细胞CCRF-CEM购于中国科学院细胞库。RPMI-1640 培养液购于HyClone;胎牛血清和Opti-MEM 培养基购于Gibco;人全血单个核细胞分离液购于天津市灏洋生物制品科技有限责任公司;Trizol 购于Ambion;反转录试剂Oligo(dT)18 Primer、PrimeScript II RTase和Recombinant RNase Inhibitor 购 于 TaKaRa;LipofectamineTM2000 购于 Invitrogen;CCK8 试剂盒、Triton X-100、封闭液和抗荧光淬灭封片液购于Solarbio;Annexin VPE/7-AAD 凋亡检测试剂盒购于BD;抗BACH2 抗体(用于免疫荧光检测)购于Abcam;细胞周期蛋白D3(cyclin D3)抗体(用于免疫荧光检测)购于武汉三鹰生物有限公司;抗cyclin D3 抗体、抗Bcl-2 抗体及抗caspase-3 抗体(用于 Western blot 检测)购于 Bioswamp。
2 方法
2.1 细胞分离和培养 取3 mL 人全血单个核细胞分离液于15 mL离心管中,加入3 mL正常人外周血,500×g离心25 min,离心管中液体分为4层:第1层为血浆层,第2 层为环状乳白色单个核细胞层,第3 层为透明分离液层,第4 层为红细胞层。小心吸取第2层于新的离心管中,加入10 mL清洗液,混匀,250×g离心10 min,弃上清,再加入5 mL清洗液重悬细胞沉淀,250×g离心 10 min,加入 5 mL 清洗液重复离心 1次。弃上清液,即可获得原代PBMC。CCRF-CEM 细胞从液氮罐中取出后,解冻复苏培养于含10%胎牛血清的RPMI-1640培养液中。
2.2 qPCR 检测细胞中 BACH2 的 mRNA 表达 采用Trizol试剂提取细胞总RNA,加入反应体系进行反转录。采用Primer Premier 5.0 软件进行引物设计,由武汉天一辉远生物科技有限公司合成引物。以逆转录获得的cDNA 为模板进行PCR 扩增,反应程序为:95℃变性5 s,56℃退火10 s,72℃延伸25 s,共39 个循环。BACH2 的上游引物序列为5'-GGTGTGTGAGAAAGAGAAAC-3',下游引物序列为5'-CAGGGCAATACCGATG-3';β-actin的上游引物序列为5'-ACACTGTGCCCATCTACG-3',下游引物序列为5'-TGTCACGCACGATTTCC-3'。 以 β -actin 为 内 参照,采用 2-ΔΔCt法计算细胞中 BACH2 mRNA 的相对表达量。
2.3 实验分组及处理 将CCRF-CEM 细胞分为:对照(control)组 、空 载 体(empty vector,EV)组 和BACH2 过 表 达(BACH2 over-expression,overExp BACH2)组。对照组细胞不作处理,正常培养;BACH2过表达组采用LipofectamineTM2000将BACH2过表达重组质粒转染细胞,根据BACH2基因序列(GI:1519315636)设计合成过表达引物,获得目的片段后,重组至p-EGFP-N1 载体中,获得重组质粒。采用LipofectamineTM2000 将重组质粒转染进入CCRFCEM 细胞中,转染前将细胞接种于24 孔板中,每孔约 5×105个细胞,采用 Opti-MEM 培养基稀释质粒DNA 和LipofectamineTM2000,然后将转染试剂与质粒DNA 稀释液混匀,室温静置20 min。将转染混合液加入细胞培养板中,轻轻摇晃混匀后继续培养;空载体组细胞转染空载体。培养24 h后,采用qPCR 检测细胞中BACH2的mRNA表达水平。
2.4 CCK8 法检测细胞活力 转染后,调整细胞密度接种于 96 孔板中,每孔180 μL,约5×103个细胞。培养 24 h,取出培养板,每孔加入20 μL CCK8 溶液,继续培养4 h。酶标仪检测各孔在450 nm 处的吸光度(A)值。
2.5 流式细胞术检测细胞凋亡 取各组细胞悬液,1 000×g离心5 min,弃上清,加入1 mL PBS 液重悬细胞沉淀。1 000×g离心5 min,弃上清,加入100 μL 结合缓冲液悬浮细胞,再分别加入5 μL Annexin V-PE和7-AAD 染液,混匀,避光孵育15 min。加入400 μL 结合缓冲液,进行流式细胞仪上机检测。
2.6 免疫荧光染色检测细胞中BACH2 和cyclin D3的表达 取各组细胞悬液,PBS清洗2次,采用4%多聚甲醛于室温下固定30 min,PBS 洗涤后加入0.5%Triton X-100室温通透20 min,PBS洗3次。室温下封闭 1 h 后,加入兔抗 BACH2和cyclin D3 抗体于湿盒内,4℃孵育过夜。PBS 洗3 次,加入II 抗,37℃孵育1 h。PBS 洗 5 次,加入 100 μL 抗荧光淬灭封片液进行染色,滴1滴于载玻片上进行封片,于显微镜下观察。
2.7 Western blot 检测细胞中 cyclin D3、Bcl-2 及 caspase-3 的蛋白表达 收集对照组、空载体组和BACH2 过表达组细胞,按照每1×106个细胞加入200 μL 裂解液的比例加入裂解液,于4℃充分裂解。将细胞收集于离心管中,95℃加热10 min,12 000×g离心10 min,取上清液进行蛋白定量。以每孔20 μg 蛋白上样量进行SDS-PAGE,将蛋白转移至PVDF 膜上,采用5%脱脂奶粉封闭液4℃封闭过夜。分别加入抗cyclin D3、Bcl-2 和caspase-3 抗体(稀释比例为1∶1 000),室温下孵育2 h,PBST清洗3次,加入II抗,室温下孵育2 h,PBST 清洗3 次。加入化学发光试剂,采用全自动发光分析仪读取条带灰度值,计算蛋白的相对表达量。
3 统计学处理
计量资料采用均数±标准差(mean±SD)表示,采用SPSS 23.0统计软件进行统计分析,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 BACH2在CCRF-CEM细胞中的表达
检测人急性淋巴细胞白血病T 淋巴细胞CCRFCEM 和正常人外周血单个核细胞中BACH2基因的mRNA 表达水平,结果显示,CCRF-CEM 细胞中BACH2 的 mRNA 水平显著低于 PBMC(P<0.05),见图1。
2 BACH2过表达载体转染效率的检测
与对照组比较,空载体组细胞中BACH2 的mRNA 表达水平无显著差异(P>0.05),而BACH2 过表达组细胞中BACH2 的mRNA 相对表达量显著升高(P<0.05),见图2,说明本次转染实验成功获得BACH2高表达的CCRF-CEM细胞。
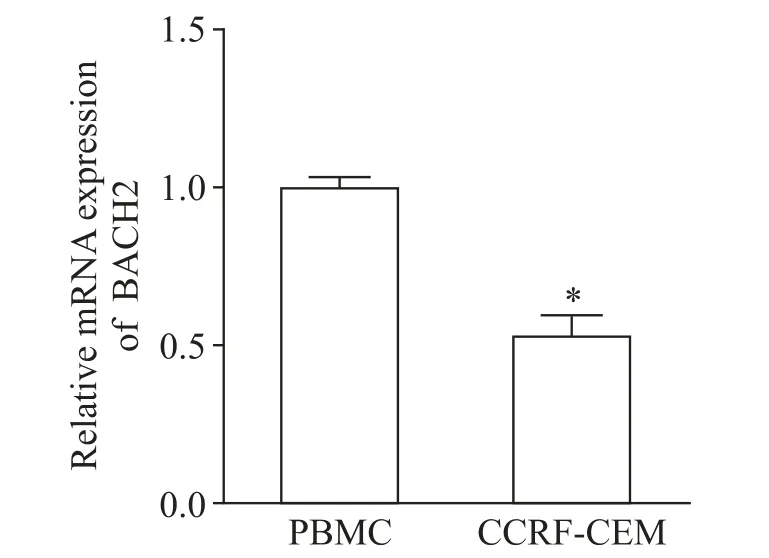
Figure 1.The mRNA expression of BACH2 in PBMC and CCRF-CEM cells was detected by qPCR.Mean±SD.n=3.*P<0.05 vs PBMC group.图 1 qPCR 检测 PBMC和CCRF-CEM 细 胞 中 BACH2 的mRNA表达水平
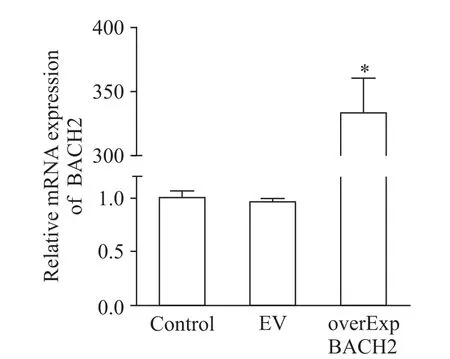
Figure 2.The mRNA expression of BACH2 in CCRF-CEM cells was detected by qPCR.Mean±SD. n=3.*P<0.05 vs control group.图2 qPCR检测CCRF-CEM 细胞中BACH2的mRNA表达水平
3 BACH2过表达对CCRF-CEM细胞活力的影响
采用CCK8 实验检测CCRF-CEM 细胞活力的变化,与对照组比较,空载体组细胞活力无显著变化(P>0.05),而 BACH2 过表达组细胞活力显著降低(P<0.05),见图3。

Figure 3.The viability of CCRF-CEM cells was detected by CCK8 assay.Mean±SD. n=3.*P<0.05 vs control group.图3 CCK8法检测CCRF-CEM细胞活力
4 BACH2过表达对CCRF-CEM细胞凋亡的影响
检测各组CCRF-CEM 细胞的凋亡水平,与对照组比较,空载体组细胞凋亡率无显著变化(P>0.05),BACH2 过表达组细胞凋亡率显著升高(P<0.05),见图4。
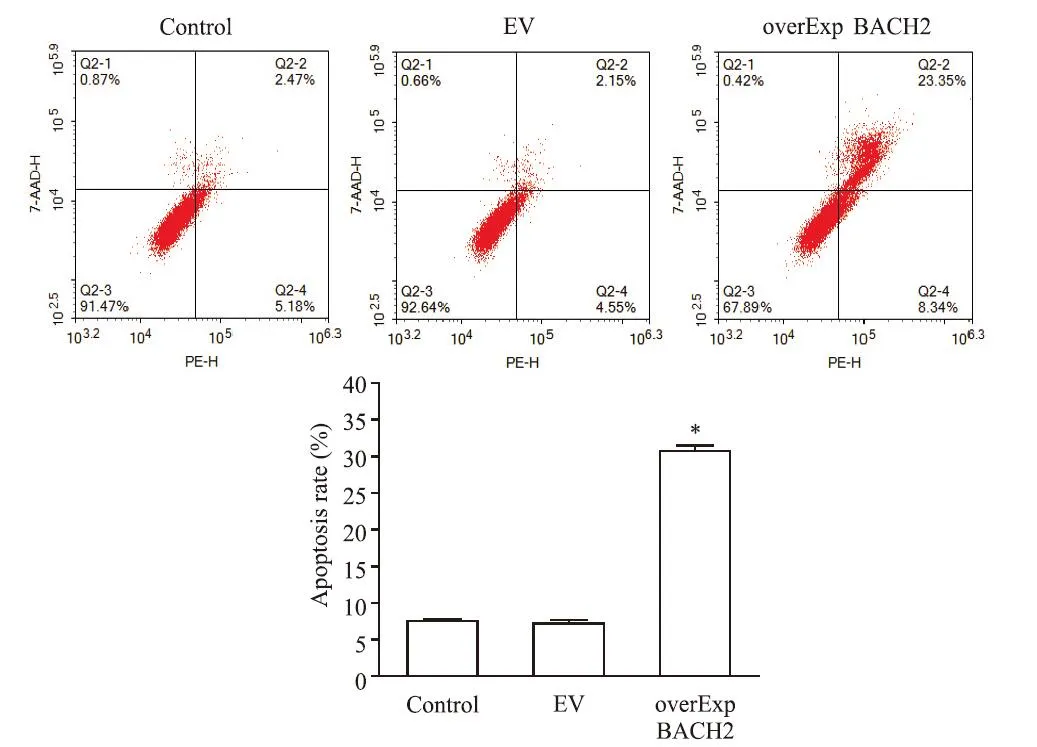
Figure 4.Apoptosis rate of CCRF-CEM cells was detected by flow cytometry.Mean±SD. n=3.*P<0.05 vs control group.图4 流式细胞术检测CCRF-CEM细胞的凋亡率
5 CCRF-CEM 细胞中 BACH2和cyclin D3 表达的变化
免疫荧光染色检测各组CCRF-CEM 细胞中BACH2 和cyclin D3 的表达水平,结果显示,与对照组相比,BACH2 过表达组细胞中BACH2 表达增多,见图5A,而cyclinD3表达减少,见图5B。

Figure 5.The expression levels of BACH2(A)and cyclin D3(B)in CCRF-CEM cells were detected by immunofluorescence.图5 免疫荧光染色检测CCRF-CEM细胞中BACH2和cyclin D3的表达
6 BACH2 过表达对 CCRF-CEM 细胞 cyclin D3、Bcl-2和caspase-3蛋白表达的影响
Western blot 检测各组CCRF-CEM 细胞中cyclin D3、Bcl-2和caspase-3蛋白表达水平,结果显示,与对照组相比,BACH2 过表达组细胞中cyclin D3 和Bcl-2 蛋白表达水平降低,而caspase-3 表达升高(P<0.05),见图6。
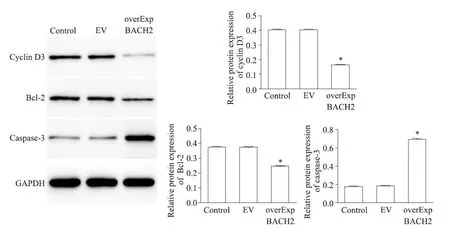
Figure 6.The protein expression levels of cyclin D3,Bcl-2 and caspase-3 in CCRF-CEM cells were detected by Western blot.Mean±SD. n=3.*P<0.05 vs control group.图6 Western blot检测CCRF-CEM细胞中cyclin D3、Bcl-2和caspase-3蛋白表达水平
讨 论
ALL 主要表现为T、B 淋巴细胞异常增殖,大量未成熟的白细胞聚集浸润骨髓及其他组织和器官,引起骨髓的造血功能发生异常和免疫功能紊乱等[9]。成人ALL 主要以儿科治疗为基础强化化疗,但随着年龄的增长,对高强度化疗的耐受性降低,不良预后因素的发生率增加[10],复发/难治性 ALL 急需新的治疗方法[11]。由于ALL 具有高度异质性,新分子治疗靶点的开发对ALL 患者的临床治疗及预后的改善具有重大意义[12]。
BACH2 是BTB 碱性区亮氨酸拉链因子家族的成员之一,Sasaki 等[13]研究表明 BACH2 对 B 淋巴细胞的发育具有调控作用,BACH2基因的缺失是人类B 细胞淋巴瘤常见的染色体改变之一。BACH2 可通过多步骤调节免疫相关疾病,参与B淋巴细胞和T淋巴细胞的发育,调控淋巴细胞的周期[14]。同时,BACH2被认为是T 淋巴细胞维持免疫稳定状态的调节因子[15]。本研究显示,ALL T 淋巴细胞中 BACH2的表达显著低于正常人外周血单个核细胞,该结果与 Ge 等[8]研究结果相似,为了进一步探讨 BACH2 在ALL T 淋巴细胞中的具体作用机制,我们通过上调BACH2 在CCRF-CEM 细胞中的表达,观察过表达BACH2对CCRF-CEM细胞活力和凋亡的影响。
细胞周期的失调在肿瘤的发展过程中发挥关键性作用,cyclin D3 是细胞周期转换的重要正调控因子,染色质免疫沉淀实验发现BACH2可直接调控cyclin D3,进而调控淋巴细胞周期转换[14]。破坏细胞活力和凋亡之间的生理平衡是肿瘤发展的重要步骤之一,细胞凋亡抵抗是血液系统恶性肿瘤的关键机制[16]。Bcl-2 家族在细胞内源性凋亡通路中发挥重要作用,Bcl-2 家族蛋白可调控线粒体膜电位及通透性,当线粒体内细胞色素C 释放至细胞质时,可激活caspase 凋亡级联反应,而caspase-3 则为凋亡执行因子[17-18]。本研究结果显示,BACH2 过表达抑制了CCRF-CEM 细胞的活力,促进其发生凋亡,且细胞中cyclin D3和Bcl-2 蛋白表达下调,而 caspase-3 表达上调,提示BACH2 通过参与细胞内源性凋亡途径诱导CCRF-CEM 细胞凋亡。研究显示[19],Bcl-2 在淋巴细胞白血病中表达上调,针对Bcl-2 拮抗剂的研发成为治疗白血病的方向之一,而本文中过表达BACH2 可下调Bcl-2 表达,因此,BACH2 可能具有治疗白血病的潜在价值。
综上所述,急性T 淋巴细胞白血病细胞中BACH2表达水平降低,上调BACH2表达可抑制白血病细胞的活力,并诱导其凋亡。

