三种无缝克隆试剂盒连接效率的比较
邢体坤 王 斌 郭冰峰 宋路萍 杨振苹 荆新蕊 郝一楠 张静静▲
1.华兰生物工程股份有限公司研发中心,河南新乡 453003;2.华兰基因工程有限公司质量控制部,河南新乡 453000;3.华兰生物工程股份有限公司血制研发部,河南新乡 453003
DNA克隆技术在生物医学领域研究中应用广泛[1]。传统酶切连方法耗时长、耗费高、效率低,不能满足目前分子生物学发展需求[2-3]。为提高克隆技术连接效率,近年来开发出多种新方法[4-6]。其中,无缝克隆是新技术中的典型代表[7],位点选择灵活、连接产物无冗余序列、连接效率高且简单快捷,受到广大研究者的青睐[8-17]。本研究对比三个厂家试剂盒价格、总克隆数和阳性克隆率,表明生工生物工程(上海)股份有限公司的无缝克隆试剂盒为最佳选择。
1 材料与方法
1.1 供试品
pUC57-HNB2M11由金斯瑞生物科技有限公司合成,DH5a感受态购自生工生物工程(上海)股份有限公司,pET-26b载体由华兰生物工程股份有限公司保存。
1.2 材料
蛋白胨购自OXOID,酵母粉购自BD,DH5a感受态、琼脂粉购自生工生物工程(上海)股份有限公司,Nco I、Xho I购自 Takara,Gene JET Plasmid Miniprep Kit购自 Thermo,EasyPfu DNA Polymerase购自 TransGen Biotech,Ready-to-Use Seamless Cloning Kit购自生工生物工程(上海)股份有限公司,Kit A购自厂家A,KitB购自厂家B。
1.3 仪器设备
摇床(HYG-A)购自太仓实验设备厂,台式离心机(1-15PK)购自德国赛多利斯,水浴锅(HWS-28)购自上海一恒科学仪器有限公司,洁净工作台(SW-CJ-2FD)购自苏州安泰空气技术有限公司,PCR(S100)反应扩增仪购自BIO-RAD,紫外仪(WD-9403C)、电泳仪(DYY-10C)、电泳槽(DYCP-31DN)购自北京六一生物科技有限公司,凝胶成像系统(AlphaImager HP)购自 ProteinSimple,微量分光光度计(NanoDrop ONE)美国 Thermo Fisher,涡旋混匀器(HYQ-2121A)购自美国精骐有限公司,恒温培养箱(BPX-272)购自上海博讯实业有限公司。
1.4 片段线性化
本研究目的基因HNB2M11插入原核表达载体pET26b的PelB信号肽开放阅读框(ORF),采用酶切或PCR扩增连接片段线性化。
1.4.1 载体线性化 原核表达载体pET26b采用Nco I和Xho I双酶切,胶回收纯化获得线性化载体。
1.4.2 目的基因线性化 无缝连接试剂盒要求目的基因HNB2M11两端与pET26b载体末端形成15-25 bp同源序列。扩增引物设计要求引入15-25bp的载体末端序列形成重组位点,即5’-15-25bp同源序列-所需酶切位点序列-特异性引物序列-3’。具体序列如下:引物F:ccagccggcgatggccatgg-HNB2M11 5’端 20bp 序 列;引 物 R: tggtggtggtggtgctcgag-HNB2M11-XhoI- 3’端14bp序列(反向)。
1.5 目的片段与载体的重组
将目的DNA片段和线性化载体以一定的摩尔比加到PCR管中进行重组反应。组分加入量2×Seamless cloning Master Mix 10μL,线性化载体50~ 100ng,插入片段 10~ 30ng,ddH2O 补足至20μL,50℃反应15~20min。反应结束立即将离心管置于冰上冷却2min,待转化。
1.6 转化
加5μL的反应体系到DH5α感受态细胞中,轻弹数下,置冰上孵育30min。42℃水浴中热激90s后快速放入冰上5min。加入500μL LB液体培养基,37℃孵育45~60min。4000rpm离心3min收集菌体去上清,均匀的涂布在含卡那霉素抗性固体培养板过夜37℃培养。
1.7 菌液PCR
挑取单个菌落至装有20μL去离子水的离心管,100℃热击2min。取1μL上清为模板,T7和T7TER作为引物,20μL PCR体系进行扩增反应,凝胶核酸电泳观察实验结果。
2 结果
2.1 载体线性化
pET26b表达载体按照50μL体系酶切反应(Xho I 2.5μL,Xho I 2.5μL,10×K Buffer 5μL,DNA ≤ 2μg,灭菌水加至 50μL)Nco I和 Xho I双酶切 4 管,37℃孵育3h。制备1%琼脂糖浓度的凝胶,待凝胶成形后上样。调节8v/cm(电压:150v,电流:300mA)电泳15~20min(图1)。胶回收线性化pET26b载体,紫外吸收法检测浓度核酸浓度为26.1ng/μL。

图1 pET26b酶切线性化核酸电泳图注 :M:MarkerDL10000;1 ~ 4: pET26b Nco I和Xho I双酶切线性化四个重复上样孔
2.2 目标片段扩增
金斯瑞合成pUC57-HNB2M11作为模板,引物F和R作为引物,按照50μL PCR反应体系[EasyPfu Buffer(10×) 5μL,dNTPs(2.5mM)2μL,引 物F(10μM)1μL,引 物 R(10μM)1μL,EasyPfu DNA Polymerase(2.5U/μL)1μL,模板 DNA(20~50ng/μL)2μL,加水至50μL]扩增。PCR反应条件为:95℃ 5min激活 Taq聚合酶; 95℃变性 30s,60℃退火 30s,72℃延伸 1min,共 30 个循环。经过电泳检测结果显示扩增出条带单一,片段大小符合预期(图2)。PCR产物浓度519.1ng/μL。
2.3 重组反应
参考生工生物工程(上海)股份有限公司的Ready-to-Use Seamless Cloning Kit,Kit A 和 Kit B说明书,按照表1体系和反应条件进行重组,重组完成后冰冻2min,待转化。
2.4 菌液PCR鉴定
生工、厂家A和厂家B三种无缝克隆试剂盒连接体系转化DH5α后,分别长出107、86和16个克隆。挑22、22和16个克隆菌液PCR鉴定。生工挑取22个单克隆菌液PCR鉴定,其中20个为阳性克隆,见图3。
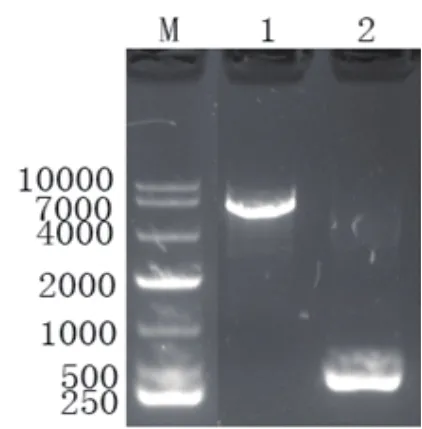
图2 pET26b和HNB2M11线性化产物鉴定核酸电泳图注:1.pET26b Nco I+Xho I纯化后图谱;2.HNB2M11 PCR 产物图谱

表1 生工、厂家A和厂家B无缝克隆试剂盒评价实验重组体系与条件

图3 生工无缝克隆试剂盒评价实验菌液PCR鉴定核酸电泳图注:其中1 ~ 22为生工Seamless cloning Master Mix试剂盒的22个单克隆菌液PCR鉴定的结果,最后一个为阴性
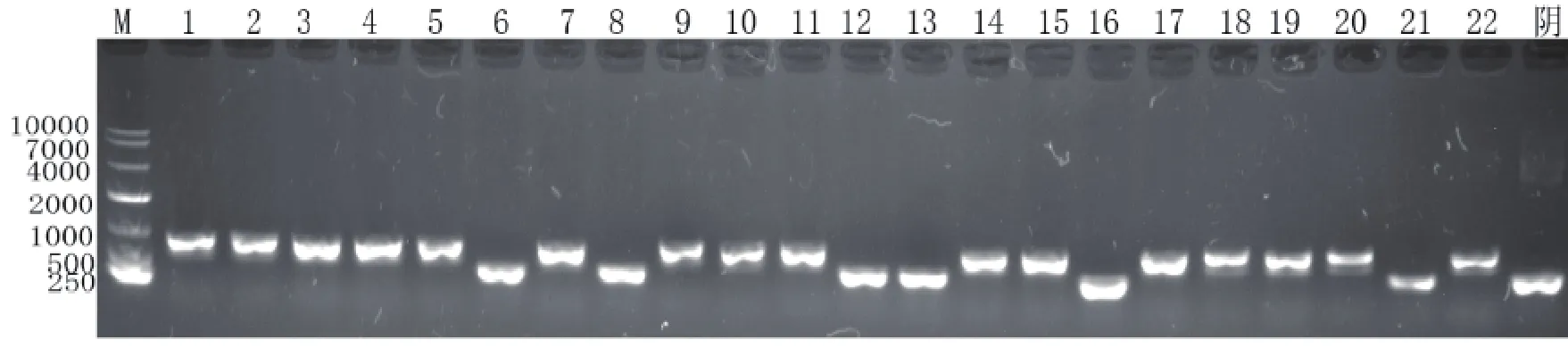
图4 厂家A无缝克隆试剂盒评价实验菌液PCR鉴定核酸电泳图注:其中1 ~ 22为Kit A的22个单克隆菌液PCR的结果,最后一个为阴性
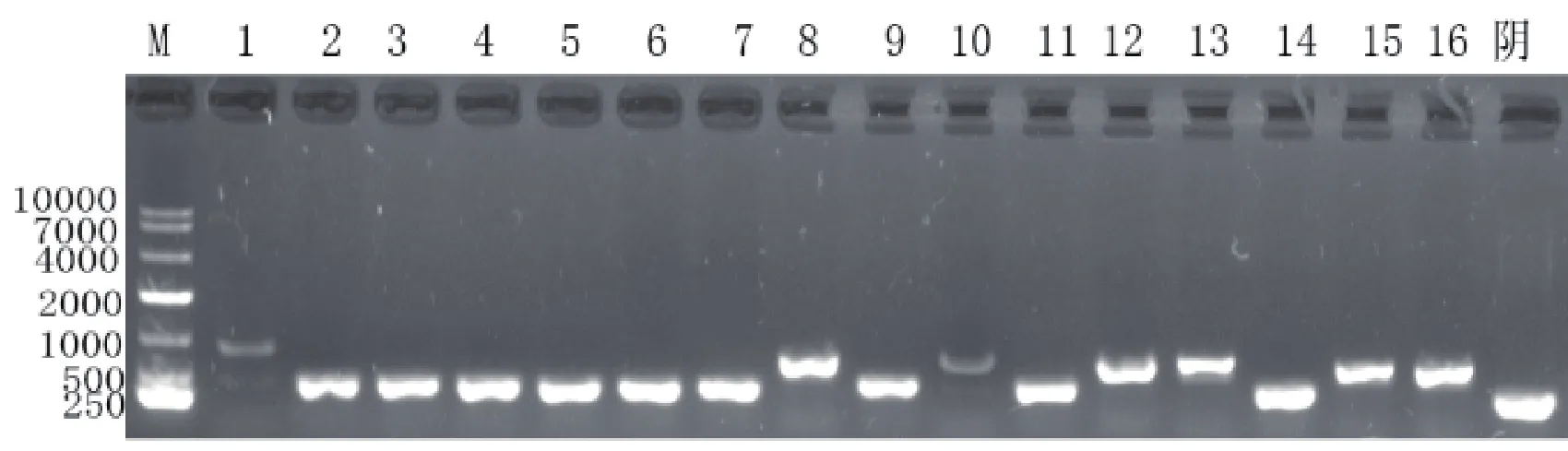
图5 厂家B无缝克隆试剂盒评价实验菌液PCR鉴定核酸电泳图注:其中1 ~ 16为Kit B的16个单克隆菌液PCR鉴定的结果,最后一个为阴性
厂家A挑取22个单克隆菌液PCR鉴定,其中16个为阳性克隆,见图4。
厂家B挑取16个单克隆菌液PCR鉴定,其中7个为阳性克隆,见图5。
从转化总克隆数量,商品价格及阳性克隆百分比三方面考虑,生工的 Seamless cloning Master Mix无缝克隆试剂盒为文库构建最佳选择,见表2。
3 讨论
无缝克隆是一种新型、快速、简洁的克隆方法,可同时将1~4个DNA片段克隆到任何载体中,阳性率达到95%以上。实验时只需插入的DNA片段末端引入载体末端15~25个同源碱基序列,反应时间短至20min,即可在载体的任意位点完成克隆重组。本研究利用该技术完成多种表达质粒和噬菌体筛选文库构建,证实其技术优点:(1)依赖末端同源片段重组连接,位点选择灵活,无需考虑酶切位点等限制因素;(2)阳性率高,本研究在His6标签碱基重复区域重组,阳性率仍在90%以上;(3)大大简化了DNA克隆的实验步骤,显著提高了基因克隆的成功率。影响无缝试剂盒连接效率因素繁多:同源序列GC含量,重复序列,目标片段大小、纯度、定量方法、感受态转化效率等。目前,不同厂家无缝克隆的试剂盒质量参差不齐,选择合适产品成为一种挑战。本研究选择三个厂家的无缝克隆试剂盒对比其单克隆的数量和连接效率,评价方法简单高效。此外,本次评价在未经纯化的PCR产物,含His6标签同源序列(GC含量大于60%且重复)等不利条件下进行,评价结果相对客观可信。最后,结合商品性价比综合考虑,生工无缝克隆的试剂盒为文库构建等阳性率要求严格实验的最佳选择。

表2 生工、厂家A和厂家B无缝克隆试剂盒评价汇总

