Guselkumab治疗银屑病关节炎疗效及安全性meta分析
卢昌佩 景海霞 王润超 王 恒 罗 亭 步青云
锦州医科大学十堰市太和医院研究生培养基地(湖北医药学院附属医院),湖北十堰,442000
银屑病是一种较为常见的慢性炎症性皮肤病,全球患病率约在2%~3%[1],其中有1/3的银屑病患者有银屑病关节炎(psoriatic arthritis, PsA)[2],常伴有关节肿痛、僵硬及运动障碍,部分可累及脊柱,严重者可造成残疾,对于患者身心健康产生了严重的影响[3]。其发病机制尚不清楚,但是相关研究表明T细胞亚群和其效应细胞因子介导的慢性炎症对于两者的发病具有重要意义[4],尤其是最近几年发现IL-23/Th-17免疫调节通路[5],银屑病与PsA有着相同的病理生理及临床特征引起了相关生物制剂的研究[6]。目前关于PsA的治疗方案主要为非甾体抗炎药、糖皮质激素、抗风湿药物、硫唑嘌呤、维A酸类等,由于疗效欠佳及不良反应,临床上逐渐倾向于生物制剂的研究,肿瘤坏死因子抑制剂经常被选为PsA患者的首选生物疗法,但在临床试验中,评估的相当大一部分患者并没有达到美国风湿病学会(ACR)定义的有意义的反应,同时其复杂的安全性,特别是在感染风险方面,进一步限制了临床应用[7],抗IL-17类生物制剂除了感染风险外,还有可能造成炎症性肠病的新发或加重[8],其他生物制剂如ustekinumab, 托法替尼等也因安全性使得PsA在药物选择上受限[9]。IL-23/Th17细胞通路在PsA的皮肤和关节表现的发生及发展中起关键作用[10,11],Guselkumab于2017年7月在美国获批用于治疗中重度斑块状银屑病[12],为一种人源单克隆IgG1抗体,选择性与IL-23p19结合,抑制IL-23与其表面受体的相互作用,从而阻止IL-23受体介导的信号传导途径[13]。近期已有多项临床试验证明Guselkumab对PsA有着良好的疗效与安全性,本文对Guselkumab治疗PsA的疗效及安全性进行meta分析,进一步为Guselkumab治疗PsA提供依据。
1 资料与方法
1.1 纳入标准与排除标准
1.1.1 纳入标准 ①研究对象:临床诊断为PsA≥6个月,年龄≥18岁;② 66个压痛关节中有3个及以上,68个肿胀关节中有3个及以上,C反应蛋白浓度至少为0.3 mg/dL;③至少有3%的体表面积受到斑块状银屑病的影响;④对标准治疗有不良反应或不耐受(≥3个月的抗风湿药物或≥4周的口服糖皮质激素或非甾体抗炎药);⑤研究类型:随机对照试验(RCT);⑥干预措施:试验组采用Guselkumab治疗,对照组采用安慰剂治疗;⑦测量指标:银屑病关节炎的体征和症状改善至少20%患者的例数(ACR 20)、50%的例数(ACR 50)、70%的例数(ACR 70),PASI下降达75%(PASI 75)、90%(PASI 90)的例数,HAQ-D1较基线提高0.35的患者例数,(HAQ-D1即健康状况评定量表,主要用于评估类风湿关节炎患者的功能状态,每个问题得分0~3分,得分越高,功能或情绪越差),试验组和对照组患者发生不良反应(AEs)和严重不良反应(SAEs)及其他具体不良反应的例数。
1.1.2 排除标准 ①非RCT;②动物实验;③研究对象为非PsA患者;④全文中未提供相关结局指标;⑤同一研究,重复发表;⑥质量太差,合并其他疾病的患者。
1.2 检索策略 检索Pubmed、Embase、Cochrane Library、万方数据库、中国知网及维普数据库,检索时间均为建库起至2020年4月。检索采用主题词与自由词结合的方式。中文关键词为:“银屑病关节炎和Guselkumab”,英文关键词为“Psoriatic Arthritis和Guselkumab”,纳入已经公开发表的文献。
1.3 资料提取 确定纳入文献后,使用统一设计的数据收集表,由两位研究者分别对每个随机对照研究的题目和摘要进行审查和评价,阅读全文提取数据资料,内容包括:样本的入选标准和样本量,受试者的基本信息,治疗方案,疗效指标等。如资料提取中存在争议,通过与第三方讨论解决分歧。
1.4 文献质量的评价 采用Cochrane系统评价员手册所表述的质量评价标准,对纳入的文献进行质量评价。评分标准基于以下6点,主要评价项目包括:(1)研究的随机方法是否恰当;(2)是否做到分配隐藏;(3)是否正确采用双盲法;(4)数据是否完整,有无失访或者退出;(5)是否存在选择偏倚;(6)是否存在其他偏倚。根据文献内容是否以及未提及来进行文献等级划分,分A、B、C三等。若满足全部6个条件,则为A等,满足3个及以上条件为B等,3个以下则为C等。
1.5 统计学方法 采用Review Manager 5.3软件进行meta分析。算出比值比(risk ratio,RR)及其95%可信区间( confudence interval,CI)。对纳入研究间数据行异质性检验,判断异质性大小,如P>0.05且I2<50%则表明无明显异质性,故采用固定效应模型(fixed model);反之,则有统计学异质性,采用随机效应模型(random model)进行分析。
2 结果
2.1 纳入研究筛选 初检164篇文献,采用EndNoteX7软件排除重复文章31篇,仔细查看文献标题、摘要后剔除综述类文献,与研究不符等110篇,根据纳入标准及排除标准,阅读全文后,最终纳入3篇文献含3个临床随机对照试验进行meta分析,总计纳入896例,见图1。纳入对象的用药方案、年龄、病程、疗程等基本特征见表1。
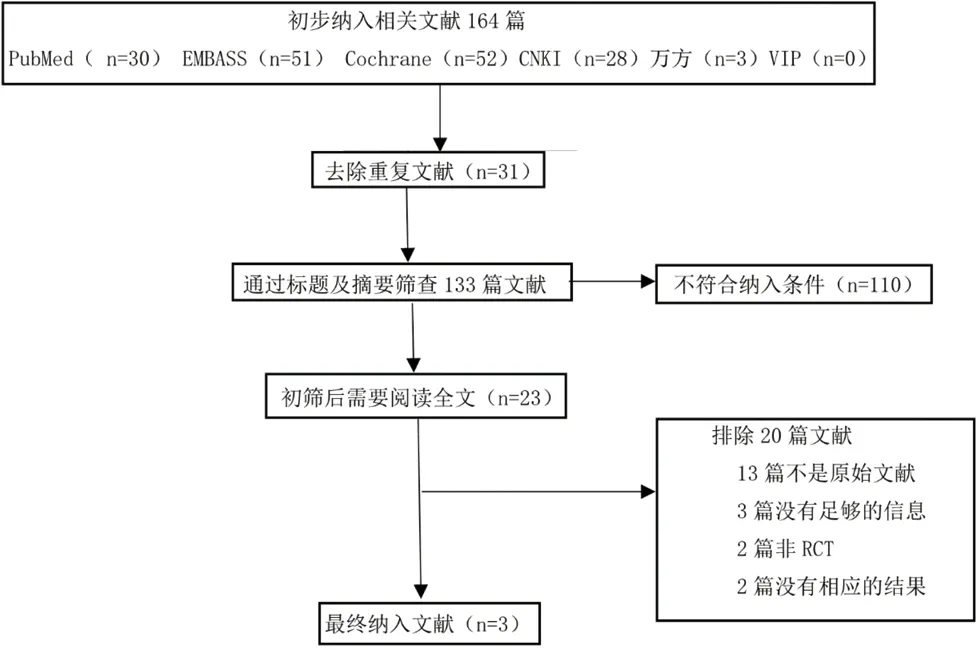
图1 文献筛选流程图
2.2 偏倚风险评估 纳入3项研究[14-16]总体质量较高,偏倚风险较低,偏倚风险评估具体见图2。

图2 偏倚风险评估图
2.3 临床疗效
2.3.1 ACR 20 3个研究报道了皮下注射Guselkumab100 mg,每8周1次,治疗24周后ACR 20改善的例数与安慰剂比较,各研究间无统计学异质性(I2=25%,P=0.52),故采用固定效应模型合并效应量。结果显示,两组差异有统计学意义(RR=2.16,95%CI1.82~2.56),见图3。
2.3.2 ACR 50 纳入文献均采用皮下注射Guselkumab 100 mg,方案同上,ACR 50改善的例数与安慰剂比较,各研究间轻度异质性(I2=0%,P=0.40),采用固定效应模型合并效应量。结果显示,100 mg组与安慰剂组比较差异有统计学意义(RR=2.61,95%CI1.94~3.49),见图4。
2.3.3 ACR 70 同样试验组皮下注射Guselkumab 100 mg,每8周1次,对照组安慰剂,时长24周,ACR 70改善的例数与安慰剂比较,各研究间无统计学异质性 (I2=16%,P=0.31),故采用固定效应模型合并效应量。结果显示:两组差异有统计学意义(RR=3.80,95%CI2.29~6.30),见图5。
2.3.4 PASI 75 3项研究均皮下注射Guselkumab 100 mg,每8周1次,治疗24周后PASI 75改善的例数与安慰剂比较,各研究间无统计学异质性(I2=47%,P=0.15),故采用固定效应模型合并效应量。结果显示两组差异有统计学意义(RR=4.18,95%CI3.28~5.32) ,见图6。
2.3.5 PASI 90 同样试验组皮下注射Guselkumab 100 mg,每8周1次,对照组安慰剂,治疗24周后PASI 90改善的例数与安慰剂比较,各研究间无统计学异质性(I2=17%,P=0.30),故采用固定效应模型合并效应量。结果显示两组差异有统计学意义(RR=6.67,95%CI4.67~9.52),见图7。
2.3.6 HAQ-D1 治疗24周后HAQ-D1改善的例数与安慰剂比较,各研究间无统计学异质性(I2=0%,P=0.86),故采用固定效应模型合并效应量。结果显示,两组差异有统计学意义(RR=1.66,95%CI1.39~1.99),见图8。
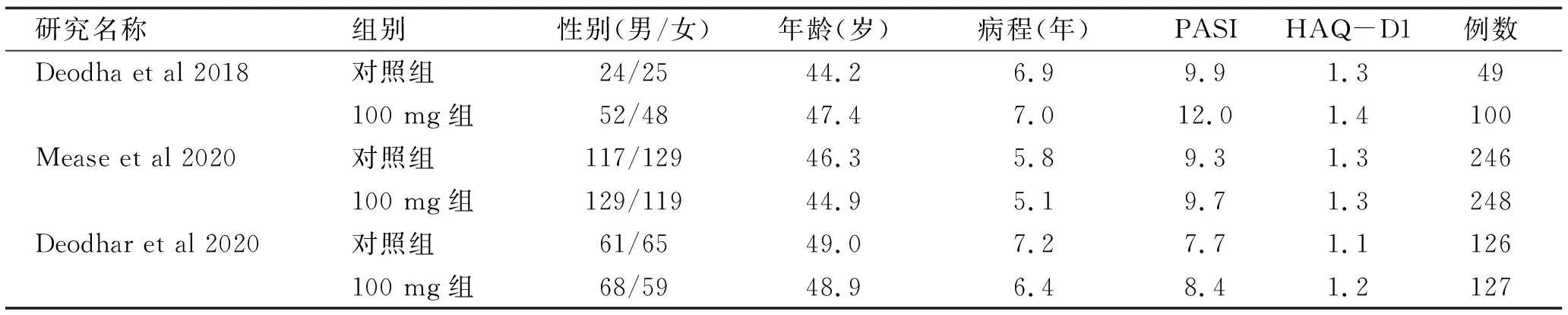
表1 纳入文献基本特征表
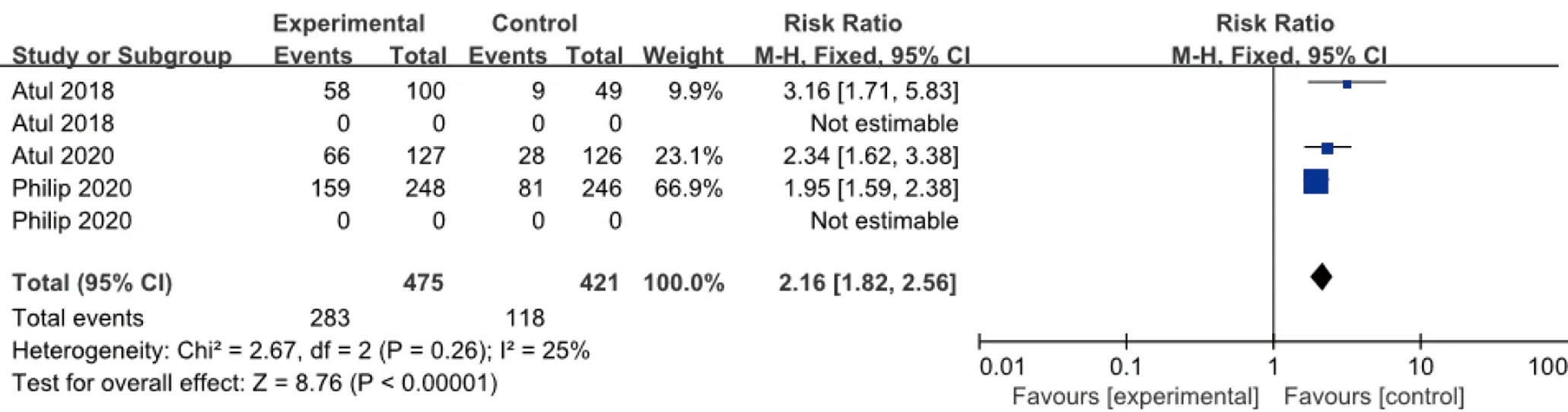
图3 100 mg组Guselkumab与安慰剂比较达到ACR 20改善例数的meta分析
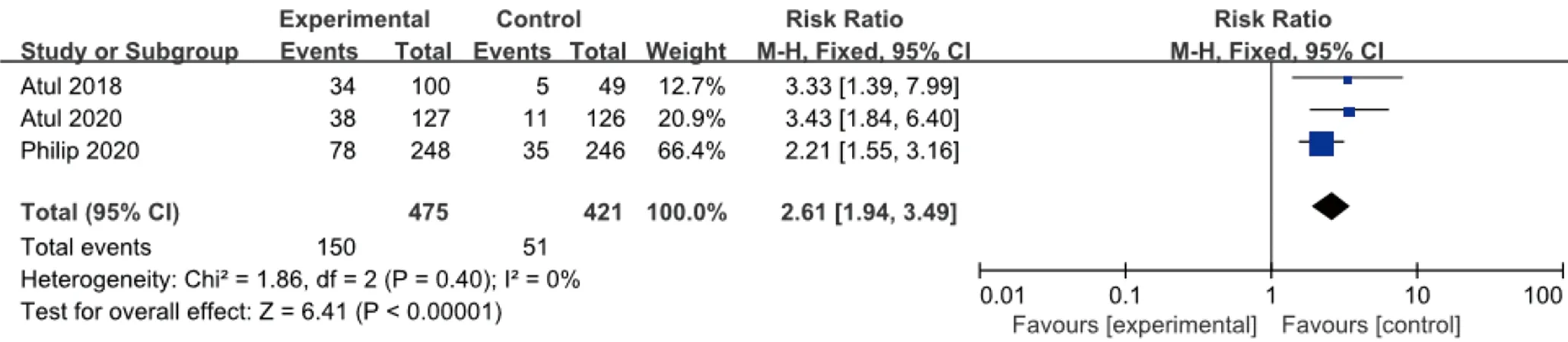
图4 100 mg组Guselkumab与安慰剂比较达到ACR 50改善例数的meta分析
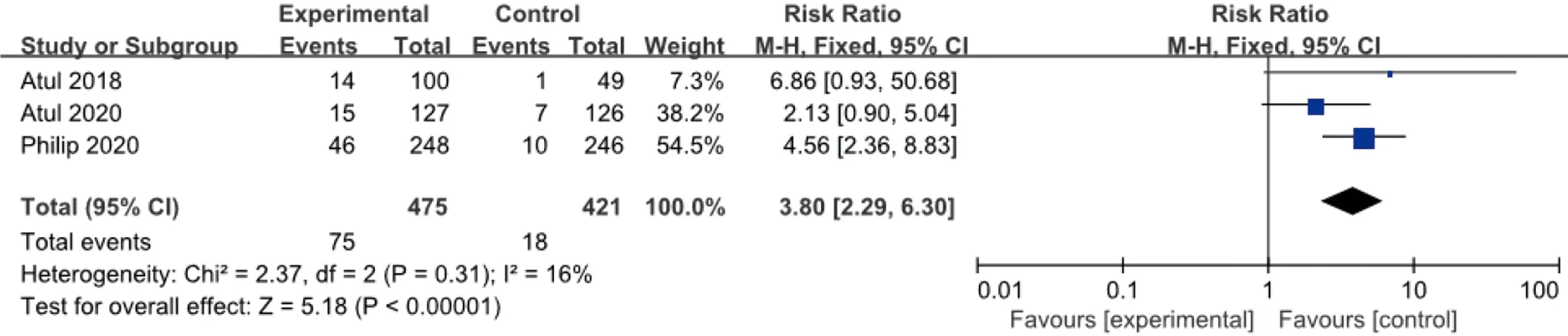
图5 100 mg组Guselkumab与安慰剂比较达到ACR 70改善例数的meta分析
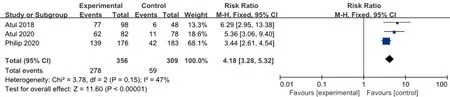
图6 100 mg组Guselkumab与安慰剂比较达到PASI 75改善例数的meta分析

图7 100 mg组Guselkumab与安慰剂比较达到PASI 90改善例数的meta分析
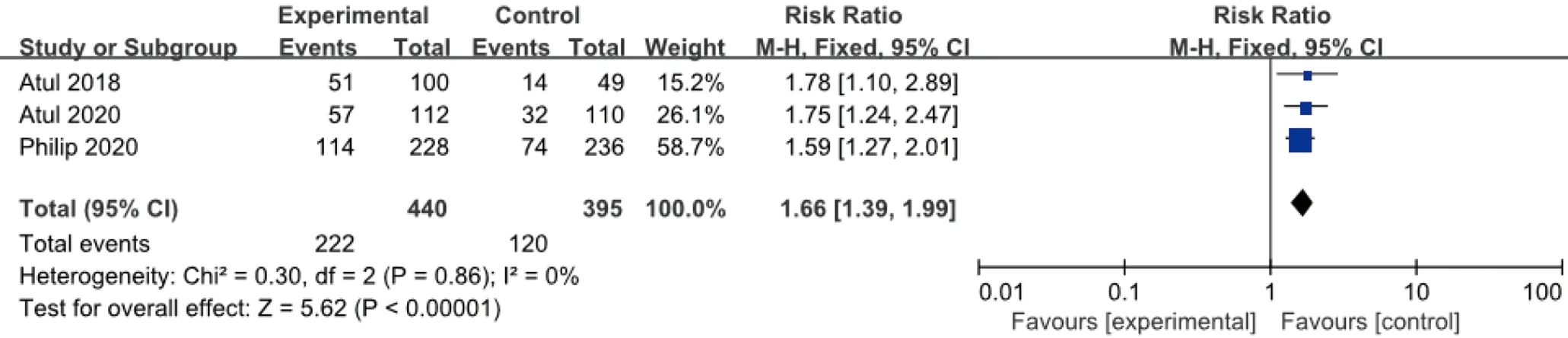
图8 100 mg组Guselkumab与安慰剂比较达到HAQ-DI改善例数的meta分析

不良反应类型纳入研究数研究例数试验组对照组I2效应模型RR(95%CI)P值总的不良反应347542118固定1.04(0.90~1.20)0.30严重不良反应34754210固定0.60(0.25~1.44)0.85感染34754210固定0.92(0.70~1.19)0.78上呼吸道感染34754210固定0.78(0.39~1.56)0.92鼻咽炎347542134固定1.25(0.75~2.10)0.22ALT34754210固定1.36(0.90~2.05)0.50AST347542161随机1.59(0.66~3.82)0.08
2.4 药物安全性评价3个RCT均报道了Guselkumab治疗组和安慰剂组在治疗期间不良反应的发生率。总的不良反应包括研究过程所有的不良反应事件,本研究将导致死亡、危及生命、需要住院治疗、导致严重残疾或出生缺陷的不良反应事件定义为严重不良反应。3项RCT最常发生的感染事件包括鼻咽炎、上呼吸道感染、肝功能异常,表2可以看出Guselkumab组鼻咽炎(RR1.25,95%CI0.75~2.10),ALT升高(RR1.36,95%CI0.90~2.05),AST升高(RR1.59,95%CI0.66~3.82),以上不良反应的发生率差异均无统计学意义。
3 讨论
在过去的十年里,银屑病的治疗发生了革命性的变化。然而,一些患者,包括PsA或对抗肿瘤坏死因子药物无效的患者,被归类为难以治疗的人群[17,18]。最近发现的IL-23/Th17细胞通路在PsA发病机制中的作用导致了新生物制剂的开发,这些生物制剂在PsA随机临床试验中显示出较好的耐受性和临床疗效。本文应用meta分析的方法系统评估Guselkumab治疗PsA的安全性和有效性。
本研究表明:Guselkumab皮下注射100 mg,间隔时间为0周、4周,以后8周/次,在第24周时显著提高达到ACR 20、ACR 50和ACR 70的例数;与安慰剂比较,在第24周时能显著提高达到PASI 75和PSAI 90的例数,与Cameron等[19]的meta分析结果一致;不良反应发生率及严重不良反应发生率与安慰剂相比无统计学差异。
本系统评价所纳入的研究存在一定的偏倚,但是研究的总体质量较高,且纳入的研究比较全面,几乎都是多中心、研究结果均显示Guselkumab可以缓解中重度斑块型银屑病及PsA患者的症状,可能是因为一般阳性结论的文章较容易发表而阴性结论的文章不容易发表,所纳入的文献只是公开发表的,大量未公开发表的文献没有检索到,可能会存在一定的发表偏倚。
综上所述, Guselkumab治疗PsA有良好的效果和较好的耐受性,不良反应与安慰剂对比并未增加,为临床治疗提供了强有力的证据支持,为PsA患者提供了新的治疗选择。由于此次meta分析纳入文献及患者样本量较少,观察时间偏短,故今后还需要更大规模、更长时间的临床试验来验证本系统评价的结果。

