豆腐果苷对间歇低氧大鼠记忆损伤的保护作用
张袁祥,周安成,张晓彤,李红金,刘言浩,董 健,童九翠
(1.皖南医学院 研究生学院,安徽 芜湖 241002;2.皖南医学院第一附属医院 弋矶山医院 临床药学部,安徽 芜湖 241001)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种呼吸系统疾病,表现为睡眠时频繁出现上呼吸道部分或完全阻塞,会严重损害身体机能[1]。OSA在各个年龄阶段均可导致严重心血管和神经认知疾病,被认为是具有重大意义和高度流行的公共健康问题[2]。OSA患者在不同程度上存在神经认知障碍,尤其在学习理解、记忆方面[3]。研究发现,长期间歇性低氧大鼠的海马组织中MDA、TNF-α、IL-1 β、IL-6含量增多,而SOD含量降低,从而会进一步加速海马区的细胞凋亡[4],导致认知障碍。活性氧清除剂以及药物降低的氧化应激和炎症水平可以减轻长期间歇性低氧动物空间记忆缺损[5]。
豆腐果苷(helicid,HEL)是我国山龙眼科植物萝卜树中的天然药物成分,目前用于减轻神经系统方面的疾病[6-7]。研究表明,豆腐果苷可以改善抑郁样大鼠的行为,减缓炎症[8-10]。但是目前关于豆腐果苷对 OSA大鼠神经认知的保护研究报道甚少。豆腐果苷作为OTC药物是否可以改善OSA引起的神经认知障碍和炎症、氧化应激反应。实验旨在探索豆腐果苷能否缓解年轻OSA模型大鼠的认知障碍以及可能潜在的机制。
1 材料与方法
1.1 动物及分组 3~4周龄、80~90 g雄性SD大鼠[南京市青龙山实验动物中心SCXK(苏)2019-0043]42只。大鼠饲养1周以适应新环境,光照时间12 h(7:30~20:30),自由摄取食水,室温(24±2)℃,每笼7只。42只大鼠随机分为6组:正常组(control)、正常+豆腐果苷8 mg/(kg·d)(TCI Japan)组[control+HEL 8 mg/(kg·d)]、正常+豆腐果苷32 mg/(kg·d)组[control+HEL 32 mg/(kg·d)]、间歇低氧(intermittent hypoxia,IH)组、间歇低氧+豆腐果苷8 mg/(kg·d)组[IH+HEL 8 mg/(kg·d)]、间歇低氧+豆腐果苷32 mg/(kg·d)组[(IH+HEL 32 mg/(kg·d)]。整个实验进行6周,HEL溶解于生理盐水中,每日7:30灌胃给药。IH组、IH+HEL 8 mg/(kg·d)组、IH+HEL 32 mg/(kg·d)组进行间歇低氧。
1.2 慢性间歇性低氧模型 实验大鼠每7只放入一个密闭箱体中(75 cm×50 cm×50 cm),向箱内输入N2,使用调控系统,使箱内氧气含量在40s内从21%降至10%,60s内从10%升到21%,整个循环时间100 s。每天8:00~16:00,计8 h。正常组、正常+HEL[8、32 mg/(kg·d)]组不做处理。
1.3 Morris水迷宫行为检测 定位航行实验中,平台处于水下2 cm,为了让大鼠无法看见平台,用黑色染料将水染黑,水温控制在(25±2)℃。实验进行时用蓝色遮光帘将周围光源遮住,保持安静。前4 d每只大鼠每天从四个象限指定位置背向池壁进池。第5天检测其逃避潜伏期。若大鼠超过60 s并未停留在平台上,其将被引导至平台上停留20 s。于第6天撤除平台进行空间搜索实验,将大鼠背向池壁沿原平台位置对角线进池。在60 s内记录大鼠的行为轨迹。
1.4 样本采集 检测行为学后,大鼠被腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,取其血液和海马组织。4℃、3000 r/min、15 min处理静脉血,获得血清,并置于-80℃保存,用于后续实验。血气分析仪测定动脉血血氧饱和度。
1.5 ELISA检测
1.5.1 SOD、MDA检测 取-80℃环境下的大鼠海马,将含有RIPA 细胞裂解液(含 PMSF)组织打碎,冰上慢摇裂解 30 min,将高速离心机设为4 ℃、1 2000 r/min、30 min,移液枪抽取上清,按照试剂盒(南京建成生物工程研究所)说明书检测SOD、MDA含量。
1.5.2 炎症因子检测 大鼠海马上清液、血清用IL-1β、TNF-α和IL-6(RayBiotech,Atlanta,USA)检测试剂盒,按说明书操作测定其含量。

2 结果
2.1 HEL对间歇低氧诱导大鼠的血氧饱和度影响 IH组的血氧饱和度与正常组相比,血氧饱和度含量降低(P<0.001),IH组与IH+HEL[8、32 mg/(kg·d)]组相比,药物组的血氧饱和度含量增加(P<0.05)。正常组与正常+HEL[8、32 mg/(kg·d)]组的血氧饱和度含量差异有统计学意义(F=22.371,P<0.001),见图1。

图1 HEL对IH诱导大鼠动脉血的血氧饱和度影响
2.2 HEL对间歇低氧诱导大鼠定位航行实验影响 第1天各组大鼠潜伏期差异无统计学意义,这说明所有组的大鼠具有相似运动和视觉能力。测试大鼠第5天期间采集数据表明,暴露于间歇低氧试验动物逃避潜伏期比正常组延长(P<0.001),IH+HEL 8 mg/(kg·d)组、IH+HEL 32 mg/(kg·d)组与IH组相比,大鼠的逃避潜伏期缩短(P<0.05)。正常组与正常+HEL[8、32 mg/(kg·d)]组的差异无统计学意义。实验表明HEL[8、32 mg/(kg·d)]均可以改善间歇低氧大鼠的空间记忆缺损(表1)。
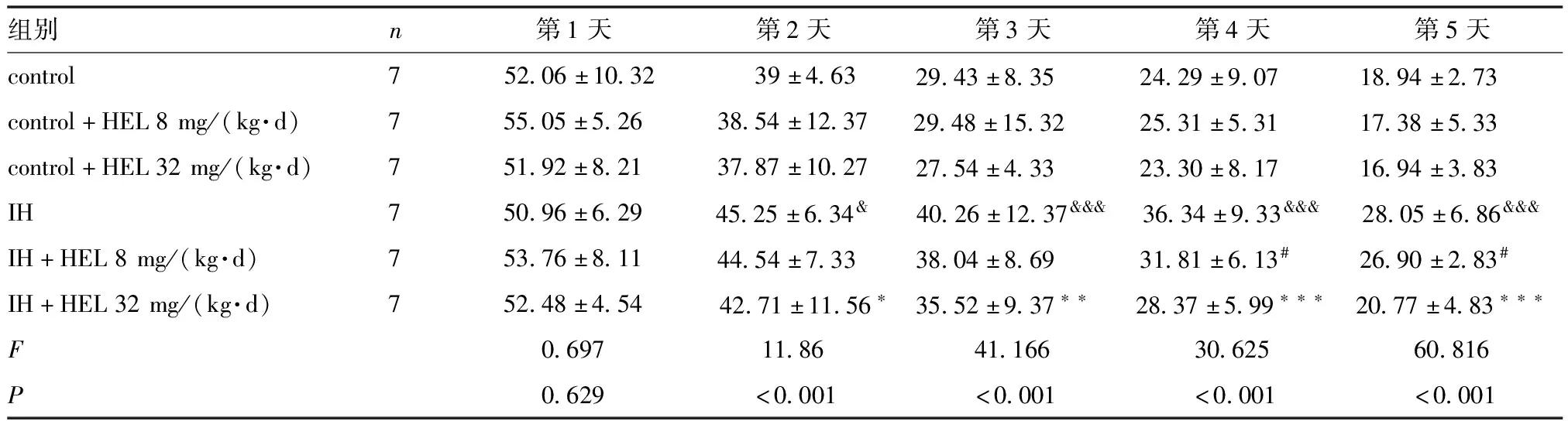
表1 各组大鼠逃避潜伏期的比较 s
2.3 HEL对IH诱导大鼠的空间探索实验影响 IH和HEL均对大鼠的空间探索有明显效果。暴露于IH大鼠到达平台时间延长(P<0.001),IH组大鼠与IH+HEL[8、32 mg/(kg·d)]组大鼠相比,药物组大鼠到达平台时间缩短(P<0.05)。正常组与正常+HEL[8、32 mg/(kg·d)]组到达平台时间相比,差异无统计学意义。暴露于IH大鼠与正常组的大鼠相比,IH大鼠探索原平台所在象限时间减少(P<0.001),而IH+HEL[8、32 mg/(kg·d)]组大鼠探索原平台所在象限时间增加(P<0.05)。IH组大鼠穿越平台位置的次数减少(P<0.001),IH+HEL[8、32 mg/(kg·d)]组能增加大鼠穿越原平台位置的次数(P<0.05)。正常组与正常+HEL[8、32 mg/(kg·d)]组相比,到达平台次数差异无统计学意义(图2)。

F=16.424,P<0.001;F=48.291,P<0.001;F=5.6,P=0.001。
2.4 HEL对IH诱导大鼠的氧化应激因子的效果 IH和HEL均对大鼠海马氧化应激因子有明显效果。IH组MDA水平增加(P<0.001),IH+HEL[8、32 mg/(kg·d)]组均可以降低MDA含量(P<0.05)。SOD含量在模型组中下降(P<0.001),使用药物低、高剂量HEL后可以增加SOD含量水平(P<0.05)。结果表明,大鼠海马中SOD含量均可以被低、高剂量HEL升高。MDA、SOD含量差异在正常组与正常+HEL[8、32 mg/(kg·d)]组均无统计学意义(图3)。

F=20.210,P<0.001;F=16.224,P<0.001。
2.5 HEL对IH诱导大鼠的炎症因子影响 IH组血清、海马中TNF-α、IL-1β、IL-6含量均增多(P<0.001),且IH+HEL 8 mg/(kg·d)组、IH+HEL 32 mg/(kg·d)组血清、海马中的炎症因子水平均比相对应的IH组低,差异有统计学意义(P<0.05)。正常组与正常+HEL[8、32 mg/(kg·d)]组海马、血清中的炎症因子水平差异无统计学意义(图4)。

F=133.840,P<0.001;F=36.367,P<0.001;F=81.254,P<0.001;F=35.907,P<0.001;F=45.917,P<0.001;F=22.457,P<0.001。
3 讨论
随着生活质量提高,患有OSA儿童受到广泛的关注,约有1%~6%的儿童患有OSA,大部分患者采用手术治疗,但手术治疗复发率达20%左右[11],因此天然植物药物如黄芪甲苷、葡萄籽原青花素、银杏、枸杞多糖[17-20]等应用于临床缓解OSA症状,在一定程度上缓解了记忆缺损。本实验主要目的是探讨豆腐果苷对暴露于间歇低氧年轻大鼠的治疗作用及对血液和海马组织中的炎症因子、氧化应激反应的影响。
采用动物缺氧/复氧模式模拟OSA,了解了该疾病的许多神经认知和生化特征,如氧化应激水平增加和炎症信号激活。这些研究成果进一步促进对该病病理过程了解,促进对该病治疗的研究[12]。本研究的结果与先前的研究一致[13],暴露于严重间歇低氧导致被试动物的空间记忆缺损,在行为上表现为逃避潜伏期延长、穿越平台次数和停留目标象限时间占比减少。暴露于间歇低氧并同时接受豆腐果苷治疗的动物比只接受间歇低氧暴露的动物表现出更少的认知和学习退化。这些效应表现为脱逃潜伏期明显缩短、穿越原平台次数和探索目标象限时间百分比增加,表明间歇低氧诱导大鼠的记忆缺损可以被豆腐果苷逆转。
由于脑中丰富的多元不饱和脂肪酸特别容易被氧化,多种疾病会引起脑内脂质过度氧化,如OSA。脂质过氧化引起细胞损伤,产生可扩散的次生生物活性醛,如MDA[14]以及使SOD含量降低[15]。在患有OSA患者以及暴露于间歇低氧下大鼠,SOD和MDA含量均显著变化[16]。本实验中间歇低氧诱导的大鼠SOD水平显著下降,MDA表达显著增多。用于药物豆腐果苷后,能明显逆转SOD和MDA的含量,表明豆腐果苷改善氧化应激反应。
OSA患者血清中促炎症因子水平(TNF-α、IL-1β、IL-6)升高,在海马组织上有不同程度的变化[17-18]。据报道,布洛芬可以抑制暴露于间歇低氧大鼠炎症因子过表达而改善大鼠的行为[19]。间歇低氧诱导的大鼠血清和海马中促炎症因子TNF-α、IL-1β、IL-6均升高,豆腐果苷低、高剂量可以逆转其促炎症因子水平。
总之,豆腐果苷可以改善暴露于间歇低氧年轻大鼠的记忆缺损,可能通过调节氧化应激反应以及降低促炎症因子水平,其具体机制将进一步探索。

