甲型流感病毒感染后粒细胞-巨噬细胞集落刺激因子对M1样气道单核细胞/巨噬细胞极化的影响
柯文玲,赵艳雪
(十堰市妇幼保健院儿科,湖北 十堰 442000)
呼吸道上皮细胞是人类流行性感冒(流感)病毒的主要靶细胞[1]。长期以来,上皮细胞一直被认为是免疫系统中的被动介质,其主要功能是作为物理化学屏障,阻止入侵的病原体进入黏膜下层或呼吸系统。目前,上皮细胞对抗病毒免疫的生理作用尚未明了[2-3]。呼吸道上皮细胞对肺内稳态、病毒免疫和流感诱导的免疫病理有积极作用。流感病毒感染过程中引起免疫病理的机制已被充分证实,先天免疫和适应性免疫都参与其中[4-5]。宿主暴露于某种病原体后的结果取决于宿主抵抗和耐受感染的能力,抗性通过抑制病原体复制和促进病原体清除来保护宿主,这一过程主要是由先天和适应性免疫系统介导[6-7]。耐受性是指在不影响病原体负担的情况下,通过限制组织损伤来改善疾病结果的能力[7]。过度活跃的免疫反应会导致严重的组织损伤,从而对疾病产生负面影响[8]。本研究探究甲型流感病毒感染后粒细胞-巨噬细胞集落刺激因子(GM-CSF)过表达对M1样气道单核细胞巨噬细胞极化的影响。
1 材料与方法
1.1 实验动物
雄性NC/Nga小鼠60只,8周龄,由湖北省医科院动物中心提供。小鼠被安置于一空调房,维持在12 h光照/黑暗循环状态,保持在(24±2)℃和(55±15)%湿度下,随意取食食物和水。
1.2 甲型流感病毒感染模型的建立和分组
甲型流感病毒感染模型的建立:实验前,所有小鼠抗流感病毒核蛋白抗体测试呈阴性。小鼠在BSL2生物安全箱中被感染,经气管注射15 mL的甲型流感病毒悬液(FLUAVsw[A/swine/Kitzen/IDT6142/2007;H1N2]107.25 50%组织培养感染剂量[TCID50]/mL),剂量1.2 mg·kg-1。
实验分组:模型建立后,采用随机数字表法将小鼠分为甲型流感病毒感染组(对照组,n=30)和GM-CSF过表达组(过表达组,n=30)。过表达组小鼠规范使用支气管镜将重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)凝胶(10 μg·cm-2)(长春金赛药业有限责任公司)涂抹在支气管,建立GM-CSF过表达模型。所有小鼠关在过滤器顶部的微隔离笼中。感染期间,每天观察小鼠2次,评估发病率和病死率。
1.3 GM-CSF的诱导过表达实验
GM-CSF基因的扩增:首先提取小鼠呼吸道组织总RNA,采用逆转录PCR方法扩增GM-CSF基因片段,逆转录为cDNA。根据GenBank中的GM-CSF基因序列设计扩增编码GM-CSF基因的引物序列。PCR反应条件:94 ℃预变性4 min,94 ℃变性30 s,52 ℃退火35 s,72 ℃延伸30 s,30个循环之后,72 ℃ 5 min终止反应。
GM-CSF原核表达质粒的构建:分别用EcoR Ⅰ切PCR产物,XholⅠ双酶切pET22b(+)质粒DNA,插入pET22b(+)质粒并转化大肠杆菌Rosetta-gami(2),获得工程菌Rosetta-gami(2)-pET22ab(+)/GM-CSF。随后采用SDS电泳收集目的片段,将GM-CSF基因经T4 DNA连接酶导入pET22b(+)质粒上,连接产物转化JM109感受态细胞。取构建成功的pET22b(+)/GM-CSF质粒导入大肠埃希菌表达菌株Rosetta-gami(2)感受态细胞。
GM-CSF的诱导过表达及纯化:将Rosetta-gami(2)-pET22b(+)/GM-CSF接种于含氨苄青霉素的LB液体培养基中,37 ℃、200 r·min-1震荡30 min,加入终浓度为0.5 mmol·L-1异丙基-β-D-硫代半乳糖苷(IPTG),30 ℃、200 r·min-1继续震荡培养6 h,离心收集菌细胞后,采用超声破碎细胞,继续离心得到细胞内物质。参照美国GE公司HisTrapTM FF亲和层析柱说明书对表达的重组融合蛋白进行纯化和鉴定。
1.4 观测指标及方法
1.4.1 各组小鼠肺功能指标的测定
分别用氯胺酮/木拉嗪(130 mg·kg-1和10 mg·kg-1,i.p)麻醉小鼠,气管插管采用19 G钝针气管造口,用缝线固定气管插管,控制小鼠持续吸入1%~5%的异氟烷保持镇静。使用Flexivent小动物肺功能仪对全部小鼠在脉冲振荡下的静息呼吸进行频谱分析,测定其呼吸力学参数。然后对小鼠进行支气管肺泡灌洗(BAL),每只小鼠取灌洗液150 g,离心10 min后移除上清液,并立即将标本在-80 ℃医用冰箱冷冻保存。所有标本严格按照试剂盒说明测定BAL蛋白表达。在450 nm处,使用SpectraMax M2 UV/Vis/荧光96-384平板阅读器测量ELISA平板的吸光度。采用ELISA或Luminex Magpix多重阵列(应用ProcartaPlex cytokine & chemokine 36plex mouse panel 1A)检测细胞因子CCL17、CXCL9和MMP12的BAL蛋白表达情况。所有小鼠处死后,取支气管上皮细胞在含10%小牛血清的DMEM培养基中培养,加入常规双抗,在37 ℃、5% CO2培养箱中培养。当其汇合生长形成单层细胞,加入0.25%胰蛋白酶进行消化,制成单细胞悬液。在4 ℃的汉克平衡盐溶液(HBSS)中,使用3%荧光标记的单克隆抗体对细胞进行表面染色,接种于24孔的培养板上。
1.4.2 免疫荧光显微镜观察巨噬细胞的单核细胞分离、分化和极化
染色后的细胞标本脱蜡后置于柠檬酸缓冲液中蒸沸3 min后冷却至室温,重蒸1次,然后冷却至室温;37 ℃下,用10%山羊血清封闭标本30 min,PBS清洗;分别用1:100稀释的PE-anti CD 197(CCR-7)、MMR和兔抗-LC3抗体4 避光染色1 h;PBS清洗;用于LC3染色的切片加入Dylight405-羊抗兔抗体,4 ℃避光染色1 h;PBS清洗;磷酸甘油缓冲液封片后于荧光显微镜下以相应波长激发光激发后观察、拍照和分析。使用Winview32和Micro-Manager(www.Micro-Manager.org)软件包控制图像采集。使用ImageJ软件对与鼠脑地图集比较识别的目标区域进行图像处理,包括对背景图像进行减法、去除随机亮点(使用despeckle滤波算法、ImageJ)以及均匀调整整个图像的亮度和对比度。强度尺度坡度按获得图像的时间进行缩放和规范化,用RLU/min表示。利用生物发光图像上的RainbowRGB查找表(LUT)生成伪彩色图像。利用ImageJ对roi进行分析,将roi归一化为目标区域到非目标区域。
1.4.3 M1样气道单核/巨噬细胞极化标记基因的表达
采用SYBR Green进行实时荧光PCR反应,分析M1样标记物的mRNA表达,并计算极化程度(引物序列见表1)。使用Trizol试剂(美国Invitrogen公司)从组织提取总RNA。使用Prime-Script RT试剂盒(美国TaKaRa 公司)进行逆转录为cDNA。取2 μL cDNA 进行荧光定量PCR,25 μL反应体系含Taq酶12.5 μL,10 μmol·L-1上、下游引物各0.5 μL,3 μmol·L-1TaqMan-MGB探针1 μL,ddH2O 8.5 μL。所有引物均由Invitrogen Corp构建。反应条件为:95 ℃预变性 60 s和10 s,60 ℃ 30 s扩增40个循环,读取荧光(60 ℃)。阴性对照组是将cDNA 模板换成等体积的ddH2O。绝对定量的标准曲线制作:将标准品分别稀释10的3、4、5、6、7个次方作为模板,反应液配置、反应条件和参数与PCR相同。使用SDS软件(Applied Biosystems,HT7900,美国)计算基因表达的相对水平。

表1 RT-PCR引物序列
1.5 统计学方法
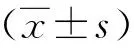
2 结果
2.1 小鼠感染流感病毒的发病率和病死率
过表达组小鼠的发病率和病死率均低于对照组(均P<0.05),见表2。
2.2 小鼠肺功能指标的测定结果
对照组的肺力学参数、压力容积曲线(pressure-volume curve,PV曲线)的曲率小于过表达组(均P<0.05),对照组呼吸系统总阻力和组织或外围气道阻力大于过表达组(P<0.05),表明GM-CSF过表达改善了甲型流感病毒感染对呼吸力学的影响。见表3。

表2 2组小鼠流感发病率和病死率比较
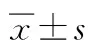
表3 2组小鼠呼吸力学参数的比较
过表达组细胞因子CCL17、CXCL9和MMP12的BAL蛋白表达水平高于对照组(P<0.05),见表4。
表4 2组小鼠BAL蛋白测定的结果

表4 2组小鼠BAL蛋白测定的结果
组别nCCL17CXCL9MMP12对照组 30224.00±20.303.21±1.0442.19±5.07过表达组30315.00±31.6012.73±3.25103.06±13.09t19.71317.23512.763P0.0060.0070.004
2.3 M1样气道单核/巨噬细胞极化相关标记基因的表达
对照组中巨噬细胞M1样mRNA水平较高,其中TNF-α、MCP-1、IL-6 mRNA表达水平高于过表达组(均P<0.05);对照组的组织中CD11b+标记气道单核细胞/巨噬细胞极化高于过表达组(P<0.05)。提示正常组织中巨噬细胞以M2型为主,减少炎症反应。见图1和表5—6。
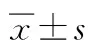
表5 组织巨噬细胞极化相关标记基因的表达
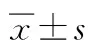
表6 巨噬细胞表面分子的百分比
3 讨论
单核细胞/巨噬细胞被认为是可塑性细胞,根据其微环境可分化为促炎(PRO-炎性,即M1)亚型,也称为经典活化亚型,或消炎或交替活化亚型(anti-activated subtype,M2),小鼠极化单核细胞/巨噬细胞的表型标记已得到广泛的研究[9-10]。
本文证明GM-CSF过表达抑制M1样气道单核细胞/巨噬细胞极化,暗示极化以M2样抗炎为主,减少炎症反应从而改善了甲型流感病毒感染对肺力学的影响。巨噬细胞在机体对微生物的先天免疫和适应性免疫中发挥重要作用,是炎症反应的主要介质[11]。它们的表型异质性现在已得到充分认识,并已被证明取决于微环境,特别是与生长因子和细胞因子有关[12]。DUNN等[13]证明在这些因素中,(GM-CSF)和巨噬细胞集落刺激因子(M-CSF)是主要的,在单核细胞/巨噬细胞与单核细胞的分化中起着重要作用。GM-CSF和M-CSF生成的单核细胞/巨噬细胞有一些共同的识别模式,但也有一些基因标记表达不同,单核细胞/巨噬细胞之间的另一种异质性与它们的激活/极化状态有关[14]。FENG等[15]进一步对mRNA表达分析鉴定了M1极化的6个标志物(IL-12p35、CXCL10、CXCL11、CCL5、CCR7、IDO1)、M2极化的5个标志物(TGF-b、CCL14、CCL22、SR-B1、PPARc)和参与单核细胞/巨噬细胞极化的转录因子,与病毒感染后期趋化因子CCL2表达的强烈抑制有关。先天免疫系统检测甲型流感至少有3种不同的机制[16-18]。首先,细胞质受体RIG-I检测5′-三孢酰化流感病毒基因组片段。在无病毒非结构蛋白1(NS1)的情况下,RIG-I诱导产生一种强抗病毒型干扰素应答。其次,toll样受体如TLR3和TLR7检测病毒相关的RNA分子。GM-CSF已被ZHU等[19]证明在几个癌症模型中促进MDSCs的招募和扩增。GM-CSF受体信号通过信号转换器和转录因子3(STAT3)的激活剂传递与肝外髓细胞PD-L1表达相关。16STAT3也被证明可以调节乳腺癌MDSCs中IDO的表达。JAROSZBIEJ等[20]发现GM-CSF驱动L-MDSC的扩增,推测GM-CSF通过STAT3信号通路诱导L-MDSC IDO和PD-L1表达,表明GM-CSF是L-MDSC IDO/PDL-1表达的关键驱动因子,也是增强肝内抗肿瘤免疫的潜在机制靶点。
由于巨噬细胞的极化特性在培养的小鼠细胞中已经基本得到了表征,且小鼠和人类之间还存在生物学差异,因此还需进一步对人类单核细胞/巨噬细胞的M1/M2表型标记进行深入研究。此外,用于从单核细胞中获得单核细胞/巨噬细胞的生长因子,即GM-CSF或M-CSF的性质,可能会影响其分化成特定亚型的能力。
综上所述,GM-CSF过表达改善了甲型流感病毒感染对肺力学的影响,抑制M1样气道单核细胞/巨噬细胞极化则暗示极化以M2样为主,减少炎症反应。

