ESVD用于门脉高压食管胃静脉曲张破裂出血治疗的临床效果研究
郑 捷 潘志刚 苏东星
肝硬化的主要病理改变是肝脏组织的进行性肝纤维化,中国的乙型肝炎病毒(HBV)感染率较高,导致肝硬化发病率居高不下。食管胃静脉曲张是肝硬化患者较为常见的并发症,在肝硬化患者中的发生率达19.8%,由于肝脏门静脉系统的长期充血导致门静脉高压,严重影响患者的生命安全[1]。目前食管胃静脉曲张的治疗主要以控制急性出血、预防出血和再出血作为主要目标。传统的序贯治疗虽然效果可靠,但易导致胃、食管溃疡,而且远期再出血率较高。随着近年来医疗器械的飞速发展,内镜下食管胃静脉曲张精准断流术(ESVD)的应用越来越多,该术式在内镜下观察并寻找食管胃静脉曲张来源,通过注射硬化剂等物质起到局部栓塞作用,疗效较好[2]。本研究观察了ESVD治疗食管胃静脉曲张患者的临床效果,以期为临床治疗提供参考,现报道如下。
1 资料与方法
1.1 临床资料
选取2015年1月至2018年8月南宁市第二人民医院收治的108例食管胃静脉曲张患者,采用随机数表法分为观察组和对照组各54例。观察组男性32例,女性22例,年龄47~72岁,平均年龄(59.6±8.2)岁;肝功能Child-Pugh分级A级15例,B级34例,C级5例;食管胃静脉曲张SARIN分型GOV1型23例,GOV2型26例,GOV3型5例。对照组男性34例,女性20例,年龄45~75岁,平均年龄(60.5±8.2)岁;肝功能Child-Pugh分级A级12例,B级37例,C级5例;食管胃静脉曲张SARIN分型GOV1型25例,GOV2型24例,GOV3型5例。两组的年龄、性别等基础资料相比较,差异均无统计学意义(P>0.05)。
纳入标准:(1)食管胃静脉曲张的诊断标准参考《肝硬化门静脉高压食管胃静脉曲张出血防治指南(2015)》[3]中的标准;(2)年龄≤75岁;(3)经内镜检查证实为食管胃静脉曲张破裂出血;(4)对本研究知情同意。排除标准:(1)恶性肿瘤;(2)急性心肌梗死;(3)心、脑血管疾病;(4)凝血功能异常;(5)免疫系统疾病。本研究经医院医学伦理委员会批准。
1.2 手术方法
对照组采用传统的序贯注射治疗。在内镜下寻找食管胃曲张静脉出血点,邻近出血静脉注射,对于无出血点者可在齿状线上方2 cm向曲张静脉注射。用聚桂醇硬化剂注射,一点注射量8 mL,总量≤40 mL。对于胃底曲张静脉,则依次将聚桂醇、组织胶、聚桂醇注入静脉,其中聚桂醇为2~3 mL,根据胃底静脉曲张程度选用0.5~4 mL组织胶注入静脉。在首次硬化剂注射治疗后间隔1周再次治疗,连续治疗2~4次,以静脉曲张消失为标准。
观察组采用ESVD治疗。在内镜下观察曲张静脉的范围,对胃曲张静脉进行阻断。找到胃曲张静脉来源,由远至近多点静脉依次注射聚桂醇2.5 mL、组织胶0.5 mL、空气2.5 mL、0.9% NaCl溶液2.5 mL,按照静脉曲张程度决定用量,必要时可在首次治疗4周后进行二次治疗。
1.3 观察指标
比较两组的治疗次数、硬化剂和组织胶使用量、成功止血率(治疗后立即止血,72 h内未再次出血)、术后3个月内再出血率、术后6个月静脉曲张消失率,根据患者再次出现黑便、粪便隐血阳性或胃镜复查发现出血等方法诊断并发症发生情况。
1.4 统计学方法

2 结果
2.1 两组的治疗情况比较
观察组的治疗次数少于对照组,差异有统计学意义(P<0.05)。两组的硬化剂和组织胶使用量差异均无统计学意义(P均>0.05)。见表1。

表1 两组的治疗情况比较()
2.2 两组的止血情况比较
观察组的术后6个月静脉曲张消失率高于对照组,差异有统计学意义(P<0.05)。两组的成功止血率、术后3个月内再出血率的差异均无统计学意义(P均>0.05)。见表2。

表2 两组的止血情况比较/例(%)
2.3 两组的并发症发生情况比较
两组的并发症发生率差异无统计学意义(P>0.05)。见表3。

表3 两组的并发症发生情况比较/例(%)
2.4 两组的典型病例
图1为采用传统的内镜下序贯注射治疗的患者,治疗后6个月复查内镜见静脉曲张显著缓解。图2为采用ESVD治疗的患者,治疗后3个月复查内镜见静脉曲张显著缓解。
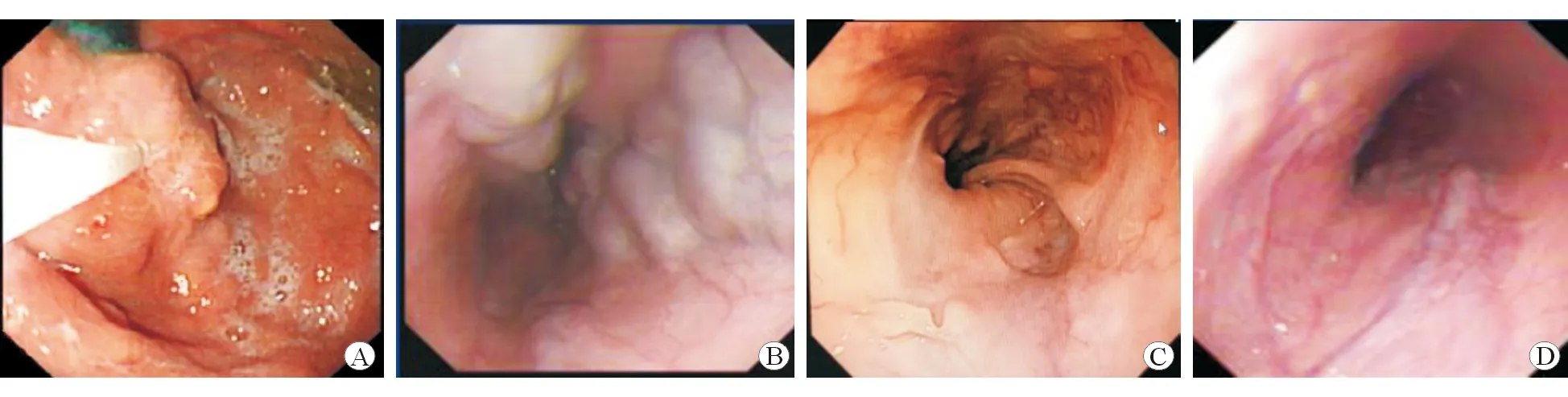
图1 采用传统的内镜下序贯注射治疗的患者 A 治疗中 B 治疗后1个月 C 治疗后3个月 D 治疗后6个月

图2 采用ESVD治疗的患者 A 治疗中 B 治疗中 C 治疗后1个月 D 治疗后3个月
3 讨论
食管胃静脉曲张为临床上常见的疾病,主要是由于各种病因造成门静脉压力升高导致,门静脉血流阻力升高导致门体侧支循环形成,曲张的侧支循环极易破裂出血,属于消化系统危急重症,严重影响患者的生命安全[4-5]。中国的肝硬化发生率较高,随着病情进展会导致食管胃静脉曲张发生,肝炎病毒在肝脏内大量复制导致炎性因子释放增多,肝细胞出现纤维样变,肝脏被分割为不规则结节,肝硬化失代偿期患者的门静脉充血量显著增加,门静脉高压形成过程中会出现血液逆流,因此机体建立侧支循环来缓解门静脉高压,食管胃静脉出现迂曲,曲张的静脉向腔内突出,压力过大会导致静脉破裂出血[6-7]。传统的治疗方法是药物、三腔二囊管压迫等方法,但效果一般,止血维持时间短。外科手术或经颈静脉肝内门体分流手术(TIPS)可以暂时缓解静脉曲张,但术后并发症发生率较高,而且极易复发,疗效有限[8]。随着内镜的普及以及微创外科的飞速发展,内镜治疗的适用范围不断扩大,止血效果显著,患者更易接受。然而,传统的胃底组织胶注射和食管静脉序贯治疗需多次反复应用硬化剂和组织胶,易造成食管和胃溃疡、出血、食管狭窄等并发症,远期出血也时有发生[9-10]。
本研究中观察组采用ESVD治疗门脉高压食管胃静脉曲张,在胃镜下用穿刺针找到曲张静脉来源,由远至近注射硬化剂和组织胶,起到栓塞作用,可完全封堵曲张静脉从而获得较好的止血效果[11]。近年来临床上按照曲张静脉的血流方向将食管胃静脉曲张分为4种类型,包括静脉回流上行、静脉回流下行、静脉回流上下行以及静脉回流不确定,根据血流的方向穿过贲门、胃底和胃体寻找曲张静脉的源头,根据分流特征注射聚桂醇硬化剂和组织胶进行血管栓塞,封堵后开展硬化治疗提高了临床疗效[12-13]。ESVD治疗的关键是要确定曲张静脉来源并进行精准断流,而决定是否出现复发和再出血的重要因素是来源血管是否完全闭塞。近年来越来越多的临床医师利用门静脉CT血管成像(CTA)、内镜等方式寻找血管来源支,通过血管夹将血管来源支夹闭断流,阻断血流,可减少组织胶使用量,并可减少术后异位栓塞的发生[14]。治疗期间发现胃底静脉出现萎缩和实变,如在食管静脉看到聚桂醇充盈呈现灰白色则表示血流中断,聚桂醇可引起血管内皮组织炎性反应,损伤血管内皮进而阻塞血管,起到止血效果[15]。ESVD一方面有助于精准断流血管来源支,避免在食管内的过多操作,能同时对曲张的食管和胃静脉进行治疗;另一方面能提高疗效,静脉曲张改善情况更为显著,而且能减少内镜治疗的次数,有利于减轻患者的心理压力,节省医疗资源[16]。
本研究显示,观察组的治疗次数少于对照组(P<0.05),但观察组和对照组的硬化剂和组织胶使用量的差异均无统计学意义(P均>0.05),说明采用ESVD治疗食管胃静脉曲张破裂出血能减少治疗次数。观察组的术后6个月静脉曲张消失率高于对照组,说明采用ESVD治疗食管胃静脉曲张破裂出血可达到消除静脉曲张的作用,疗效更好。观察组和对照组的并发症发生率差异无统计学意义(P>0.05),说明ESVD治疗食管胃静脉曲张破裂出血并未提升并发症发生率。本研究评估了ESVD治疗食管胃静脉曲张破裂出血的效果,但因本研究纳入患者数量有限且随访时间较短,因此今后需增加样本量,并进行长期随访研究。
综上所述,ESVD治疗食管胃静脉曲张破裂出血具有操作简便、术后静脉曲张消失率高的优势。

