维生素D与缺血性脑卒中预后的相关性研究
高玲玲,张文静,查才军,刘彦虹
(哈尔滨医科大学附属第二医院检验科,黑龙江哈尔滨 150086)
脑卒中已成为我国人口死亡的主要原因,其高病死率及高致残率为患者及家属带来极大的经济负担[1]。脑卒中包括出血性脑卒中和缺血性脑卒中,其中,缺血性脑卒中是最常见的一种类型。对缺血性脑卒中进行早期诊断并积极治疗可改善预后,降低病死率[2]。尽早评估缺血性脑卒中患者病情严重程度及预后可优化护理流程,合理分配医疗资源,促进患者身心健康[3]。因此,研究人员应该积极寻找对缺血性脑卒中预后具有预测价值的生物标志物,延缓疾病进展,优化治疗方案。
维生素D是一种类固醇激素,其在促进钙磷吸收,维持骨骼稳定方面发挥重要作用。25-羟基维生素D[25(OH)D]因其半衰期较长被认为是反映人体维生素D水平的可靠指标。近年来,越来越多的研究表明维生素D与心血管疾病、糖尿病、动脉粥样硬化等疾病相关[4-5]。BRØNDUM-JACOBSEN等[6]研究发现,随着25(OH)D水平降低,缺血性脑卒中发生风险显著增加。本课题组前期研究表明,维生素D水平降低与缺血性脑卒中严重程度相关[7]。因此,本研究旨在进一步探讨维生素D与缺血性脑卒中预后之间的相关性,通过测定维生素D水平,分析其在预测缺血性脑卒中预后不良中的价值。
1 资料与方法
1.1一般资料 选取2018年6月至2019年1月就诊于本院神经内科并经头颅CT或MRI诊断为缺血性脑卒中患者220例为研究对象,其中男129例,女91例。纳入标准参照中华医学会神经病学分会脑血管病学组制定的《中国急性缺血性脑卒中诊治指南 2018》标准[8]。排除标准:(1)脑出血或脑外伤者;(2)近期服用钙剂或活性维生素D3者;(3)甲状旁腺功能亢进以及其他甲状腺疾病者;(4)自身免疫性疾病者;(5)严重肝、肾功能不全或血液系统疾病者;(6)急、慢性感染或急性心肌梗死者;(7)恶性肿瘤者。本研究所有入组对象均已签署知情同意书,并获得本院伦理委员会批准。所有入组对象均采集其一般信息及既往史。采用水银柱血压计测量2次肱动脉血压,并取平均值。同时于入院24 h内收集患者空腹静脉血,并测定25(OH)D、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)的水平。根据文献[9],将25(OH)D<20 ng/mL定义为维生素D缺乏。
1.2仪器与试剂 德国罗氏MODULAR D2400 P800全自动生化分析仪,意大利索灵LIAISON化学发光分析仪。所需试剂为TG检测试剂(德国罗氏公司,批号:25499801,34776501),TC检测试剂(德国罗氏公司,批号:26998101,28676201),HDL-C酶液1(日本积水医疗株式会社,批号:825RLO,822RCO,826RCP,827REP),HDL-C酶液2(日本积水医疗株式会社,批号:818RAO,820RKO,821RAP),LDL-C酶液(日本积水医疗株式会社,批号:830RBP,828RJO,831RDP),LDL-C显色液(日本积水医疗株式会社,批号:829RLO,830RBP,827RHO,831RDP),FBG检测试剂(德国罗氏公司,批号:25789901),25(OH)D检测试剂(意大利索灵公司,批号:3070200009)。
1.3方法
1.3.1指标的检测 采用全自动生化分析仪检测TG、TC、HDL-C、LDL-C、FBG水平;采用索灵化学发光分析仪检测25(OH)D水平,检测下限为4 ng/mL。
1.3.2神经功能及预后评定 采用美国国立卫生研究院卒中量表(NIHSS)评估患者神经功能,总分为42分,分值越高,表示神经功能缺损程度越重[10]。根据改良Rankin量表(mRS)评分评估发病90 d后的预后情况,将mRS评分≤2分定义为预后良好,mRS评分≥3分定义为预后不良[11]。

2 结 果
2.1研究对象的临床资料比较 所有研究对象25(OH)D的水平为17.05(12.30,22.48)ng/mL。维生素D的缺乏率为64.1%(141/220)。本研究以25(OH)D的P75水平值(22.48 ng/mL)为界,将所有患者分为25(OH)D<22.48 ng/mL组(A组,n=165)和25(OH)D≥22.48 ng/mL组(B组,n=55)。A组年龄、男性占比、NIHSS评分、mRS评分、TC、TG及LDL-C水平与B组比较,差异均有统计学意义(P<0.05),见表1。
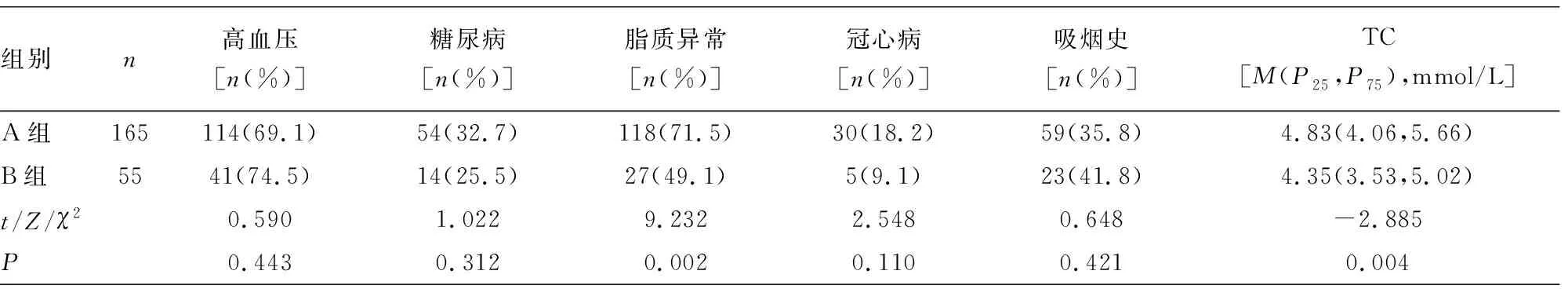
组别n高血压[n(%)]糖尿病[n(%)]脂质异常[n(%)]冠心病[n(%)]吸烟史[n(%)]TC[M(P25,P75),mmol/L]A组165114(69.1)54(32.7)118(71.5)30(18.2)59(35.8)4.83(4.06,5.66)B组5541(74.5)14(25.5)27(49.1) 5(9.1)23(41.8)4.35(3.53,5.02)t/Z/χ20.5901.0229.2322.5480.648-2.885P0.4430.3120.0020.1100.4210.004

组别nTG[M(P25,P75),mmol/L]HDL-C[M(P25,P75),mmol/L]LDL-C[M(P25,P75),mmol/L]FBG[M(P25,P75),mmol/L]A组1651.89(1.43,2.57) 1.22(1.05,1.45)2.82(2.23,3.53)5.55(4.88,7.29)B组551.34(1.17,2.36) 1.27(1.08,1.52)2.44(1.94,3.02)5.41(4.81,6.07)t/Z/χ2-3.050-0.740-3.055-1.449P0.0020.4590.0020.147
2.2血清25(OH)D水平与缺血性脑卒中患者临床特征的相关性分析 缺血性脑卒中患者中,25(OH)D水平与NIHSS评分及mRS评分呈负相关(r=-0.469、0.403,P<0.001)。同时,25(OH)D水平与年龄、TG、LDL-C及FBG水平呈负相关(r=-0.303、-0.170、-0.160、-0.172,P<0.05),见表2。
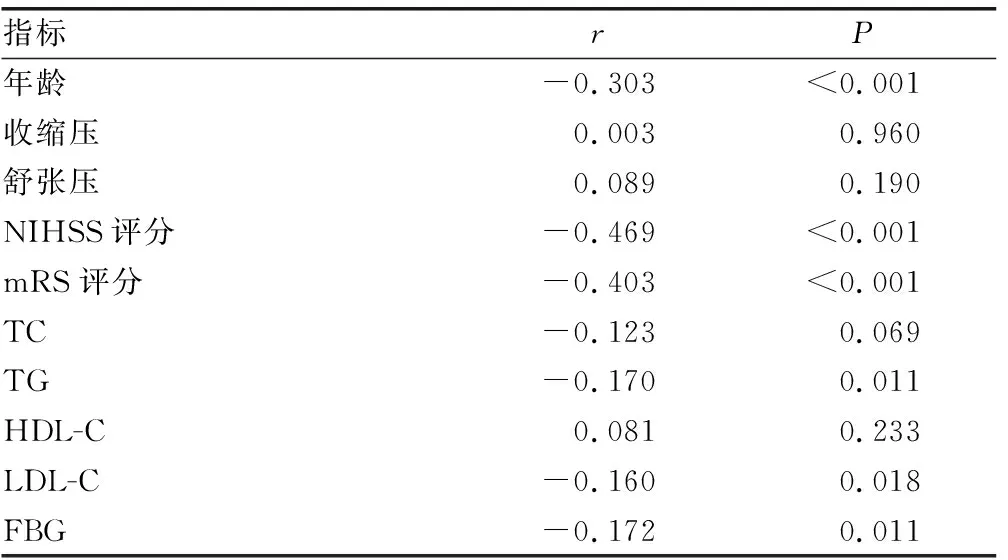
表2 血清25(OH)D水平与缺血性脑卒中患者临床特征的相关性分析
2.3血清25(OH)D水平对缺血性脑卒中患者预后的诊断价值 利用ROC 曲线评估25(OH)D对缺血性脑卒中预后的诊断价值,结果显示,25(OH)D诊断缺血性脑卒中预后的曲线下面积(AUC)为0.769,95%CI:0.691~0.846;NIHSS评分诊断缺血性脑卒中预后的AUC为0.866,95%CI:0.809~0.923。25(OH)D诊断缺血性脑卒中预后的cut-off值为13.3 ng/mL,灵敏度为69.0%,特异度为80.9%。然而二者联合并未提高诊断价值(AUC=0.863,95%CI:0.801~0.925,P<0.001)。
2.4血清25(OH)D水平与缺血性脑卒中患者预后的关系 根据mRS评分将缺血性脑卒中患者分为预后不良组(mRS评分≥3分)及预后良好组(mRS评分≤2分),分析两组25(OH)D水平的差异,结果显示,预后不良组25(OH)D水平[11.65(8.73,15.43)ng/mL]显著低于预后良好组[18.90(14.50,23.33)ng/mL],差异有统计学意义(P<0.05)。将25(OH)D水平按照25(OH)D<12.30 ng/mL、12.30~<17.04 ng/mL、17.05~<22.47 ng/mL、≥22.48 ng/mL共4组,并以25(OH)D≥22.48 ng/mL作为参照,结果显示,随着25(OH)D水平降低,缺血性脑卒中预后不良发生风险增加,当25(OH)D<12.30 ng/mL时,缺血性脑卒中预后不良的发生风险约是25(OH)D≥22.48 ng/mL患者的13倍,见表3。
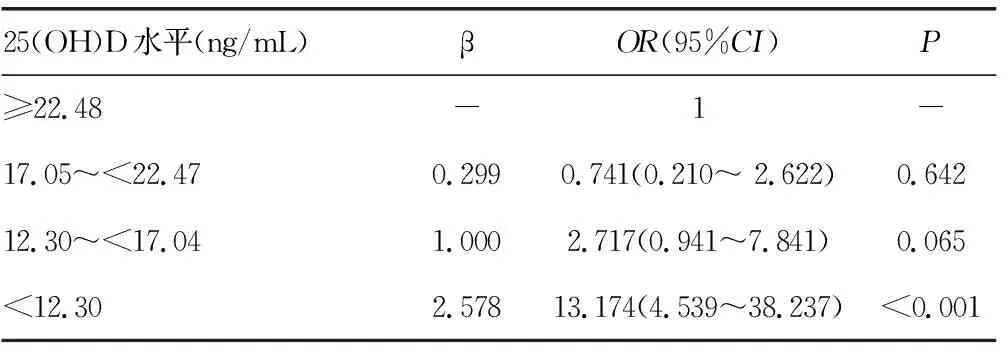
表3 Logistic回归分析25(OH)D对缺血性脑卒中预后的预测作用
3 讨 论
日光照射、饮食摄取及维生素D制剂的补充是体内维生素D的主要来源。目前,维生素D缺乏较为常见。在美国成年人中,维生素D缺乏率可达41.6%,我国一项历时4年的研究指出,60岁以上人群维生素D缺乏率为34.3%[12-13]。参照文献[9],本研究中维生素D缺乏率为64.1%,高于其他研究,可能与地理位置及不同标本收集季节有关[14]。东北地区为高纬度地区,相关研究指出,维生素D水平随地域纬度增加而降低,且本研究标本收集季节多集中于秋冬季,东北地区秋冬季节气温较低,患者日光暴露减少,进一步导致维生素D水平降低[15-16]。
维生素D水平与心脑血管疾病及其危险因素具有相关性。既往研究表明随着25(OH)D水平降低,心脑血管疾病发生风险随之增加[17]。研究表明维生素D可通过防止胰岛β细胞凋亡进而调控血糖[5],本研究发现A组糖尿病患者所占比例高于B组,且25(OH)D水平与FBG水平呈负相关与上述研究结论相符。本研究结果显示,A组脂质异常患者所占比例高于B组(P<0.05),同时,25(OH)D水平与TG及LDL-C水平呈负相关(P<0.05),原因为25(OH)D缺乏可通过激活甾醇调节元件结合蛋白2促进胆固醇从头合成,以及低水平的25(OH)D可促进巨噬细胞向泡沫细胞转化,进而导致动脉粥样硬化[18-19]。
动物实验证实维生素D及维生素D受体是大脑发育的重要调节因子,敲除维生素D受体的小鼠更易出现与神经功能相关的运动障碍[20]。本研究结果发现,25(OH)D水平与NIHSS评分呈负相关(P<0.05),该结果与TU等[21]研究结果一致,说明25(OH)D水平降低可能增加缺血性脑卒中严重程度。BALDEN等[22]通过建立缺血性脑卒中小鼠模型发现,与正常饮食组相比,缺乏维生素D饮食的喂养组梗死后神经损伤更严重。
体外研究表明,维生素D可调节神经元钙离子,上调神经元营养通路,增强神经传导,促进轴突及树突的再生,加速中枢神经系统的恢复,还可通过激活Shh、JAK2-STAT3、MEK/ERK以及PI3-K/AKT等信号通路保护神经功能[23]。一氧化氮水平升高可导致神经毒性及神经退行性病变,抑制诱导型一氧化氮合酶合成,抗氧化及抗炎作用可能是维生素D保护神经功能的另一机制[23]。另有研究表明,维生素D可能与神经元周围网络相互作用,维生素D缺乏可干扰突触可塑性形成,导致神经功能障碍[24]。本研究中预后不良组患者血清25(OH)D水平显著低于预后良好组(P<0.05),说明随着25(OH)D水平降低,缺血性脑卒中患者预后不良可能性增大。本研究采用ROC曲线分析了25(OH)D水平对缺血性脑卒中患者预后不良的诊断价值,当cut-off值为13.3 ng/mL时,其灵敏度为69.0%,特异性为80.9%。进一步采用Logistic回归分析25(OH)D预测缺血性脑卒中预后的发生风险,结果显示,当25(OH)D<12.30 ng/mL时,缺血性脑卒中预后不良的发生风险约是25(OH)D≥22.48 ng/mL患者的13倍。
目前已有相关临床试验对补充维生素D的作用进行研究。SLUYTER等[25]研究表明通过长期补充维生素D可降低维生素D缺乏成年人的中心动脉压。而一篇荟萃分析指出补充维生素D并未显著改善动脉硬化情况,降低心血管疾病发生风险[26]。
4 结 论
综上所述,维生素D水平降低是缺血性脑卒中患者预后不良的危险因素,且分析其水平对预后情况具有一定的诊断价值。然而补充维生素D对缺血性脑卒中患者预后是否具有改善作用仍需进一步探讨。

