杨梅叶中杨梅素的提取及抗氧化性研究
童天娇, 刘军海, 刘 艳, 曹 瑞, 魏玲玲
(陕西理工大学 化学与环境科学学院,陕西 汉中 723000)
杨梅树又名山杨梅、朱红、珠蓉,属于杨梅科常绿乔木,适应性广,易于栽培,适宜在酸性的土壤种植。杨梅树的人工栽培技术已经有2 000多年的历史,中国的浙江、江苏、台湾、福建等地均有分布,在东南亚国家也有分布。杨梅树生长于山坡或山谷森林中,树龄长,可绿化美化环境,具有很高的观赏价值。杨梅果实、杨梅叶、杨梅根、杨梅树皮等均有食用或药用价值。杨梅叶含有黄酮类化学物、原花青素、精油等多种活性成分,具有很高的经济价值。杨梅叶中黄酮类化合物的主要成分为杨梅素,又名杨梅树皮素、杨梅黄酮,是一种多羟基黄酮,具有抗氧化作用,置于空气中易被氧化成绿色[1]。杨梅素主要来源是杨梅科及其他天然植物,因具有多样的医药价值而受到广泛的关注和大量的研究[2-4]。从杨梅树自身的应用价值来看,杨梅颈条、杨梅枝条和杨梅叶均含有杨梅素[5-6]。杨梅叶资源丰富,目前没有得到有效的利用,大量废弃造成资源的浪费。因此,本研究以杨梅叶为原料,采用超声波提取工艺提取杨梅素,在单因素试验基础上通过正交试验优化提取工艺,并考察了杨梅素的抗氧化活性,以期为杨梅素的提取与应用,以及杨梅叶资源的开发提供理论参考。
1 材料与方法
1.1 原料、试剂与仪器
杨梅叶,采于浙江余姚市;杨梅素标准品(纯度≥97%),上海笛柏生物科技有限公司;维生素C片,西安利君制药有限责任公司;DPPH、硫酸亚铁、30%过氧化氢、水杨酸、无水乙醇,均为分析纯。
FW117中草药粉碎机,天津泰斯特仪器有限公司;超声波清洗机,宁波新芝生物科技股份有限公司;离心机,北京京立离心机有限公司;722可见分光光度计,上海仪电分析仪器有限公司制造;电热鼓风干燥箱,天津市泰斯特仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;Cary50型紫外可见分光光度计,美国瓦里安;LC-2030液相色谱仪,岛津公司。
1.2 杨梅素的提取与测定方法
1.2.1原料的预处理 杨梅叶经蒸馏水清洗、自然晾干后,于60 ℃烘箱中干燥至质量恒定,然后粉碎机粉碎过425 μm筛,得到杨梅叶粉末,备用。
1.2.2杨梅素的提取 准确称取一定量的杨梅叶粉末于烧杯中,加入一定量的乙醇溶液浸泡0.5 h后,加表面活性剂茶皂素[7],在超声波[8]提取器中设置一定温度、时间进行提取。提取结束后,冷却至室温,离心,收集离心瓶中的溶液于量筒中,记录其体积(V),得到杨梅素的提取液,稀释一定的倍数,采用液相色谱仪在检测波长373 nm时测定杨梅素的色谱峰面积,根据标准曲线计算杨梅素质量浓度,按下式计算杨梅素的提取得率。
式中:Y—杨梅素提取得率,%;C—由标准曲线方程计算得到的杨梅素质量浓度,g/L;V—杨梅素提取液的体积,L;N—提取液的稀释倍数;m—称取杨梅叶粉末质量,g。
1.2.3保留时间的确定 准确称取杨梅素标准品20 mg,以体积分数80%的乙醇溶液溶解于100 mL容量瓶。在离心管中取少量杨梅素稀释液,离心机转速3 000 r/min离心10 min后,取一定体积定容至50 mL,用液相色谱仪测定[9],检测器为UV-Vis,检测波长为373 nm[10],C18色谱柱(150 mm×2.1 mm,粒径3.5 μm),柱温30 ℃,进样量10 μL,流速0.8 mL/min。杨梅素标准品色谱图见图1(a),杨梅素提取液色谱图见图1(b)。由图可知,杨梅素的保留时间为2.3 min左右。

图1 杨梅素标准品(a)和提取液(b)的色谱图
1.2.4标准曲线的绘制 准确称取20 mg杨梅素标准品,并用80%乙醇溶液溶解于100 mL容量瓶。于6个25 mL容量瓶分别移取2.0、 4.0、 6.0、 8.0、 10.0和12.0 mL上述溶液,用80%乙醇溶液稀释定容摇匀静置;分别取少量的稀释液,以1.2.3节方法进行离心操作,在373 nm处分别测定各溶液的色谱峰面积;以杨梅素标准品溶液的质量浓度(g/L)为横坐标,峰面积为纵坐标,绘制标准曲线。在质量浓度0.016~0.096 g/L范围内,得到线性回归方程为:y=455 795.21x-86 988.6,相关系数为0.999 8,说明峰面积与溶液质量浓度之间有良好的线性关系。
1.3 杨梅素的抗氧化性实验
1.3.1DPPH自由基清除率的测定 按文献[11-12]方法,以正交试验所得到的最佳提取工艺提取杨梅素,将杨梅素溶液稀释配制成0.5、 1.0、 1.5、 2.0、 2.5和3.0 mg/L系列溶液。以无水乙醇为溶剂,在棕色容量瓶中制备浓度为0.1 mol/L DPPH自由基溶液。将不同质量浓度的杨梅素溶液各取2.0 mL于 10 mL 试管,并加入2.0 mL DPPH自由基溶液,摇匀,反应30 min,在377 nm测量吸光度(Ai)。另取不同质量浓度的杨梅素溶液2.0 mL于10 mL试管中,用2.0 mL无水乙醇代替DPPH自由基溶液,反应30 min,测量吸光度(Aj)。用2.0 mL DPPH自由基溶液和2.0 mL无水乙醇溶液代替杨梅素溶液,摇匀,反应30 min,测量吸光度(A0)作为参比,用相同的实验方法测定VC的抗氧化活性。杨梅素对DPPH·清除率(η)的计算公式为:η=[1-(Ai-Aj)/A0]×100%。
1.3.2OH自由基清除率的测定 参考文献[13-14]方法,将杨梅素稀释成30、 60、 90、 120和150 mg/L 的溶液。取1 mL不同质量浓度的杨梅素稀释液于试管中,各加入1 mL的2.25 mmol/L FeSO4和2.25 mmol/L H2O2至混合液中,静置10 min后,加入1 mL 2.25 mmol/L水杨酸溶液,混合溶液置于黑暗处反应30 min,于377 nm处测定溶液的吸光度(Ai);使用蒸馏水代替水杨酸溶液,测其吸光度(Aj);用蒸馏水代替杨梅素溶液,测其吸光度(A0),通过相同的实验方法测定VC的抗氧化活性。杨梅素对·OH 清除率(η)的计算公式同1.3.1节。
2 结果与讨论
2.1 杨梅素提取的单因素试验
2.1.1液料比 准确称取1.0 g杨梅叶粉末5份,置于5个100 mL烧杯中,以液料比10 ∶1、 15 ∶1、 20 ∶1、 25 ∶1和30 ∶1(mL ∶g,下同)分别加入80%的乙醇溶液,摇匀,浸泡0.5 h之后,加入0.5%(以杨梅叶粉末质量计,下同)表面活性剂茶皂素,设定超声波提取温度60 ℃,提取时间40 min,进行超声波提取。液料比值对提取得率的影响见图2(a)。由图2(a)可以看出,随着液料比值的增加,杨梅素的提取得率呈现出先增加后降低的趋势,液料比值为20时,提取得率最大为1.211%。这是因为随着提取溶剂用量的增加,杨梅素可以充分地溶解,提取得率增加;当液料比值达到20时,杨梅素已基本溶解,此后再增加提取溶剂用量,对提取得率几乎没有影响。因此,适宜的液料比为20 ∶1。
2.1.2乙醇体积分数 准确称取1.0 g杨梅叶粉末5份,置于5个100 mL烧杯中,分别加入60%、 70%、 80%、 90%和100%的乙醇溶液20 mL,摇匀,浸泡0.5 h后,分别加入0.5%表面活性剂,按照2.1.1节方法进行超声波提取,计算杨梅素的提取得率。乙醇体积分数对杨梅素提取得率的影响见图2(b)。由图2(b)可以看出,杨梅素的提取得率随着乙醇体积分数的增加不断增加,当乙醇体积分数为80%时,提取得率达到1.143%,此后体积分数再增加,杨梅素提取得率开始不断下降。根据相似相溶原理,原因是杨梅素与80%的乙醇水溶液的极性接近。因此合适的乙醇体积分数为80%。
2.1.3提取温度 准确称取1.0 g杨梅叶粉末5份,置于5个100 mL烧杯中,加入体积分数80%乙醇溶液20 mL,浸泡后加入0.5%表面活性剂,分别控制提取温度为40、 50、 60、 70和80 ℃,按照2.1.1节实验方法进行超声波提取,并计算杨梅素的提取得率。提取温度对得率的影响结果见图2(c)。由图2(c)可以看出,当温度不断升高时,杨梅素的提取得率呈先增加后降低的趋势,在温度60 ℃时,提取得率最大为1.165%。这是因为温度升高,杨梅素的溶解度增加,故可以提高其提取得率。杨梅素为大分子有机化合物,当温度高于80 ℃时,结构被一定程度地破坏,失去活性;同时高温也会影响表面活性剂的增溶效果,故提取得率会降低。综合分析适宜的提取温度为60 ℃。
2.1.4提取时间 准确称取1.0 g杨梅叶粉末5份,置于5个100 mL烧杯中,按液料比20 ∶1加入体积分数为80%乙醇溶液,浸泡后加入0.5%表面活性剂,分别控制超声波提取时间为20、 30、 40、 50和60 min,按照2.1.1节实验方法进行超声波提取,并计算杨梅素的提取得率。提取时间对杨梅素提取得率的影响结果见图2(d)。由图2(d)可以看出,提取时间达到20~50 min时,杨梅素的提取得率从0.965% 增加到1.273%,提取时间达到60 min时得率又有所下降。这是因为杨梅素溶解于溶剂中需要一段时间,故提取时间的增加为杨梅素提取提供很好的条件,但时间过长可能会导致杨梅素的结构发生变化,影响提取效果。故选择50 min为适宜的提取时间。
2.1.5表面活性剂用量 准确称取1.0 g杨梅叶粉末5份,置于5个100 mL烧杯中,按液料比20 ∶1加入体积分数为80%乙醇溶液,浸泡0.5 h后,加入0.1%、 0.3%、 0.5%、 0.7%和0.9%表面活性剂茶皂素[15],即0.001、 0.003、 0.005、 0.007和0.009 g,按照2.1.1节实验方法进行超声波提取,并计算杨梅素的提取得率。表面活性剂用量对杨梅素提取得率的影响结果见图2(e)。由图2(e)可以看出,在表面活性剂用量为0.1%~0.9%的范围内,杨梅素的提取得率先增大后减小,用量为0.5%时提取得率最大为1.169%。茶皂素是一类天然提取的表面活性剂,利用分子结构的两亲性可改变提取溶液的界面性质,以此影响杨梅素的提取结果,故表面活性剂对杨梅素有增溶效果[15-16],提取得率提高。由图可知在表面活性剂用量为0.5%时提取得率最大,故表面活性剂的适宜用量为0.5%。
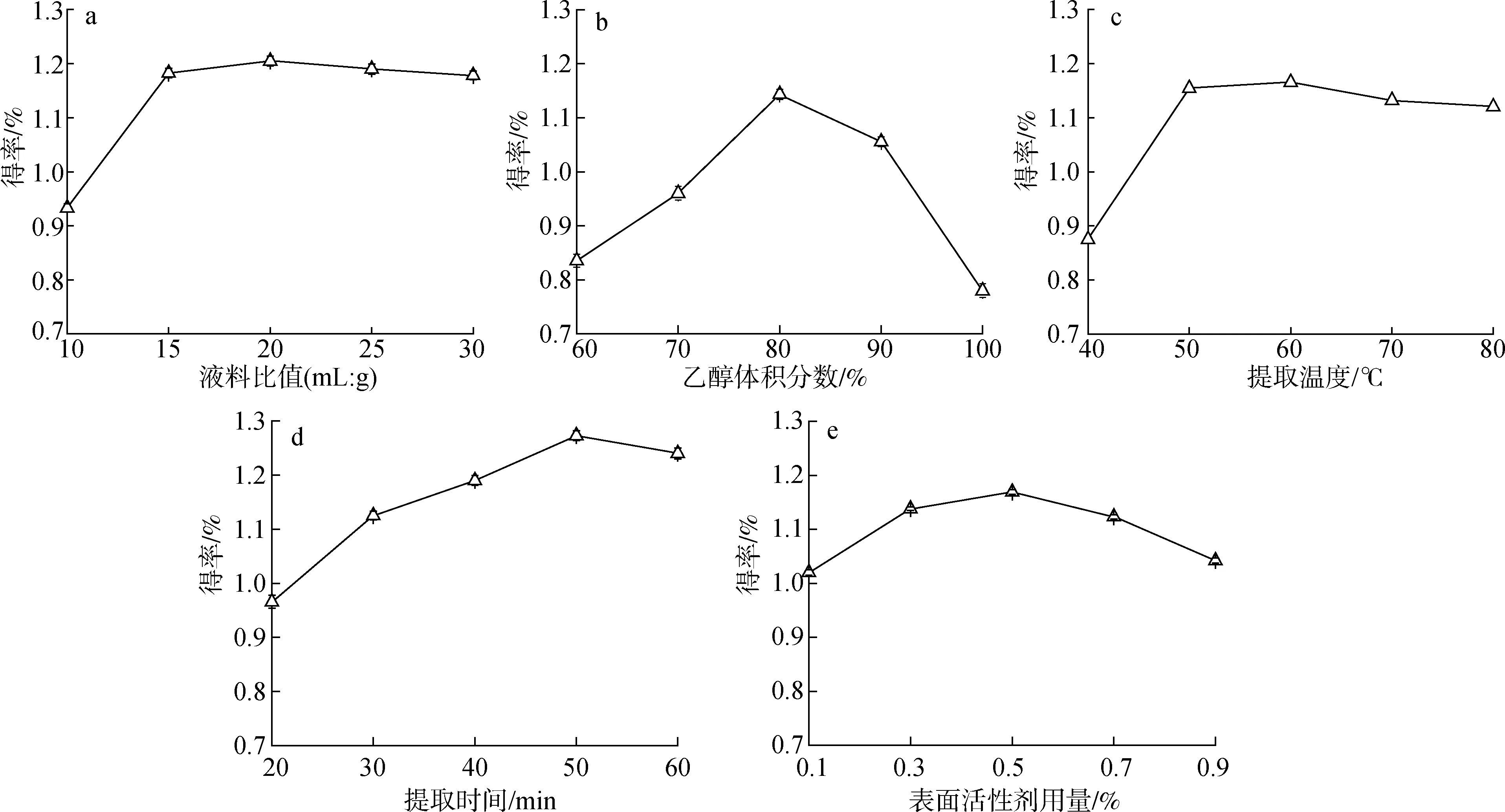
a.液料比liquid-to-material ratio; b.乙醇体积分数ethanol volume fraction; c.提取温度extraction temperature;
2.2 正交试验优化提取工艺
2.2.1正交试验设计及直观分析 根据单因素试验结果,以液料比、乙醇体积分数、提取温度、提取时间和表面活性剂用量这5个因素,选取4个不同水平,设计L16(45)正交试验,以此进一步优化杨梅素的最佳提取工艺条件,正交试验设计及直观分析见表1。由表1可以看出,杨梅叶中杨梅素的最佳提取工艺条件为A2B2C3D2E1,即液料比15 ∶1,乙醇体积分数80%,提取温度70 ℃,提取时间为50 min,表面活性剂用量0.3%(0.003 g),提取得率最高可达到1.35%。
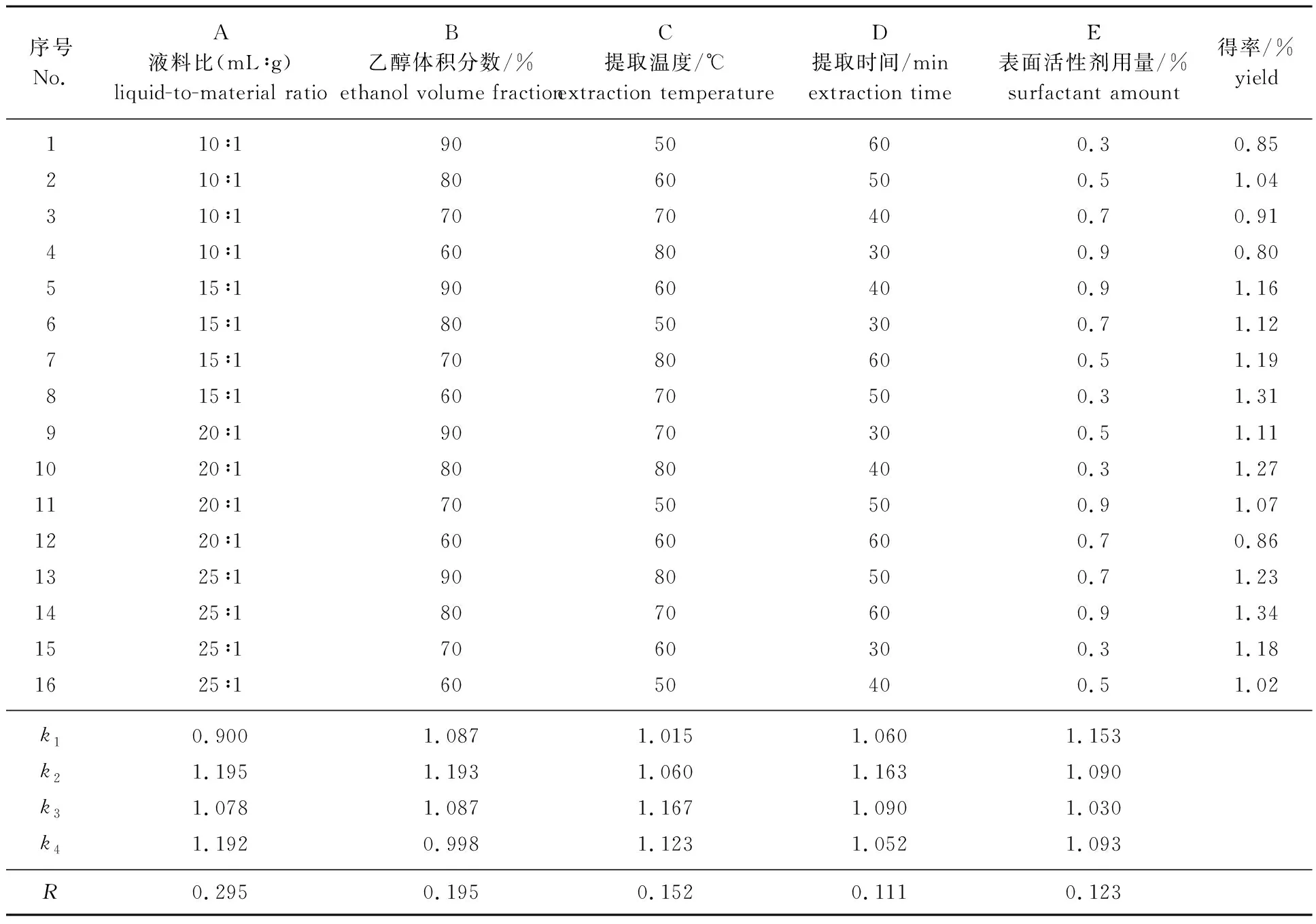
表1 正交试验设计及直观分析Table 1 Orthogonal experimental design and visual analysis
2.2.2正交试验结果的方差分析 对表1结果进行方差分析,结果见表2。方差分析表明,液料比和乙醇体积分数对提取得率的影响较大,提取温度、提取时间和表面活性剂用量对提取得率的影响较小。因此,实际操作过程中,可适当升高温度,减少提取时间或增加表面活性剂用量,以提高生产能力,节约生产成本。
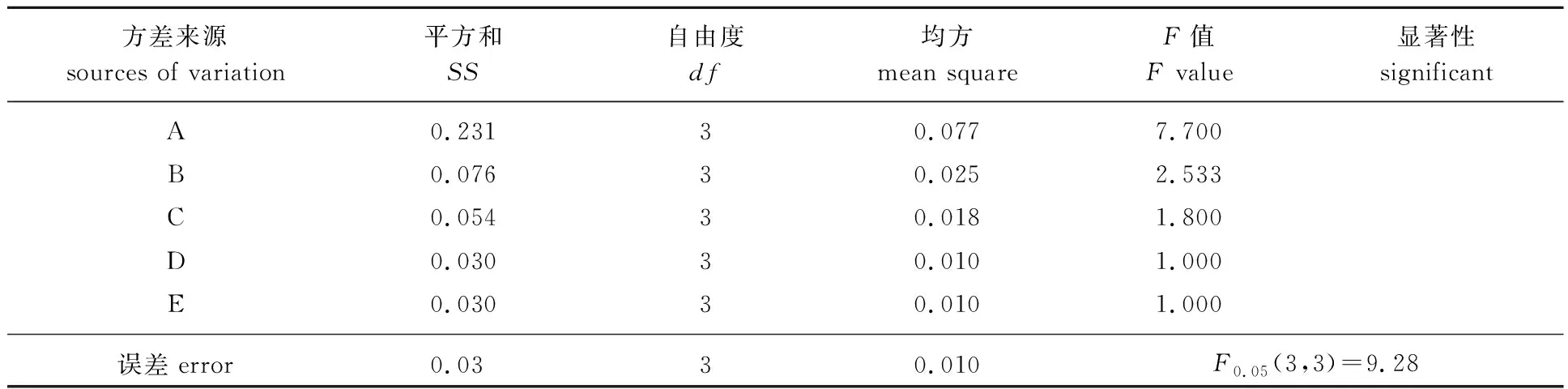
表2 正交试验结果的方差分析Table 2 Variance analysis of orthogonal experimental results
2.2.3验证实验 对2.2.1节的最佳提取工艺条件进行验证实验,操作条件分别为液料比15 ∶1,乙醇体积分数80%,提取温度70 ℃,提取时间为50 min,表面活性剂的用量0.3%。平行3次实验,提取得率取平均值,最终杨梅素提取得率为1.33%。
茶皂素是一类天然表面活性剂,用于杨梅素的提取不会造成二次污染,符合现在的绿色环保理念。本研究采用茶皂素强化提取技术,对比邓丹雯等[17]未加表面活性剂茶皂素提取杨梅素提取时间为1.5 h,提取得率为1.355%,在本实验中加入茶皂素之后提取得率为1.33%,提取时间为50 min,可见加入茶皂素能缩短提取时间,降低提取成本,具有较好的发展前景,可为杨梅素的提取以及杨梅叶的开发提供很好的参考价值。
2.3 杨梅素抗氧化性分析
2.3.1DPPH·清除率 杨梅素对DPPH·的清除率结果见图3(a)。由图3(a)可以看出,在质量浓度0.5~3.0 mg/L的范围内,VC和杨梅素对DPPH·的清除率均不断增加,在低浓度时两者的抗氧化能力均随浓度的升高快速增加,但杨梅素的清除率始终低于VC;当质量浓度达到最高3.0 mg/L时,VC的清除率达到56.49%,此时杨梅素清除率最高为52.11%。其中,杨梅素对DPPH·的IC50值为2.670 mg/L,VC对DPPH·的IC50值为2.363 mg/L。在实验的质量浓度范围内两者的清除效果差别不大,但VC的DPPH·清除效果要略优于杨梅素。
2.3.2·OH清除率 杨梅素对·OH的清除率结果见图3(b)。由图3(b)可知,质量浓度为30~150 mg/L 时,VC对·OH的清除率不断增加,在150 mg/L时达到最高74.96%;而杨梅素对·OH的清除率先增加后保持稳定,当质量浓度为120 mg/L时,杨梅素对·OH的清除率达到最高为64.21%,此时VC的清除率为72.11%。其中,杨梅素对·OH的IC50值为91.139 mg/L,VC对·OH的IC50值为61.483 mg/L。可以看出,杨梅素的·OH清除效果略低于VC。

图3 DPPH· (a)和·OH(b)清除率的测定
3 结 论
3.1以杨梅叶为原料,表面活性剂茶皂素为提取强化剂,采用超声波提取工艺,在单因素试验的基础上,采用正交试验优化杨梅素的提取工艺。结果表明:杨梅素提取的最佳工艺条件为液料比15 ∶1(mL ∶g),乙醇体积分数80%,提取温度70 ℃,提取时间50 min,表面活性剂茶皂素用量为原料质量的0.3%,在此工艺条件下,杨梅素提取得率可达到1.33%。
3.2杨梅素抗氧化实验结果表明:当质量浓度达到3.0 mg/L时,VC对DPPH·的清除率达到56.49%,杨梅素对DPPH·的清除率为52.11%,VC和杨梅素对DPPH·的IC50值分别为2.363和2.670 mg/L;当质量浓度为150 mg/L 时,VC对·OH的清除率达到最高74.96%,而杨梅素对·OH的清除率在120 mg/L时达到最大,为64.21%,VC和杨梅素对·OH的IC50值分别为61.483和91.139 mg/L。可以看出,杨梅素对DPPH·和·OH清除率较高,抗氧化能力较好,但整体效果略低于VC。

