核桃转录因子JrDof3的克隆及渗透胁迫表达分析
马凯恒,张 彤,闫鹏宇,李文凯,李大培,杨桂燕
(1.西北农林科技大学 林学院,陕西 杨凌 712100;2.陕西省核桃工程技术研究中心,陕西 杨凌 712100)
Dof(DNA-binding one zinc finger)是一类普遍存在于植物中的转录因子,属于锌指蛋白家族,由两个结构域构成:含有一个单锌指结构域,即N-末端的Dof 结构域,较保守;含有一个氨基酸序列多样的转录调控结构域,即C-末端结构域,较多变[1]。C-末端结构域中由一个特殊的C2-C2 型单锌指结构(C2-C2-Dof domain)构成的活动中心负责调控靶基因的转录,从而调控植物的生长发育等过程[2],如碳的固定与氮的同化吸收[2-3]、激素应答[4]、次生代谢[5]、花脱落[6]、导管发育[7-8]、种子脂质代谢及萌发[9-11]、光周期反应[12-13]等。Kang 等[14]在实验中发现拟南芥Arabidopsis thaliana的 三 个Dof 蛋 白OBP1、OBP2、OBP3 均受生长素、水杨酸及环己酰亚胺诱导表达,且存在组织特异性,而OBP3 过表达株系表现出严重的生长缺陷,表明Dof 蛋白受不同激素水平调控且与植株生长发育有关。在番茄Solanum lycopersicum中过表达Dof 转录因子CDF3 促进了碳同化[15]。可见,Dof 转录因子在植株中的功能具有多样性。
近年来,有关植物Dof 转录因子涉及响应高温、干旱、盐等逆境胁迫的研究开始受到广泛关注并取得了一定的成果,如,Shaw 等[16]从小麦Triticum aestivum中鉴定出31 个Dof 转录因子基因,发现其中的大部分Dof基因能响应干旱胁迫,出现下调的转录现象。在刚毛柽柳Tamarix hispida Dof家族基因响应盐和渗透胁迫的实验中,发现ThDof3、ThDof4、ThDof7 和ThDof14均受盐胁迫诱导表达,预测这些基因存在耐盐的可能性[17]。在盐及渗透胁迫下,ThDof1.4和ThZFP1均被诱导表达,且具有相似的表达模式,进一步研究发现ThDof1.4与ThZFP1形成转录调控级联,过表达时可提高脯氨酸水平以增强ROS 清除能力,从而提高柽柳的逆境生存能力[18]。Wang 等[19]从毛果杨Populus trichocarpa基因组中鉴定出41 个Dof家族基因成员,其中7 个PtrDof基因响应脱落酸(ABA)和渗透胁迫,在叶和根中的表达被显著上调,表明PtrDofs可能增强了毛果杨对非生物胁迫的耐受性。
自1993 由Yanagisawa 和Izui 最早从玉米Zea mays中鉴定出第一个Dof 以来[20],目前已从水稻Oryza sativa[21]、小麦[16]、番茄[22]、大豆Glycine max[9]、毛果杨Populus[23]等多种植物中鉴定获得了Dof基因家族相关成员,并阐明了其在植物生命过程中的功能机制;但植物Dof 家族成员较多,对其功能机制研究远远不够,特别是在木本植物中,有关Dof基因的研究仍属初步阶段。核桃Juglans regia是我国重要的木本油料树种,在我国西北、华北、西南等地区广泛种植。然而,核桃的生长发育同其他植物一样,易受不良环境的影响,果实的产量与品质均会因逆境胁迫而降低。因此,挖掘核桃逆境响应潜在基因,阐明其逆境响应功能机制,这将对选育核桃抗逆优良品种提供重要候选基因,为其科学管理打下理论基础进而推动核桃产业发展。因此,本研究从核桃转录组中鉴定获得一条Dof 转录因子家族基因,将其命名为JrDof3基因,对其基本生物学信息、启动子、逆境响应表达等进行分析,探讨其逆境响应潜力,为探究核桃Dof 转录因子在逆境响应调控中的功能机制提供基础资料。
1 材料与方法
1.1 材料及方法
选取相同培养条件下生长的2年生‘香玲’(‘Xiangling’)核桃嫁接苗用于处理。处理包括:0.3 mol·L-1氯化钠(NaCl)处理0、3、12、24 h,100 g·kg-1聚乙二醇(PEG6000)处理0、3、4、5 d,0.1 mmol·L-1脱落酸(ABA)处理0、3、24、48 h。处理后分别收集植株叶,用液氮速冻后置于-80℃冰箱储存、备用。0 h 为对照,实验设置3 次重复。每个处理包含至少6 棵植株。
1.2 JrDof3 基因的克隆与分析
基于课题组前期获得‘香玲’核桃转录组数据,以关键词“DNA-binding one zinc finger transcription factor”查找基因,运用美国生物技术信息中心网站(NCBI)中BLAST 对获得的基因进行比对,获得一条Dof 基因(命名为JrDof3)进行下一步分析。运 用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找JrDof3基因开放读码框(ORF),基于ORF 设计引物JrDof3-F 与JrDof3-R(表1),以‘香玲’核桃cDNA 为模板通过聚合酶链式反应(PCR)进行扩增,产物经过纯化回收后与pMD-18-T 载体(Takara,中国)连接,转化至大肠杆菌DH5ɑ 感受态细胞,挑取阳性单克隆进行扩大培养,进行菌液PCR 验证后送北京奥科鼎盛生物科技有限公司杨凌分公司进行测序确定。运用Expasy ProtParam(http://web.expasy.org/protparam/)对确定的JrDof3基因序列的基本特征进行分析。用保守结构域预测软件Conserved Domain Search Service(CD Search, https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析其具备的保守结构域;对来自不同物种的Dof 蛋白使用Clustal 和MEGA 进行多序列比对及系统发育分析。

表1 本研究所用引物Table 1 The primers used in the study
1.3 JrDof3 基因的启动子鉴定
基于JrDof3基因序列在核桃基因组[24]中鉴定JrDof3基因的启动子并用通过BLASTP(http://blast.ncbi.nlm.nih.gov/Blast)搜索同源序列,发现该基因与核桃Dof5.1基因序列(XR_001997405.1)高度一致。故选取XR_001997405.1 序列起始密码子上游1 299 bp 作为该基因的候选启动子,设计引物。提取核桃叶总DNA,PCR 克隆启动子片段,并利用在线工具NEW PLACE(https://www.dna.affrc.go.jp/PLACE/?action=newplace)对其启 动子包含的顺式作用元件进行预测分析。
1.4 JrDof3 基因的表达分析
使用十六烷基三甲基溴化铵(CTAB)法分别提取经NaCl、PEG6000及ABA 处理后的核桃叶总RNA[25],用DNA 消化酶处理后按照康为世纪(CWBIO,中国)生产的PrimeScriptTMRT reagent Kit 说明书反转录为cDNA。经10 倍稀释后用作实时荧光定量PCR(qRT-PCR)模板。根据SYBR Green Real time PCR Master mix(CWBIO)说明书进行qRT-PCR。核桃18S rRNA(HE574850)作为内参基因[26]。JrDof3 基因定量引物为DL-F/DL-R(表1)。采用Applied Biosystems 公司生产的Step OneTMReal-Time PCR System 仪器进行定量反应。反应程序:94 ℃/30 s;94 ℃/12 s,60 ℃/45 s,72 ℃/45 s,45个循环;81 ℃/1 s。每个样品重复3次。相对表达水平按照2-ΔΔCT法[27]进行计算。
2 结果与分析
2.1 JrDof3 全长cDNA 序列分析
从‘香玲’核桃转录组查找获得1 条Dof基因,命名为JrDof3。该基因ORF 长为873 bp,编码多肽包含291 个氨基酸,分子量为30.54 ku,理论等电点为9.36。对JrDof3 蛋白进行保守结构域分析,发现该蛋白含有Dof 结构域(图1),属于Dof 转录因子。构建进化树分析JrDof3 蛋白的系统进化情况,发现JrDof3 蛋白与来自壳斗科栎属的欧洲栓皮栎Quercus suberQsDof2.4 蛋白具有较近的进化关系(图2),进一步说明JrDof3 属于Dof 类转录因子。

图1 JrDof3 蛋白的保守结构域Fig.1 The conserved domain of JrDof3 protein

图2 JrDof3 蛋白的系统进化树分析Fig.2 Phylogenetic tree analysis of JrDof3 protein and its homologs from other species
2.2 JrDof3 启动子分析
JrDof3基因上游1299 启动子片段包含众多与逆境胁迫响应相关的顺式作用元件,如干旱、盐胁迫相关的MYB 元件、MYC 元件、WRKY 元件等,激素调控相关的ARFAT 元件、PYRIMIDINEBOXOSRAMY1A 元件等,组织特异表达相关的GATABOX 元件、OSE1ROOTNODULE 元件,光调控相关的GATABOX 元件、GT1CONSENSUS 元件等(表2)。
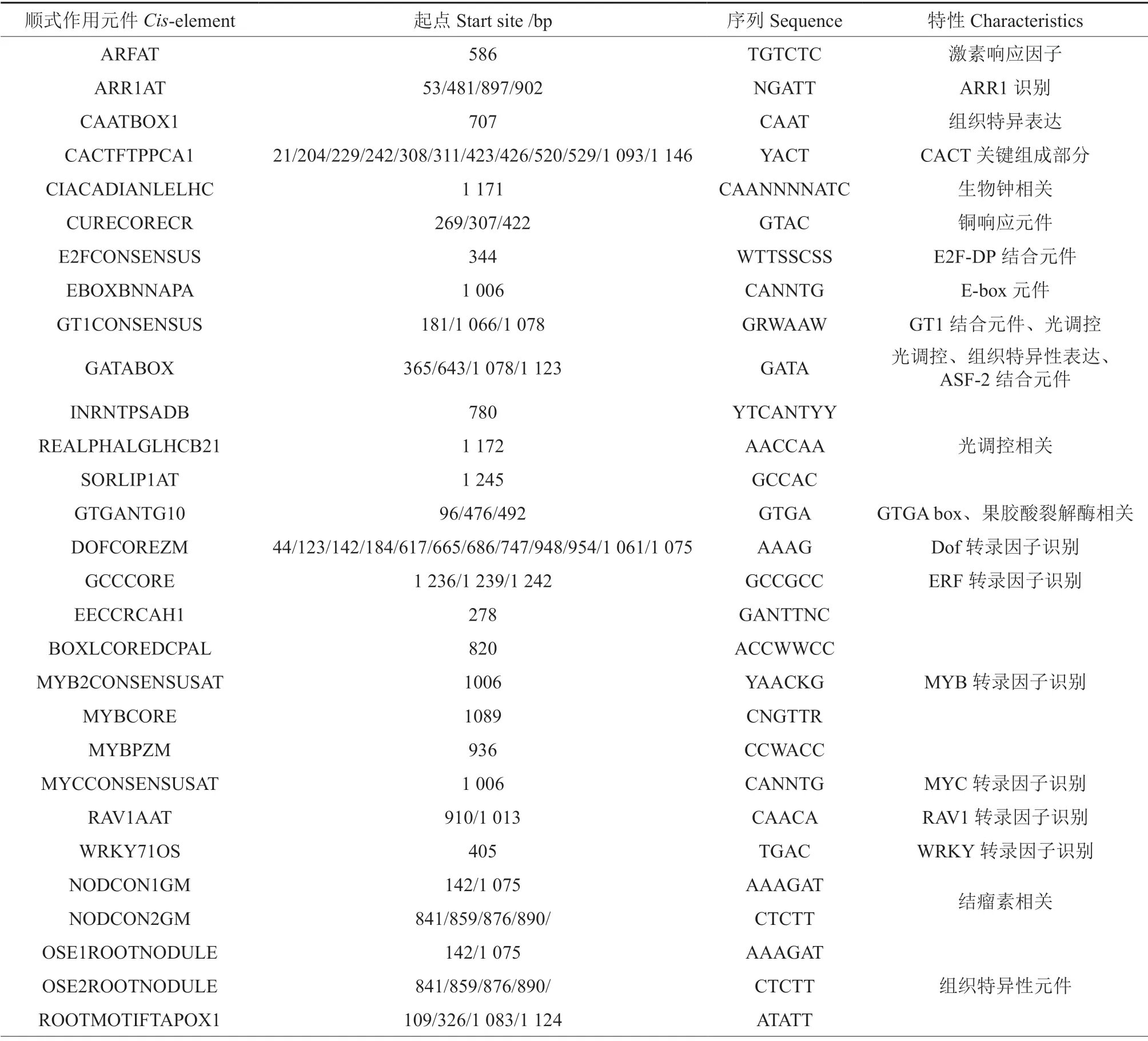
表2 JrDof3 启动子包含的主要顺式作用元件Table 2 The major cis-acting elements contained in JrDof3 promoter

续表2Continuation of table 2
2.3 渗透胁迫及ABA 处理对JrDof3 表达的影响
为进一步研究JrDof3基因对渗透胁迫的响应情况,分别对核桃植株进行了NaCl、PEG6000及ABA 处理进行qRT-PCR 分析,检测JrDof3基因在核桃叶中的表达情况。结果显示,JrDof3基因能被NaCl、PEG6000及ABA 胁迫显著诱导。NaCl胁迫下,随着处理时间的延长,JrDof3基因的表达水平逐渐上升,到24 h 为对照的6.56 倍。PEG胁迫下,在3 d 时为对照的7.82 倍,之后随着时间增长,转录水平有所下降,5 d时为对照的4.66倍。ABA 处理下,JrDof3基因的表达值随时间的变化趋势与NaCl 相似,在48 h 达到最大值,为对照的6.08 倍(图3)。表明JrDof3基因具备响应由盐、旱引起的渗透胁迫的潜力,且与ABA 信号相关。

图3 JrDof3 基因在不同处理下的表达水平Fig.3 The expression of JrDof3 gene under different treatments
3 结论与讨论
研究表明,JrDof3基因的ORF 长为873 bp,编码蛋白为30.54 ku,包含291 个氨基酸,理论等电点为9.36。JrDof3 蛋白与QsDof2.4 蛋白具有较高的相似性,可能二者在功能上具有相似性。JrDof3基因启动子包含众多与逆境响应相关顺式作用元件,如DOF、MYB。在NaCl、PEG6000及ABA 处理下,JrDof3基因在不同处理时间具有不同程度的诱导表达水平,体现出JrDof3基因对盐害、干旱的积极响应,同时,JrDof3基因响应逆境受上游启动子调节,并可能与ABA 信号通路相关。这为后续开展核桃抗逆分子机制提供了重要候选基因。
核桃是重要的木本粮油树种,在我国西北、西南及华北等地区广泛种植,具有极高的营养价值和经济价值[28]。高盐、干旱是自然界常见的植物生长胁迫因子,影响植物的生长状况和果实品质,严重时可导致植株死亡。为了适应自然环境中多种逆境胁迫,在长期的进化过程中,植物自身建立起了复杂的调控机制,其中转录因子在植物响应不同逆境胁迫、适应不良环境中发挥着重要的作用[29-30]。因此,筛选核桃抗逆优良基因,研究相关转录因子的作用机理,阐明其功能机制,将有利于推进核桃抗逆优良品种选育及核桃产业科学管理,继而推动核桃产业向更高水平发展。Dof 转录因子对植物的生长发育、开花结实过程起着重要的调控作用,如参与拟南芥光敏色素信号通路[31],调控大豆脂肪酸生物合成途径中相关基因的表达来提高大豆种子的油脂含量[9]。本研究从‘香玲’核桃转录组中克隆获得一条Dof 转录因子家族基因(JrDof3),通过对其启动子包含的顺式作用元件进行分析,发现其启动子包含众多与调控植物生长发育、开花结实相关的顺式作用元件,如光调控相关的GT1CONESENSUS 和INRNTPSADB元件,氧反应相关的CURECORECR 元件,激素响应相关的ARFAT 元件,干旱响应相关的MYCCONSENSUSAT 元件;另外还包括多种逆境响应相关的转录因子识别元件,如MYB 转录子识别相关的BOXLCOREDCPAL、MYB2CONSENSUSAT、MYBCORE 元件,WRKY 转录因子识别相关的WRKY71OS 元件,故可初步推测JrDof3基因参与核桃多种逆境胁迫响应,且可能与不同的激素信号通路相关。
盐、干旱等刺激均易引起植株遭受渗透胁迫,进而影响植株的生理活动。为进一步明确JrDof3基因是否能够积极响应渗透胁迫诱导,对JrDof3基因在盐、干旱胁迫下的表达水平进行分析,发现JrDof3基因能被高水平诱导表达。同时,在ABA 处理下,JrDof3基因的转录水平也得到明显提高。这与其他一些报道相似,如Corrales 等在研究Dof3转录因子在拟南芥植株非生物胁迫和开花发挥多方面作用的过程中,发现Dof3受干旱、极端温度和ABA 胁迫处理高度诱导[15]。在进行干旱及盐胁迫后,胡萝卜Daucus carota的8 个DcDof基因均被不同程度的诱导表达,其中盐胁迫 下DcDof-B1-1、DcDof-D2-1和DcDof-B2-2在胡萝卜叶中的表达水平被上调,而DcDof-C2.1-5在胁迫8 h 内的表达呈下降趋势,8 h 后上升;干旱胁迫0~4 h 内,DcDof-B1-1和DcDof-D2-1基因表达水平呈下降趋势,而DcDof-B2-2呈上升趋势[32]。刘俊等[33]在实验中发现毛竹Phyllostachys edulisPheDof4-1基因响应干旱、盐以及低温胁迫诱导,其中干旱胁迫下该基因在幼茎中的表达被显著诱导而在叶和根中的表达被抑制,盐及低温胁迫下毛竹PheDof4-1在植物中的表达情况相似,均短期内下降然后迅速上升。这些研究表明Dof转录因子响应逆境表达与其逆境调控功能相关。在不同激素处理下的积极转录可推测目的基因的功能涉及潜在的激素信号通路。综合本研究结果可知,JrDof3基因具备响应渗透胁迫的能力,是潜在的调控逆境响应的候选基因,且其功能机制涉及ABA 信号通路。本研究对JrDof3基因的启动子及逆境响应模式进行了分析,是筛选核桃抗逆候选基因的基础研究,对揭示该基因的功能只提供了基础依据,要深入JrDof3基因的功能机制,仍需开展后续的大量研究。在后续研究中将深入分析JrDof3基因响应不同逆境胁迫的功能、下游调控路径及上游调控网络。

