品种、冷冻速率和白藜芦醇对鸡精液冷冻保存效果的影响
喻宗岗 蒋隽 朱立军 姚亚铃 蒲学慧 燕海峰


摘要:【目的】明確品种、冷冻速率和白藜芦醇对鸡精液冷冻保存效果的影响及其互作关系,为解决鸡精液冷冻保存不稳定的困境及加快新品种培育进程提供技术支持。【方法】采集黑丝羽乌骨鸡(简称乌鸡)和黄土二鸡(简称黄鸡)2个品种的公鸡精液,分别添加0、25、50和100 μmol/L白藜芦醇,以二甲基乙酰胺(DMA)为抗冻剂制备细管冻精,在液氮面上1 cm处(高冷冻速率)或3 cm处(低冷冻速率)冷冻,通过冻后精子活力、脂质过氧化水平和线粒体膜电位水平评价鸡精液冻后品质。【结果】黄鸡精液冻后精子活力显著高于乌鸡(P<0.05,下同),但线粒体膜电位水平差异不显著(P>0.05,下同);高冷冻速率下的鸡精液冻后脂质过氧化水平显著低于低冷冻速率,但冻后精子活力和线粒体膜电位水平差异不显著;不同白藜芦醇添加量下,鸡精液冻后精子活力和脂质过氧化水平差异不显著,但线粒体膜电位水平差异显著。双因素组合时,品种×冷冻速率、品种×白藜芦醇和冷冻速率×白藜芦醇间均存在交互作用,其中,乌鸡×高冷冻速率组合的鸡精液冻后脂质过氧化水平显著低于黄鸡×高冷冻速率组合,但冻后精子活力和线粒体膜电位水平无显著差异。三因素组合时,鸡精液冻后脂质过氧化水平最低的组合是乌鸡×低冷冻速率×50 μmol/L白藜芦醇,线粒体膜电位水平最高的组合是乌鸡×低冷冻速率×0 μmol/L白藜芦醇。【结论】鸡精液冷冻保存时其品种、冷冻速率和白藜芦醇间存在二元互作效应或三元互作效应。因此,只有充分考虑鸡品种、冷冻速率和抗氧化剂间的互作效应,才能切实提高鸡冷冻精液的品质。
关键词: 鸡;冷冻精液;品种;冷冻速率;白藜芦醇;互作效应
中图分类号: S831.34 文献标志码: A 文章编号:2095-1191(2020)08-1880-08
Effects of breeding line, freezing rate and resveratrol on chicken semen cryopreservation
YU Zong-gang1,2, JIANG Juan1*, ZHU Li-jun2, YAO Ya-ling3, PU Xue-hui3,
YAN Hai-feng2*
(1College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2Hunan Institute of Animal Husbandry and Veterinary Medicine, Changsha 410131, China; 3Xinhuang Gongxi Yelang Chicken Culture Professional Cooperative, Xinhuang, Hunan 419200, China)
Abstract:【Objective】To clarify the effects of variety, freezing rate and resveratrol on the cryopreservation of chicken semen and their interaction, so as to provide technical support for solving the dilemma of unstable cryopreservation of chicken semen and speeding up the breeding process of new breeds. 【Method】Semen of two breeds, black-feathered black-bone chicken(abbreviated asblack chicken) and yellow two native chicken(abbreviated asyellow chicken), were collected, added with resveratrol at 0, 25, 50 and 100 μmol/L, respectively, and made into thin tube frozen semen with dimethyl acetamide(DMA) as cryoprotectant, which was frozen at 1 cm (high freezing rate) or 3 cm (low freezing rate) on the surface of liquid nitrogen.The quality of frozen semen was evaluated by semen viability, lipid peroxidation level and mitochondrial membrane potential level after freezing. 【Result】The sperm vitality of yellow chicken after semen freezing was significantly higher than that of black chicken(P<0.05,the same below), but there was no significant difference in mitochondrial membrane potential level(P>0.05, the same below). The lipid peroxidation level of chicken semen at high freezing rate was significantly lower than that at low freezing rate, but there was no significant difference in sperm motility and mitochondrial membrane potential level after freezing. Under different resveratrol dosages, there was no significant difference in sperm vitality and lipid peroxidation level after chicken semen freezing, but there was significant difference in mitochondrial membrane potential level.When the two factors were combined, there were interactions among breeds×freezing rate, breeds×resveratrol and freezing rate×resveratrol. The lipid peroxidation level of semen in the combination of black chicken×high freezing rate was significantly lower than that in the combination of yellow chicken×high freezing rate, but there was no significant difference in sperm motility and mitochondrial membrane potential after free-zing. In the combination of three factors, the combination with the lowest lipid peroxidation level after semen freezing was black-bone chicken×low freezing rate×50 μmol/L resveratrol, and the combination with the highest mitochondrial membrane potential level was black-bone chicken×low freezing rate×0 μmol/L resveratrol. 【Conclusion】 There is binary interaction effect or ternary interaction effect among chicken semen variety, freezing rate and resveratrol during cryopreservation. Therefore, only by fully considering the interaction effect among chicken breeds, freezing rate and antioxidants can the quality of chicken frozen semen be effectively improved.
1. 2. 3 白藜芦醇储存液及工作浓度 准确称量0.2282 g白藜芦醇溶于10 mL二甲基亚砜(DMSO)中,制成100 mmol/L的储存液,使用时分别取6、12和24 μL的储存液溶于24 mL的LRD抗冻液中,即获得25、50和100 μmol/L的工作液。
1. 3 试验设计
采用2×2×4(鸡品种×冷冻速率×白藜芦醇)的完全随机设计,将每个品种(乌鸡和黄鸡)采集到的混合精液分成4组,每组3个重复,每组添加不同浓度(0、25、50和100 μmol/L)的白藜芦醇,然后将含不同浓度白藜芦醇的精液细管置于液氮面上不同高度(1和3 cm)进行熏蒸和冷冻,解冻后检测冻后精子活力、脂质过氧化水平和线粒体膜电位水平,以评估冻后精液质量。
1. 4 细管冻精制作
1. 4. 1 精液采集及现场稀释 参照曹江丽(2017)的方法,采集11羽试验公鸡的精液置于集精管中,上下颠倒集精管使其充分混匀,然后以移液器将精液移至已消毒的EP管(100 mL)中,吸取1/2体积基础稀释液进行稀释,并在10 min内将稀释精液带回实验室。
1. 4. 2 鲜精检测与平衡 吸取稀释精液10 μL滴于30 ℃恒温显微镜载物台预热的载玻片上进行精子活力和精液密度判断。乳白色、无粪便污染且精子活力在0.8以上的鲜精用于制作冻精。将2个品种公鸡的混合精液分别分成4等份,置于4 ℃双制冷电子冰箱中平衡30 min。
1. 4. 3 抗冻液添加及平衡 采用稀释精液与抗冻液等体积混合,即精液终稀释比1∶3,然后置于4 ℃双制冷电子冰箱中平衡10 min。参照高亚楠等(2019)建立的鸡精子密度曲线,计算得到乌鸡和黄鸡的精液终密度分别为10.6525×108和13.3140×108个/mL。
1. 4. 4 细管制作、熏蒸、冷冻及保存 参见曹江丽(2017)的方法。
1. 5 细管冻精冻后品质检测
1. 5. 1 冻精解冻及精子活力检测 从液氮中取出的细管迅速置于40 ℃恒温水浴锅中水浴20 s,用细管针从棉塞端将精液推出至已消毒的EP管中,使用移液枪吸取精液10 μL滴于30 ℃恒温显微镜载物台预热的载玻片上,在10倍物镜下进行眼观精子活力判断。
1. 5. 2 脂质过氧化水平检测 采用MDA测试盒测定冻精脂质过氧化水平,其作用原理是过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)结合形成红色产物,在532 nm处有最大吸收峰。MDA含量越高则精液脂质过氧化越严重,精液质量越差。严格按照MDA测试盒说明进行操作,样品管、空白管和标准管均取液0.2 mL,水浴时间50 min,离心力6000 r/min;使用酶标仪测定吸光值,测定波长532 nm。计算公式如下:
MDA含量(nmol/mL)=(OD测定-OD空白/OD标准-OD空白)×10×3
1. 5. 3 线粒体膜电位水平检测 采用线粒体膜电位检测试剂盒检测精子线粒体膜电位水平。JC-1是一种广泛应用于检测线粒体膜电位?Ψm的理想荧光探针,通过荧光颜色的转变即可检测线粒体膜电位水平变化(李秀鹏等,2017)。制样程序按照试剂盒说明进行操作,并对部分步骤进行调整,离心力6000 r/min,洗涤1次。使用全波长扫描式多功能读数仪进行荧光强度测定,设双荧光参数,第一激发波长490 nm,发射波长527 nm;第二激发波长525 nm,发射波长590 nm。最后以第二荧光强度值与第一荧光强度值的比值进行统计分析,红绿荧光比值越高说明精液质量越好。
1. 6 统计分析
试验数据录入Excel 2020进行整理,以SPSS 19.0进行GLM单变量方差分析,若单变量方差分析差异显著则进行LSD和Duncans多重比较。数学模型为:
xijlk=μ+αi+βj+γl+(αβγ)ijl+(αβ)ij+(αγ)il+(βγ)jl+εijlk
式中,μ为总体平均数,α为鸡品种(i=1,2);β为冷冻速率效应(j=1,2),γ为抗氧化剂效应(l=1,2,3,4),αβγ为品种、冷冻速率和抗氧化剂的互作效应,αβ为鸡品种和冷冻速率的互作效应,αγ为鸡品种和抗氧化剂的互作效应,βγ为冷冻速率和抗氧化剂的互作效应,ε为随机误差效应,k为重复数。
2 结果与分析
2. 1 品种、冷冻速率和白藜芦醇对鸡精液冻后品质的影响
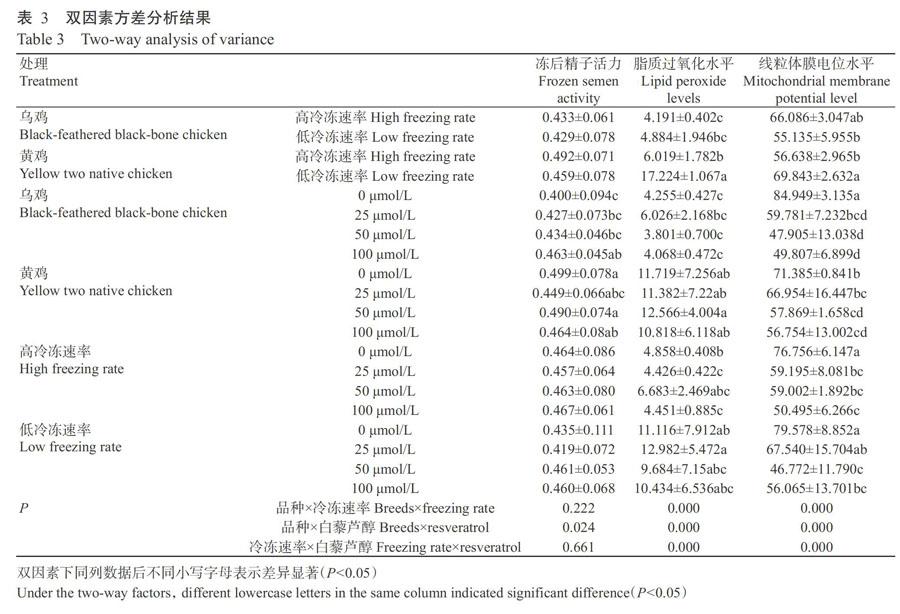
由表2可知,乌鸡和黄鸡的精液冻后精子活力和脂质过氧化水平存在显著差异(P<0.05,下同),均表现为黄鸡显著高于乌鸡,但其线粒体膜电位水平差异不显著(P>0.05,下同);不同冷冻速率下,鸡精液冷冻后脂质过氧化水平差异显著,高冷冻速率下的精液冻后脂质过氧化水平显著低于低冷冻速率,但冻后精子活力和线粒体膜电位水平差异不显著;不同白藜芦醇添加水平下,鸡精液冻后精子活力和脂质过氧化水平差异不显著,但线粒体膜电位水平差异显著,经LSD多重比较分析发现空白组的线粒体膜电位水平显著高于各白藜芦醇添加组,且25 μmol/L处理组显著高于50和100 μmol/L处理组。
2. 2 品种、冷冻速率和白藜芦醇两两组合对鸡精液冻后品质的影响
由表3可知,不同品种的鸡精液冻后精子活力均表现为高冷冻速率处理高于低冷冻速率处理,而脂质过氧化水平表现为高冷冻速率处理低于低冷冻速率处理。相同冷冻速率下黄雞精液冻后脂质过氧化水平均显著高于乌鸡;高冷冻速率下乌鸡精液冻后线粒体膜电位水平高于黄鸡,低冷冻速率下则乌鸡精液冻后线粒体膜电位水平显著低于黄鸡。随白藜芦醇添加量的增加,乌鸡精液冻后精子活力不断升高,而脂质过氧化水平呈升高—降低—升高的变化趋势,黄鸡精液冻后精子活力和脂质过氧化水平均呈降低—升高—降低的变化趋势;鸡精液冻后线粒体膜电位水平整体上随白藜芦醇添加量的增加而降低。不同冷冻速率下,鸡精液冻后精子活力整体上随白藜芦醇添加量的增加呈先降低后升高的变化趋势;高冷冻速率下鸡精液冻后脂质过氧化水平随白藜芦醇添加量的增加呈降低—升高—降低的变化趋势,而低冷冻速率下的变化趋势与高冷冻速率下的恰好相反;鸡精液冻后线粒体膜电位水平整体上随白藜芦醇添加量的增加呈降低趋势。
差异显著性检验结果显示,鸡精液冻后精子活力在品种×白藜芦醇互作时差异显著,但在其他两种组合互作时差异不显著;脂质过氧化水平和线粒体膜电位水平在品种、冷冻速率和白藜芦醇的双因素组合互作中均差异显著。
2. 3 品种、冷冻速率和白藜芦醇三因素组合对鸡精液冻后品质的影响
由表4可知,高冷冻速率下乌鸡精液冻后精子活力随白藜芦醇添加量的增加呈升高—降低—升高的变化趋势,脂质过氧化水平的变化趋势恰好相反,呈降低—升高—降低的变化趋势,而线粒体膜电位水平呈逐渐降低趋势;低冷冻速率下乌鸡精液冻后精子活力随白藜芦醇添加量的增加而逐渐升高,脂质过氧化水平呈升高—降低—升高的变化趋势,线粒体膜电位水平则呈先降低再升高的变化趋势。高冷冻速率下黄鸡精液冻后精子活力、脂质过氧化水平及线粒体膜电位水平均随白藜芦醇添加量的增加而呈降低—升高—降低的变化趋势;低冷冻速率下黄鸡精液冻后精子活力也随白藜芦醇添加量的增加呈降低—升高—降低的变化趋势,脂质过氧化水平整体上呈逐渐降低趋势,线粒体膜电位水平则呈升高—降低—升高的变化趋势。
三因素互作分析结果显示,各组合间的鸡精液冻后精子活力差异不显著,但脂质过氧化水平和线粒体膜电位水平差异极显著(P<0.01)。Duncan?s多重比较分析结果表明,鸡精液冻后脂质过氧化水平最低的组合是乌鸡×低冷冻速率×50 μmol/L白藜芦醇,线粒体膜电位水平最高的组合是乌鸡×低冷冻速率×0 μmol/L白藜芦醇,即乌鸡精液在低冷冻速率下添加低剂量白藜芦醇可获得较好的冷冻效果。
3 讨论
3. 1 鸡冷冻精液品质影响因素
精液冻存是利用生物的休眠原理,但降温产生的冰晶会对精子细胞产生理化损伤。冷冻速率决定冰晶形成的大小,一般是通过改变精液在液氮面上的熏蒸距离来实现冷冻速率调控,不同学者采用的熏蒸距离也各不相同。Long等(2014)采用1.25 cm,Kowalczyk和Lukaszewicz(2015)采用2 cm,Mosca等(2016)采用3 cm,Longobardi等(2017a)采用4 cm,Mameddu等(2016)采用5 cm,Abouelezz等(2017)采用7 cm,Chuaychu-Noo等(2017)采用11 cm。不同冷冻速率通过胞内外化学势能平衡来决定冰晶形成的大小,进而控制对精子的损伤程度(喻宗岗等,2019)。本研究结果表明,高冷冻速率(液氮面上1 cm)能更好地保护鸡冷冻精液,获得较低的脂质过氧化水平。公鸡生殖系统由于缺乏副性腺分泌的糖类及柠檬酸等物质,因此鸡精液中缺少维持供能物质,且精子膜含有大量多不饱和脂肪酸,在体外制作冻精过程中接触ROS的概率明显增加,更易被氧化(喻宗岗等,2019)。
已有大量研究表明,改变冷冻速率并向精液中添加抗氧化物可有效提高冻精品质。在人类(Garcez et al.,2010;Nashtaei et al.,2018)及鼠(Silva et al.,2012)、羊(Silva et al.,2014)、猪(王昕,2015)和水牛(Longobardi et al.,2017b)的精液基础稀释液中添加白藜芦醇,其平均冻精活力与鲜精活力无显著差异。本研究结果也表明,在不同白藜芦醇添加水平(0~100 μmol/L)下,鸡精液冻后精子活力和脂质过氧化水平差异不显著,但线粒体膜电位水平差异显著,且整体上随白藜芦醇添加量的增加呈降低趋势,与李世佳等(2018)在人類冻精中的研究结果存在差异,究其原因可能是哺乳动物与鸟类生殖系统的差异所致。白藜芦醇的有效抗氧化成分是亲脂性非黄酮类多酚化合物,其通过防止和清除ROS而发挥抗氧化作用。在本研究中,由于冷冻速率与白藜芦醇间存在互作效应,使用单因素分析不足以解释其互作效应,因此对各因素水平进行Duncan?s多重比较,结果显示高冷冻速率下添加25 μmol/L白藜芦醇的鸡精液冻后脂质过氧化水平最低。
Feyisa等(2017)研究发现地方种鸡的精液抗冻性存在明显差异。本研究结果表明,黄鸡精液冻后精子活力显著高于乌鸡,但脂质过氧化水平也显著高于乌鸡。此外,本研究首次发现品种、冷冻速率和抗氧化剂间存在互作效应,Duncan?s多重比较分析结果表明,在品种×冷冻速率组合中,平均冻后精子活力最高、脂质过氧化水平最低及线粒体膜电位水平最高的组合分别是黄鸡×高冷冻速率、乌鸡×高冷冻速率和黄鸡×低冷冻速率,其原因可能是不同品种公鸡的精液组分种类和含量存在差异,且不同冷冻速率下精液降温速度不同,导致精液中形成的冰晶数量和大小也不同,差异化的精子损伤程度致使精液冻后品质不同。在品种×白藜芦醇组合中,平均冻后精子活力最高、脂质过氧化水平最低及线粒体膜电位水平最高的组合分别是黄鸡×0 μmol/L白藜芦醇、乌鸡×50 μmol/L白藜芦醇和乌鸡×0 μmol/L白藜芦醇,可能是不同品种公鸡的精液组分种类和含量差异导致白藜芦醇渗透效率不同,而导致白藜芦醇的抗氧化活性存在差异。在冷冻速率×白藜芦醇组合中,脂质过氧化水平最低及线粒体膜电位水平最高的组合分别是高冷冻速率×25 μmol/L白藜芦醇和低冷冻速率×0 μmol/L白藜芦醇。不同冷冻速率下相同白藜芦醇浓度与同一冷冻速率下不同白藜芦醇浓度的渗透和交换效率均不同,导致精液中形成的冰晶及白藜芦醇的抗氧化活性存在差异,最终影响冷冻精液品质。在品种×冷冻速率×白藜芦醇组合中,脂质过氧化水平最低及线粒体膜电位水平最高的组合分别是乌鸡×低冷冻速率×50 μmol/L白藜芦醇和乌鸡×低冷冻速率×0 μmol/L白藜芦醇,是白藜芦醇浓度决定抗氧化活性、冷冻速率决定冰晶大小和数量、品种决定鸡精液组分含量和种类,共同影响精液抗冻性的结果。
3. 2 鸡冷冻精液品质评定标准
冻后精子活力是评价冷冻精液品质的重要指标之一,冻后精子活力高低直接影响其受精能力。眼观活力由于便捷而被广泛应用,但其准确性依赖于检测人员的经验,且精子活力是一种较综合的表观体现,无法观察到精子的超微结构变化及具体损伤部位。本研究结果表明,不同品种间的鸡精液冻后精子活力差异显著,与Feyisa等(2017)的研究结果一致,且品种×白藜芦醇互作的冻后精子活力也存在显著差异。鸡精子膜上含有大量多不饱和脂肪酸,极易被ROS氧化而发生脂质过氧化反应。因此,通过脂质过氧化水平检测可进一步评定冷冻后的鸡精液品质。MDA是脂质过氧化反应的终产物,能间接反映精子的氧化损伤程度(王捷等,2018)。本研究结果表明,品种、冷冻速率、品种×冷冻速率互作、品种×白藜芦醇互作、冷冻速率×白藜芦醇互作及品种×冷冻速率×白藜芦醇互作均显著影响鸡冷冻精液的脂质过氧化水平。
线粒体是细胞中制造能量的重要结构,其功能完整性决定着细胞的正常生理状态,而膜电位水平可直接反映精子的获能状态。线粒体膜电位水平下降是细胞凋亡的早期信号(Bollwein et al.,2008),因此,通过线粒体膜电位水平检测即可获知精子的损伤程度。本研究发现,白藜芦醇、品种×冷冻速率互作、品种×白藜芦醇互作、冷冻速率×白藜芦醇互作及品种×冷冻速率×白藜芦醇互作均显著影响鸡冷冻精液的线粒体膜电位水平。此外,本研究选取综合平衡法来确定最佳组合,通过极差确定因素的主次关系(品种>白藜芦醇>冷冻速率),并按因素主次选取较优组合,最终确定乌鸡精液在低冷冻速率下添加低剂量白藜芦醇即可获得较好的冷冻效果。
4 结论
鸡精液冷冻保存时其品种、冷冻速率和白藜芦醇间存在二元互作效应或三元互作效应。因此,只有充分考虑鸡品种、冷冻速率和抗氧化剂间的互作效应,才能切实提高鸡冷冻精液的品质。
参考文献:
曹江丽. 2017. 以DMA为冷冻保护剂的鸡精液颗粒与细管冷冻技术的研究[D]. 长沙:湖南农业大学. [Cao J L. 2017. Study on the chicken freezing semen by pellets and straws using DMA as cryoprotectants[D]. Changsha:Hunan Agricultural University.]
高亚楠,喻宗岗,李闯,姚亚铃,蒲学慧,燕海峰. 2019. 手持密度仪检测鸡与鸭精子密度技术的研究[J]. 激光生物学报,28(2):168-177. [Gao Y N,Yu Z G,Li C,Yao Y L,Pu X H,Yan H F. 2019. A study on the methods of detecting the density of roosters and drakes sperm by using hand density mrter[J]. Acta Laser Biology Sinica,28(2):168-177.]
李世佳,苏卫东,邱丽君,王雄,刘娟. 2018. 白藜芦醇对人精子冷冻损伤的保护作用[J]. 中华男科学杂志,24(6):499-503. [Li S J,Su W D,Qiu L J,Wang X,Liu J. 2018. Resveratrol protects human sperm against cryopreservation-induced injury[J]. National Journal of Andrology,24(6):499-503.]
李秀鹏,李兴爽,史文姝,盛宇,金一. 2017. CLC对冷休克和冻融猪精子活力及线粒体膜电位的影响[J]. 中国兽医学报,37(1):168-171. [Li X P,Li X S,Shi W S,Sheng Y,Jin Y. 2017. Effects of CLC on sperm motility and mitochondrial membrane potential in cold shock and frozen thawed pig sperm[J]. Chinese Journal of Veterinary Scien-ce,37(1):168-171.]
王捷,耿果霞,楊丽,徐德军,陈华丽,苟清碧,裴一飞,吴琳,李青旺. 2018. 芝麻酚对猪精液冷冻保存效果的影响[J]. 家畜生态学报,39(6):57-61. [Wang J,Geng G X,Yang L,Xu D J,Chen H L,Gou Q B,Pei Y F,Wu L,Li Q W. 2018. Effect of sesamol on cryopreservation of boar spermatozoa[J]. Journal of Ecologiae Animalis Domastici,39(6):57-61.]
王昕. 2015. 白藜芦醇对猪冷冻精子细胞凋亡及凋亡途径的影响[D]. 上海:上海海洋大学. [Wang X. 2015. Effects of resveratrol on apoptosis and apoptotic pathways of frozen boar spermatozaoa[D]. Shanghai:Shanghai Ocean University.]
喻宗岗,蒋隽,燕海峰,谢农村. 2019. 畜禽精液冷冻损伤保护研究进展[J]. 中国畜牧杂志,55(2):33-38. [Yu Z G,Jiang J,Yan H F,Xie N C. 2019. Research progress on frozen damage protection of semen in livestock and poultry[J]. Chinese Journal of Animal Science,55(2):33-38.]
Abouelezz F M K,Sayed M A M,Santiago-Moreno J. 2017. Fertility disturbances of dimethylacetamide and glycerol in rooster sperm diluents:Discrimination among effects produced pre and post freezing-thawing process[J]. Animal reproduction science,184(9):228-234.
Baur J A,Sinclair D A. 2006. Therapeutic potential of resveratrol:The in vivo evidence[J]. Nature Reviews. Drug Discovery,5(6):493-506.
Bollwein H,Fuchs I,Koess C. 2008. Interrelationship between plasma membrane integrity, mitochondrial membrane potential and DNA fragmentation in cryopreserved bovine spermatozoa[J]. Reproduction in Domestic Animals,43(2):189-195.
Bucak M N,Ataman M B,Ba?pinar N,Uysal O,Ta?pinar M,Bilgili A,?ztürk C,Güngor ?,Inan? M E,Akal E. 2015. Lycopene and resveratrol improve post-thaw bull sperm parameters: Sperm motility, mitochondrial activity and DNA integrity[J]. Andrologia,47(5):545-552.
Chuaychu-Noo N,Thananurak P,Chankitisakul V,Vongpralub T. 2017. Supplementing rooster sperm with Choleste-rol-Loaded-Cyclodextrin improves fertility after cryopreser-vation[J]. Cryobiology,74:8-12.
Dolinsky V W,Chan A Y M,Frayne I R,Light P E,Rosiera D C,Dyck J R B. 2009. Resveratrol prevents the prohypertrophic effects of oxidative stress on LKB1[J]. Circulation,119(12):1643-1652.
Fattah A,Sharafi M,Masoudi R,Shahverdi A,Esmaeili V,Najafi A. 2017. L-Carnitine in rooster semen cryopreservation:Flow cytometric,biochemical and motion findings for frozen-thawed sperm[J]. Cryobiology,74:148-153.
Feyisa S G,Park Y H,Kim Y M,Lee B R,Jung K M,Choi S B,Cho C Y,Han J Y. 2017. Morphological defects of sperm and their association with motility,fertility,and hatchability in four Korean native chicken breeds[J]. Asian-Australasian Journal of Animal Sciences,31(8):1160-1168.
Frémont L. 2000. Biological effects of resveratrol[J]. Life Scien-ces,66(8):663-673.
Garcez M E,Branco C D S,Lara L V,Pasqualotto F F,Salvador M. 2010. Effects of resveratrol supplementation on cryopreservation medium of human semen[J]. Fertility and Sterility,94(6):2118-2121.
Kowalczyk A,Lukaszewicz E. 2015. Simple and effective methods of freezing capercaillie(Tetrao urogallus L.) semen[J]. PLoS One,10(1):e0116797.
Long J A,Purdy P H,Zuidberg K,Hiemstra S J,Velleman S G,Woelders H. 2014. Cryopreservation of turkey semen:Effect of breeding line and freezing method on post-thaw sperm quality,fertilization,and hatching[J]. Cryobiology,68(3):371-378.
Longobardi V,Salzano A,Campanile G,Marrone R,Palumbo F,Vitiello M,Zullo G,Gasparrini B. 2017a. Carnitine supplementation decreases capacitation-like changes of frozen-thawed buffalo spermatozoa[J]. Theriogenology,88:236-243.
Longobardi V,Zullo G,Salzano A,de Canditiis C,Cammarano A,de Luise L,Puzio M V,Neglia G,Gasparrini B. 2017b. Resveratrol prevents capacitation-like changes and improves in vitro fertilizing capability of buffalo frozen-thawed sperm[J]. Theriogenology,88:1-8.
Madeddu M,Mosca F,Abdel S A,Zaniboni L,Mangiagalli M,Colombo E,Cerolini S. 2016. Effect of cooling rate on the survival of cryopreserved rooster sperm:Comparison of different distances in the vapor above the surface of the liquid nitrogen[J]. Animal Reproduction Science, 171:58-64.
Moghbeli M,Kohram H,Zare-Shahaneh A,Zhandi M,Sharideh H,Sharafi M. 2016. Effect of sperm concentration on characteristics and fertilization capacity of rooster sperm frozen in the presence of the antioxidants catalase and vitamin E[J]. Theriogenology,86(6):1393-1398.
Mosca F,Madeddu M,Sayed A A,Zaniboni L,Iaffaldano N,Cerolini S. 2016. Combined effect of permeant and non-permeant cryoprotectants on the quality of frozen/thawed chicken sperm[J]. Cryobiology,73(3):343-347.
Najafi A,Najafi M H,Zanganeh Z,Sharafi M,Martinez-Pastor F,Adeldust H. 2014. Cryopreservation of ram semen in extenders containing soybean lecithin as cryoprotectant and hyaluronic acid as antioxidant[J]. Reproduction in Domestic Animals,49(6):934-940.
Nashtaei S M,Nekoonam S,Naji M,Bakhshalizadeh S,Amidi F. 2018. Cryoprotective effect of resveratrol on DNA damage and crucial human sperm messenger RNAs,possibly through 5' AMP-activated protein kinase activation[J]. Cell and Tissue Banking,19(1):87-95.
O'Flaherty C. 2014. Peroxiredoxins:Hidden players in the antioxidant defence of human spermatozoa[J]. Basic and Clinical Andrology,24:4. doi:10.1186/2051-4190-24-4.
Ourique G M,Pês T S,Saccol E M H,Finamor I A,Glanzner W G,Baldisserotto B,Pavanato M A,Gon?alves P B D,Barreto K P. 2016. Resveratrol prevents oxidative da-mage and loss of sperm motility induced by long-term treatment with valproic acid in Wistar rats[J]. Experimental and Toxicologic Pathology,68(8):435-443.
Parks J E,Lynch D V. 1992. Lipid composition and thermotropic phase behavior of boar,bull,stallion,and rooster sperm membranes[J]. Cryobiology,29(2):255-266.
Partyka A,Lukaszewicz E,Ni?ański W. 2012. Effect of cryopreservation on sperm parameters,lipid peroxidation and antioxidant enzymes activity in fowl semen[J]. Theriogenology,77(8):1497-1504.
Partyka A,Rodak O,Bajzert J,Kochan J,Ni?ański W. 2017. The effect of L-carnitine,hypotaurine,and taurine supplementation on the quality of cryopreserved chicken semen[J]. BioMed Research International. doi:10.1155/2017/7279341.
Sharafi M,Zhandi M,Shahverdi A,Shakeri M. 2015. Beneficial effects of nitric oxide induced mild oxidative stress on post-thawed bull semen quality[J]. International Journal of Fertility & Sterility,9(2):230-237.

