甲基萘醌-4对少突胶质细胞缺氧性损伤的保护作用*
杨日云 潘静莹 李 奕 吴 坚 王晓冬
(南通大学医学院组织学与胚胎学教研室,南通 226001)
少突胶质细胞是中枢神经系统有髓神经纤维髓鞘的形成细胞和脑白质的重要组成细胞,其损伤与多种疾病有关。少突胶质细胞和神经元一样对缺氧极为敏感,缺氧诱导的少突胶质细胞损伤是导致新生儿脑白质损伤的最主要原因[1]。甲基萘醌-4(menaquinone-4,MK-4)是维生素K2(vitamin K2,VK2)的一种亚型,在除肝以外的器官中,VK2 可被转换成MK-4[2-3]。同时,MK-4 是脑中维生素K 主要活性形式[4]。有研究表明,MK-4 可以促进胚胎后期大脑皮质、海马和纹状体的神经元存活[5],抑制脂多糖诱导的小胶质细胞炎症反应[6],降低发育中胚胎皮质神经元和少突胶质前体细胞因谷胱甘肽或花生四烯酸诱导的氧化应激损伤[7-8]。这些研究表明MK-4 在抗氧化应激和抗炎中起到一定作用。本研究通过低氧工作站体外模拟体内细胞真实的缺氧环境,探讨MK-4 对缺氧少突胶质细胞的作用及其机制,为临床上防治和治疗缺氧导致的中枢神经系统疾病提供帮助。
1 材料和方法
1.1 细胞与试剂
大鼠少突胶质细胞Oln-93细胞株购于北京中科质检生物技术有限公司。MK-4 (河北科隆多生物科技有限公司) 溶解于二甲基亚砜(dimethyl sulfoxide,DMSO) (Sigma),储存 浓度为224.9 mmol/L,避光保存于-20℃。CCK-8试剂盒(日本同仁);二氯二氢荧光素-乙酰乙酸酯(2’,7’-Dichlorofluorescin diacetate,DCF-DA)、胰酶、多聚赖氨酸 (Sigma);DMEM-F12培养基 (Thermo);胎牛血清(Gibco);青霉素-链霉素溶液(生工);TRI Reagnet(Sigma);逆转录试剂盒(Thermo);SYBR Green PCR Kit (QIAGEN)。
1.2 细胞培养和缺氧模型的建立
Oln-93 细胞培养在含有10%的胎牛血清的高糖DMEM-F12 培养基中,待细胞长满进行传代。将Oln-93 细胞接种于培养板,分为正常氧含量组和缺氧组。正常氧含量组用含10%FBS 的DMEM-F12 培养基,置于5% CO2/95% 空气、37℃的培养箱中。缺氧组采用DWS H35 低氧工作站(5% CO2/95% N2,37℃)加无糖无血清的培养条件建立缺氧少突胶质细胞模型,分别缺氧4 、6 、12 h。
1.3 CCK-8 细胞活性检测
Oln-93 细胞以每孔104细胞接种于96 孔板,每孔100 μL 细胞悬液,置于培养箱。次日,细胞分为正常氧含量组和缺氧组,并换成相应的培养基;在培养基中加入0.01% DMSO 或者1、2、4、8、15 μmol/L 的MK-4,预处理细胞20 min;接着将细胞置于正常氧含量培养箱或低氧工作站,分别培养4、6、12 h。终止孵育,每孔加入10 μL CCK-8溶液,培养箱内孵育2 h。用Tecan M200 酶标仪测定在450 nm 处各孔的吸光度。每种浓度设置3 个复孔,实验重复3 次。
1.4 二氢乙锭染色
Oln-93细胞接种于24孔板,用二氢乙锭染色检测细胞内线粒体释放活性氧 (radical oxygen species,ROS) 的量。用0.01% DMSO或者8 μmol/L MK-4预处理细胞,分别正常氧含量或缺氧孵育12 h。PBS 清洗细胞3 遍,每遍15 min。每孔加入50 μmol/L 二氢乙锭,避光37℃ 孵育30 min。采用激发光/激发光为485 nm/535 nm 共聚焦显微镜拍片。利用Image J 软件计算单位面积平均荧光强度,统计比较正常氧含量组和缺氧组之间差异。实验重复3 次,每组统计30 个细胞。
1.5 炎症因子mRNA 的表达变化的检测
0.01% DMSO或者8 μmol/L MK-4 预处理细胞20 min 后,分别正常氧或缺氧孵育12 h。用TRI Reagnet 提取各实验组细胞的总RNA,用逆转录试剂盒合成cDNA。利用Primer 3 software version 1.0设计白介素-1 beta (interleukin-1 beta,IL-1β),白介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-alpha(tumor necrosis factor alpha,TNF-α),生长停滞特异性蛋白6 (growth arrest-specific 6,Gas6)基因和β-actin 的引物(表1)。

表1 实时荧光定量PCR 引物序列Tab 1 Primer sequences in the real-time quantitative PCR
按照SYBR Green PCR Kit 说明书建立PCR 反应体系,实时荧光定量PCR 反应在Bio-rad CFX96 real time system 上进行。
1.6 统计学处理
利用Prism 6.0 软件进行统计学分析,数据以±s表示,采用实时荧光定量ANOVA 分析,每组实验独立重复3 次或以上。
2 结果
2.1 MK-4 对缺氧Oln-93 细胞活性的影响
为探究在缺氧环境下MK-4 对Oln-93 细胞活性的影响,采用不同MK-4 浓度和3 个缺氧时间点对Oln-93 细胞进行CCK-8 实验。结果显示:DMSO处理的Oln-93 细胞在分别缺氧4、6 h 和12 h 后,与DMSO 处理正常氧含量组相比细胞活性均显著下降(图1)。但当用2、4、8 μmol/L MK-4 处理后,缺氧4 h 的Oln-93 细胞活性相较于DMSO 处理缺氧组则显著提高 (图1A)。MK-4 浓度在2、4、8、15 μmol/L 时可显著提高缺氧6 h 和12 h Oln-93 细胞的活性(图 1B、C)。因此,2、4、8 μmol/L 浓度的MK-4 对缺氧Oln-93 细胞活性有显著提高作用。综合实验结果,缺氧12 h 对Oln-93 细胞的损伤最大,且8 μmol/L MK-4 提高细胞的活性最显著,因此选择8 μmol/L MK-4 和缺氧12 h 进行后续研究。
2.2 MK-4 降低缺氧Oln-93 细胞内ROS 的产生
缺氧会影响线粒体功能[9],为探究MK-4 对缺氧Oln-93 细胞线粒体功能的影响,采用二氢乙锭染色,检测线粒体释放ROS 的含量。细胞染色荧光强度与胞内ROS 含量呈正相关,荧光强度越高,则胞内ROS 含量越高。与DMSO 处理正常氧含量组相比,DMSO处理的大鼠Oln-93细胞在缺氧12 h后,胞内红色荧光强度显著增强;当8 μmol/L MK-4处理后,缺氧细胞内荧光强度对比加入DMSO 的缺氧组明显减弱(图2)。上述结果表明缺氧可以影响Oln-93 细胞线粒体功能,进而导致胞内ROS的大量释放,但MK-4 可以明显降低缺氧Oln-93细胞内ROS 的产生,进而达到保护细胞线粒体的作用。

图1 MK-4 对缺氧Oln-93 细胞活力的影响Fig 1 Effects of MK-4 on the viability of hypoxic Oln-93 cells
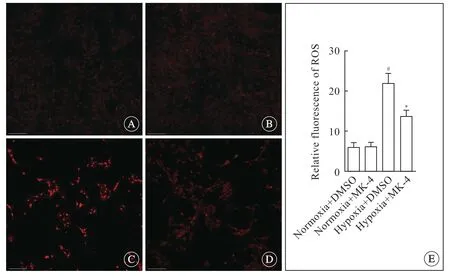
图2 MK-4 对缺氧Oln-93 细胞ROS 产生的影响,共聚焦显微镜,标尺=50 μmFig 2 Effects of MK-4 on ROS production of hypoxic Oln-93 cells,confocal microscope,bar=50 μm
2.3 MK-4 抑制缺氧Oln-93 细胞内促炎症因子的表达
缺氧能够诱导炎症反应[10-11];同时,线粒体在炎症的发生和发展中起重要作用,ROS 的大量产生可以导致炎症[12]。既然MK-4 可以降低缺氧Oln-93 细胞线粒体ROS 的产生,那MK-4 是否参与缺氧Oln-93 细胞的炎症反应。结果当DMSO 处理的Oln-93 细胞缺氧12 h 后,胞内促炎细胞因子IL-1β、IL-6、TNF-α 的mRNA 水平相较于DMSO处理正常氧含量组则明显升高;但当用8 μmol/L MK-4 处理后,缺氧细胞内IL-1β、IL-6、TNF-α 的mRNA 水平相较于DMSO 处理缺氧组则明显降低(图3A~C)。以上结果表明,缺氧可以导致Oln-93 细胞内促炎因子的表达增加,引起细胞的炎症,但MK-4 可以有效降低缺氧引起的Oln-93 细胞炎症反应,进而达到保护细胞的作用。
2.4 MK-4 提高Oln-93 细胞内Gas6 基因的表达
Gas6 是维生素K 依赖蛋白,影响线粒体功能[13],且可以抑制促炎细胞因子的表达[14]。既然MK-4 抑制缺氧Oln-93 细胞的ROS 产生和炎症反应,那么Gas6 是否在其中充当重要角色。DMSO处理的Oln-93 细胞缺氧12 h 后,胞内Gas6 基因的mRNA 水平相较于DMSO 处理的正常氧含量组则明显降低;但当8 μmol/L MK-4 处理后,缺氧细胞内Gas6 基因的mRNA 水平相较于DMSO 处理缺氧组则明显升高(图4)。以上结果表明,缺氧会降低Oln-93 细胞内Gas6 的含量,但MK-4 却可以显著提高缺氧Oln-93 细胞内Gas6 的表达。综合之前的实验结果,推测Gas6 可能参与了MK-4 对缺氧Oln-93 细胞的保护作用。
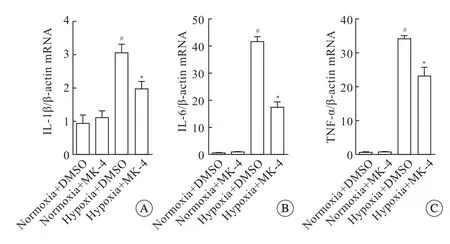
图3 MK-4 对缺氧Oln-93 细胞促炎症因子mRNA 表达的影响Fig 3 Effects of MK-4 on pro-inflammatory cytokine mRNA expression in Oln-93 cells
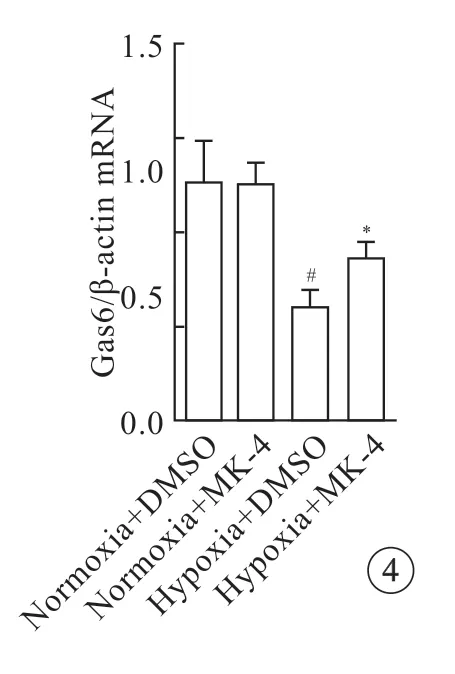
图4 MK-4 对缺氧大鼠Oln-93 细胞Gas6 mRNA 表达的影响Fig 4 Effects of MK-4 on Gas6 mRNA expression in Oln-93 cells
3 讨论
胶质细胞是神经系统中除神经元以外的另一大类细胞,其在神经系统中起重要作用。胶质细胞参与神经元的活动,对神经元具有支持、保护、营养、形成髓鞘和修复等多种功能,并且对多种中枢神经系统疾病的发生起重要作用[15]。中枢神经系统中的胶质细胞主要有星形胶质细胞、少突胶质细胞和小胶质细胞等,其中少突胶质细胞形成中枢神经系统髓鞘和组成脑白质。少突胶质细胞对缺氧高度敏感,新生的大鼠缺氧会造成白质少突胶质细胞衰竭和阻碍有髓神经纤维髓鞘的形成[16]。新生儿脑白质损伤与脑性瘫痪、智力低下等密切相关,其重要原因就是缺氧导致脑白质主要成分少突胶质细胞受损[17]。因此,研究少突胶质细胞的缺氧损伤机制和寻找缺氧少突胶质细胞的保护剂将会对脑白质损伤、脱髓鞘脑病等中枢神经系统缺氧性损伤具有重要意义。本研究区别以往常用的化学法缺氧模型,创新性地利用低氧工作站构建少突胶质细胞缺氧模型,更加真实模拟体内缺氧环境。
MK-4 又称为VK2,临床上MK-4 主要用于治疗和预防血管钙化、出血症、骨质疏松症、肝硬化发展成肝癌和帕金森病等[18-19]。MK-4 在鞘脂类的合成代谢中起重要作用,而鞘脂又与细胞增殖、分化和细胞间相互作用等多种细胞活动密切相关,进而影响神经系统的功能[20-21]。研究表明,MK-4 在大鼠脑中主要分布于有髓部分(脑桥、髓质、中脑)[22]。MK-4 可以作为线粒体电子载体保护受损线粒体的功能,维持正常ATP 产生[23]。MK-4 可以保护少突胶质前体细胞和未成熟神经元由于谷胱甘肽缺乏所引起的氧化应激损伤[7]。在由花生四烯酸诱导的少突胶质前体细胞的氧化应激损伤中,MK-4 可以有效抑制ROS 的积累,进而降低了细胞死亡率[8]。MK-4 可以通过抑制由脂多糖诱导的单核巨噬细胞NFκB 激活和IKKα/β 的磷酸化,进而抑制细胞内促炎因子IL-6 的表达[24]。综上所述,MK-4 在中枢神经系统中主要分布于髓鞘,并且其在维持线粒体功能、抗氧化应激和抗炎症中均表现出重要作用;因此需要更多研究MK-4 在与髓鞘形成相关细胞中所发挥的关键作用,为MK-4 在临床上的进一步应用提供理论基础。本研究主要探究了MK-4在缺氧少突胶质细胞中的作用,研究表明MK-4 可以有效抑制环境缺氧导致的少突胶质细胞线粒体ROS 的释放,并且首次发现MK-4 可以通过抑制促炎细胞因子的表达来降低缺氧少突胶质细胞的炎症反应,进而抑制了缺氧导致的少突胶质细胞死亡。那么MK-4 保护缺氧少突胶质细胞的作用是通过何种分子机制实现?
Gas6 是一种维生素K 依赖蛋白,其在大鼠的中枢神经系统中广泛表达[25]。已有研究表明,Gas6 在神经元和胶质细胞中表现出促细胞存活、抗凋亡、促有丝分裂和促髓鞘形成的作用[4]。Gas6可以通过激活PI3K 信号通路来保护少突胶质细胞由TNF-α 诱导的细胞凋亡[26-27]。在多发性硬化症模型中,Gas6 基因敲除的纯合子小鼠相较于野生型小鼠存在更低的少突胶质细胞存活率,以及更多的细胞丢失和整体上髓鞘形成的减少[28]。减数分裂Ⅱ期卵母细胞的Gas6 基因敲除会导致其线粒体过度激活,引起ROS 的大量产生,进而损害卵母细胞细胞质的成熟[13]。研究表明,Gas6 可以抑制小鼠小胶质细胞因LPS 诱导的促炎因子IL-1β 的表达,进而降低细胞的炎症反应[29]。本研究结果显示缺氧可以导致少突胶质细胞内Gas6 的基因表达降低,但当用MK-4 预处理细胞后,缺氧少突胶质细胞内Gas6 的基因表达显著升高。综上所述,Gas6 具有促进细胞存活、调节线粒体ROS 的产生和调节中枢神经系统炎症反应的作用,推测在本研究中MK-4 可能是通过调节缺氧少突胶质细胞内Gas6 的表达,进而保护细胞的线粒体功能,减少线粒体ROS 产生和降低细胞的炎症反应,最终保护了缺氧少突胶质,提高其存活率。
本研究主要探讨了MK-4 在缺氧少突胶质细胞中的作用。研究结果显示缺氧可以导致少突胶质细胞大量死亡,且此作用可能是通过线粒体大量释放ROS 和促炎细胞因子大量表达而引起的;但MK-4却可以改善因缺氧导致的少突胶质细胞内ROS 释放和促炎因子表达的紊乱,进而起到了保护细胞的作用。本研究提示Gas6 可能在MK-4 发挥作用的过程中扮演重要角色,为临床上防治中枢神经系统缺氧性疾病和MK-4 更广泛地应用提供理论支持。

