伴Graves病的青年人中的成人发病型糖尿病1例
彭少林,杨水冰,陆小玉,张美彪*
(1.怀化市第一人民医院内分泌代谢科,湖南 怀化 418000;2.国家代谢性疾病临床医学研究中心怀化分中心,湖南 怀化 418000;3.国家标准化代谢性疾病管理中心怀化分中心,湖南 怀化 418000)
1 病例资料
患者,女,25岁,因“多尿、体重下降2年,恶心、呕吐2天”入院。2年前患者无明显诱因下出现多尿、体重下降,在外院诊断为“2型糖尿病”,予以口服降糖药物治疗(具体不详),期间未规律用药及监测血糖。入院前2天患者受凉后出现恶心、呕吐,呕吐胃内容物。既往体健。有“糖尿病”家族史,否认“甲状腺疾病”家族史。体格检查:身高157 cm,体重51 kg。神志清楚,无突眼症。甲状腺Ⅱ度肿大,质软,无压痛,未闻及血管杂音。心率90次/分,律齐,未闻及杂音。腹平软,振水音阳性。肠鸣音4次/分。未见黑棘皮征。入院后检查:血糖、糖化血红蛋白高,胰岛素及C肽偏低,血酮体0.12 mmol/L(参考值范围0~0.28 mmol/L)。抗谷氨酸脱羧酶抗体、抗酪氨酸磷酸酶抗体、抗胰岛素抗体、抗胰岛细胞自身抗体均阴性,肝肾功能均正常。促甲状腺激素偏低,游离三碘甲状腺原氨酸及游离甲状腺素升高,甲状腺过氧化物酶抗体、促甲状腺激素受体抗体均升高,血清钾、钠、氯降低(表1)。甲状腺放射性核素扫描:双侧甲状腺位置及形态基本正常,双侧甲状腺明显肿大,显像剂摄取弥漫性增加(图1)。甲状腺摄碘率:131I摄取率增高。甲状腺彩超:甲状腺增大,实质内光点增多、增粗,分布欠均匀。电子胃镜检查:慢性浅表性胃炎,胃体息肉,胃潴留(见图2)。肌电图:双侧尺、腓肠神经及右侧正中神经感觉神经传导速度减慢。入院后予以门冬胰岛素注射液(早5 IU,中5 IU,晚5 IU,餐前皮下注射)联合重组甘精胰岛素注射液(14IU睡前皮下注射)降糖,甲氧氯普胺5 mg,3次/天,缓解胃功能障碍,甲巯咪唑片10 mg,3次/天。经治疗后患者血糖较前控制,恶心、呕吐等消化道症状好转。后完善基因检测提取基因组DNA,应用PCR技术进行MODY6基因扩增及测序,SNP位点rs2583016,GCAGGAGGC[A/G]CGGCG(图3)。诊断:MODY6。
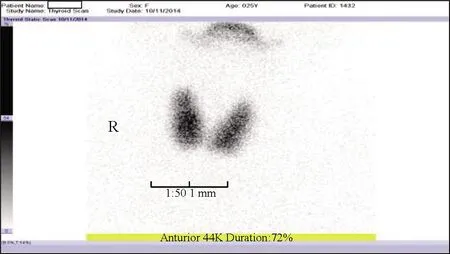
图1 甲状腺放射性核素静态显像扫描双侧甲状腺位置及形态正常,双侧甲状腺肿大,显像剂摄取弥漫性增加
完善患者家系遗传图谱,先证者家系图(见图4)。对先证者部分家族成员行血清学相关检查获得先证者家系特点:父亲患糖尿病:口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)[空腹血糖(fasting plasma glucose,FPG) 6.41 mmol/L,餐后2 h血糖(postprandial plasma glucose,PPG)14.17 mmol/L)],母亲患糖尿病(FPG 5.11 mmol/L,PPG 18.26 mmol/L),舅舅患糖尿病(FPG 6.67 mmol/L,PPG 16.77 mmol/L)(详见表1)。追问病史其外祖父患糖尿病(具体数值不详),对其它家系部分人员进行检测,未发现高血糖者。
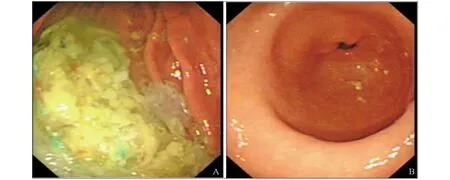
图2 电子胃镜 A:胃潴留;B:慢性浅表性胃炎胃体息肉
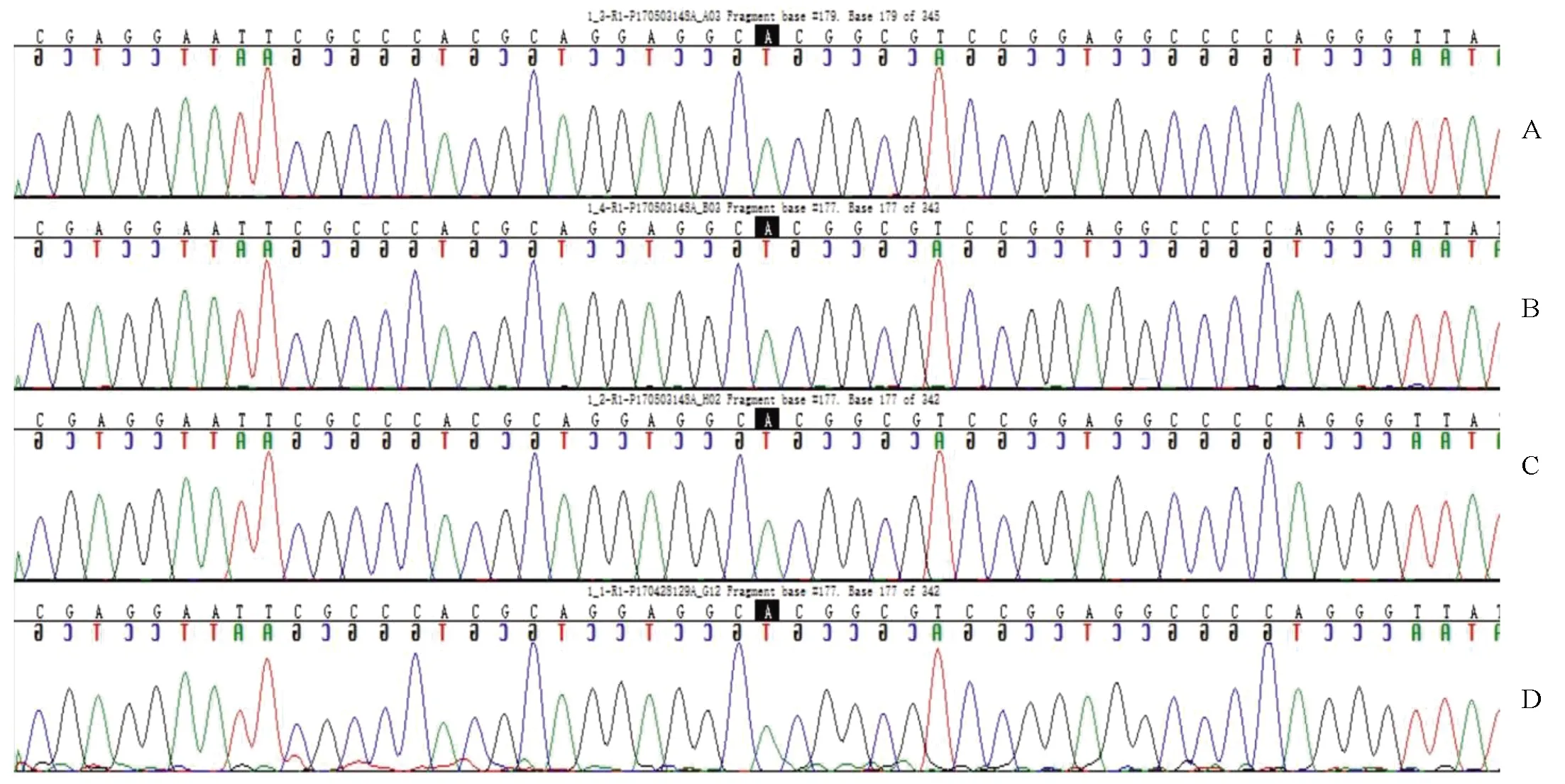
图3 基因检测结果基因的MODY6的175位为SNP位点rs2583016,GCAGGAGGC[A/G]CGGCG。图中黑色部分代表突变基因。A:先证者母亲;B:先证者;C:先证者舅舅;D:先证者家族中血糖正常者
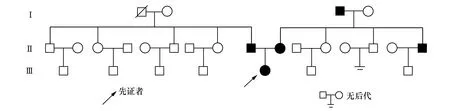
图4 先证者家系图先证者外公、父母、舅舅均患有糖尿病
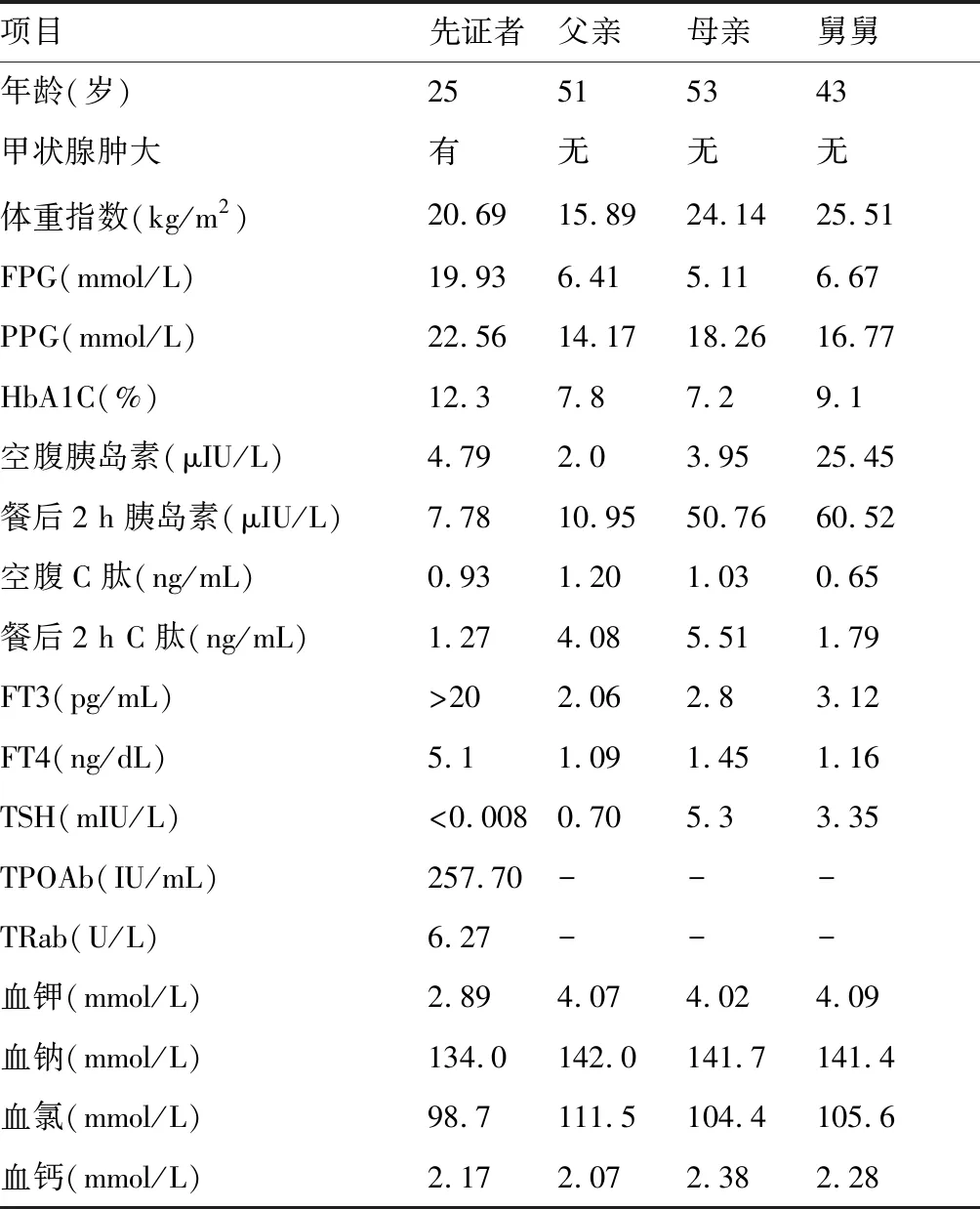
表1 先证者及其家系成员临床特征
参考范围:FPG(空腹血糖):3.9~6.1 mmol/L;PPG(餐后2 h血糖)<7.8 mmol/L;HbA1C(糖化血红蛋白):<6%;空腹胰岛素:5.5~22.7 μIU/L;餐后2 h胰岛素:20.2~73.6 μIU/L;空腹C肽:0.6~1.82 ng/mL;餐后2 hC肽:2.88~6.52 ng/mL;FT3(游离三碘甲状腺原氨酸):2.40~4.50 pg/mL;FT4(游离甲状腺素):0.90~1.66 ng/dL;TSH(促甲状腺激素):0.55~4.78 mIU/L;TPOAb(甲状腺过氧化物酶抗体):0~34 IU/mL;TRab(促甲状腺素受体抗体):<1.75 IU/L;血钾:3.5~5.3 mmol/L;血钠:137~147 mmol/L;血氯:99~110 mmol/L;血钙:2.07~2.75 mmol/L
2 讨 论
MODY是一种遗传特异性较高的疾病,属于常染色体显性遗传,部分保留胰腺β细胞功能,通常发生在25岁之前,家系中成员若携带突变基因则有较高的患病风险。MODY在欧洲占总糖尿病人群的1%~2%[1]。VaxillaireIll等[2]报道MODY诊断参考以下指标:(1)至少3代常染色体显性遗传,家系成员表型相似;(2)糖尿病确诊后至少5年以内不需胰岛素治疗,或胰岛素治疗患者能测出C肽水平;(3)至少1~2个家系成员在25岁前诊断为高血糖;(4)少见超重或肥胖;(5)胰岛素水平常在正常范围内,但仍存在高血糖状态。Graves病为一种自身免疫疾病,临床上主要以甲状腺对称性弥漫性肿大、甲状腺功能亢进症为主要表现。
该病例特点:(1)有三代家族糖尿病史:外公、父亲、母亲、舅舅均有糖尿病。(2)发病年龄25岁。(3)无自发酮症倾向,糖尿病自身抗体阴性,胰岛β细胞功能欠佳。(4)糖尿病和甲状腺疾病同时被发现。(5)甲状腺情况:否认甲状腺疾病家族史,甲状腺增大,实质内光点增多、增粗,分布欠均匀,FT3、FT4均升高,TSH降低,TPOAb、TRab均升高,131I摄取率增高,放射性核素扫描显像剂摄取弥漫性增加。(6)其它表现:肝功能异常,电解质紊乱,胃潴留,双侧尺、腓肠神经及右侧正中神经SCV减慢。
先证者存在甲状腺肿大、振水音等体征,结合患者甲状腺功能、甲状腺自身免疫相关抗体、甲状腺放射性核素扫描、彩色B超、肌电图、电子胃镜改变,分析其原因可能为甲状腺功能亢进加重糖代谢紊乱,血糖波动较大,引起糖尿病周围神经及内脏神经病变,形成糖尿病胃轻瘫,导致体内多种离子失衡。甲状腺病变存在自身免疫损伤,而糖尿病自身抗体均为阴性,故不考虑多发性内分泌腺病综合征(APS)可能。结合先证者上述病例特点,考虑患者为MODY6可能性大。
2013年美国ADA年会Banting奖获得者Bell教授提出“如果家族史符合常染色体显性遗传,有早发糖尿病患者的家族需要筛查MODY基因”[3]。Bonnefond等[4]指出,目前发现的MODY基因类型多达13种,还有其它未知类型。MODY6是由神经源性分化因子1(neuronal differentiation 1,NeuroDl)基因突变所引起。NeuroD基因位于第2号染色体长臂3区2带(2q32),含2个外显子和1个内含子,主要在胰岛、脑、中枢神经系统和外周神经系统的神经元中表达[5]。Gu C等[6]动物研究发现NeuroD与血糖代谢相关,当其缺乏时会导致糖酵解基因表达增加,同时也增加耗氧量和基础胰岛素分泌。
MODY6既往报道不超过10例[7-11],主要特征为20岁左右起病,血清胰岛素低,C肽测不出,存在轻重不一并发症,部分患者皮下或静脉胰岛素治疗有效,较少患者有不同程度体重改变(超重或肥胖);另外MODY6还容易合并其它内分泌系统疾病。先证者发病年轻,血清胰岛素及C肽水平低,且存在糖尿病并发症,需要胰岛素治疗,与Malecki[7]和Liu[9]所报道的相似。因此选择MODY6基因进行扩增及测序,SNP位点rs2583016,GCAGGAGGC[A/G]CGGCG,符合MODY6。最近日本学者报道了4例MODY6患者,除了上述提到的特点外,还发现有患者目前存在精神异常及智力残疾[12]。国内最新报道[13]的1例MODY6病例年龄为10岁,生长发育与同龄人无异,暂未出现智力异常,但需远期随访观察。
综上所述,据患者临床表现结合基因检测结果(SNP位点rs2583016,GCAGGAGGC[A/G]CGGCG),此患者可确诊为MODY6。值得注意的是,在先证者家族中血糖正常者(图3D)也检测到同样的基因突变,可继续追踪其血糖水平。临床上糖尿病合并其它脏器疾病者不少,但合并甲状腺疾病患者少,对此类患者应考虑MODY6可能,若条件允许宜行相关基因检测进一步明确诊断。

