糖尿病肾组织PPARγ和PTEN的表达及对EMT和纤维化的影响
徐庆东,郭焕开,苏 明,陈洁欣,马惠娟,邓继鸿,姜松青,石晓峰
(江门市中心医院肾内科,广东 江门 529000)
糖尿病肾病(diabetic nephropathy,DN)的发病机制尚未完全清楚,临床疗效不甚理想,因此,进一步探索DN发病机制,寻求新的有效的防治措施对治疗DN具有重要意义。肾小管间质纤维化(renal tubular interstitial fibrosis,RTIF)是DN的主要病理变化之一[1],临床研究和动物实验证实,DN的发病进程中,肾小管上皮细胞(renal tubular epithelial cells,RTECs)通过特定程序转化为间质表型细胞,即上皮细胞间质转化(epithelial-mesenchymal transition,EMT)使细胞外基质大量沉积,引起肾小管间质纤维化、变性、萎缩、消失[2]。第10号染色体缺失的磷酸酶和张力蛋白同源基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)基因编码的蛋白具有抗纤维化效应[3],过氧化物酶体增殖物激活受体γ(eroxisome proliferator-activated receptor γ,PPARγ)能在转录水平调控PTEN,延缓DN进展[4]。本研究通过探索糖尿病小鼠及高糖培养的肾小管上皮细胞中的PPARγ、PTEN的表达变化,拟进一步完善PPARγ、PTEN与糖尿病的EMT和肾纤维化的关系。
1 材料与方法
1.1 实验动物及细胞
C57BL小鼠,SPF级,体质量为(30±5)g,由广东省医学实验动物中心提供。大鼠肾小管上皮细胞株(NRK52E)购自上海斯信生物科技有限公司。
1.2 主要试剂及仪器
链脲佐菌素(Streptozotocin,STZ)购自Sigma(美国)公司;磷酸盐缓冲液(phosphate buffered saline,PBS)购自北京索莱宝科技有限公司;两步法免疫组化检测试剂盒购自cell signaling technology(CST)公司;4%多聚甲醛(polyformaldehyde,PFA)磷酸缓冲液、中性树胶封片剂购自上海生工生物工程股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma(美国)公司;双花扁豆凝集素(dolichos bifows agglutinin,DBA)试剂盒、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、DMEM培养基、低分子量蛋白Marker、RNA提取试剂盒、Trizol试剂盒,BCA蛋白定量试剂盒为赛默飞世尔科技产品。一抗鼠抗β-actin、一抗兔抗PPARγ、一抗兔抗PTEN、兔抗E-cadherin、鼠抗α-SMA、兔抗CollagenⅢ、二抗生物素标记羊抗兔、二抗羊抗小鼠免疫球蛋白(IgG)等抗体均购自上海生工生物工程股份有限公司;实时荧光定量PCR仪购自赛默飞世尔科技公司;PCR引物由上海生工生物工程股份有限公司设计完成。
1.3 细胞实验
1.3.1 细胞培养 将本室冻存的NRK-52E大鼠肾细胞株,置于37 ℃、5% CO2培养箱中孵育,48 h换液一次,取对数期细胞进行实验。
1.3.2 细胞分组 根据培养基中葡萄糖的含量,将细胞分为正常糖量的对照组和高糖量的实验组,在2% FBS的DMEM培养基中,对照组的葡萄糖浓度为5.5%;实验组的葡萄糖浓度为25%,分别在6孔板中培养细胞48 h,然后,分别用蛋白质免疫印迹(Western Blot)、实时荧光定量聚合酶链反应(real time fluorescent quantitative polymerase reaction,qRT-PCR)测定目标蛋白和基因的表达。
1.4 糖尿病(DM)小鼠模型的构建
STZ溶于无菌的pH4.5,0.01 mol/L柠檬酸-柠檬酸钠缓冲液中,腹腔注射给予C57BL小鼠STZ溶液55 mg/kg,连续注射5天,第5天注射给药后72 h,空腹测血糖,血糖≥16.7 mmol/L、尿糖阳性即为糖尿病小鼠(实验组)。
另取正常小鼠10只作为对照组,腹腔注射无菌pH4.5、0.01 mol/L的柠檬酸-柠檬酸钠缓冲液,连续注射5天,第5天注射给药后72 h,空腹测血糖。实验期间两组小鼠均正常饮食饮水,连续喂养8周,处死小鼠,取肾脏,一侧肾脏固定于4% PFA溶液中制作石蜡切片,进行病理检查、免疫组化检测。另一侧肾脏加入生理盐水研磨,提取总蛋白和RNA,进行Western Blot、qRT-PCR检测。
1.5 肾组织病理学检测
肾组织用中性甲醛固定制成石蜡切片,分别用苏木精-伊红(Hatmatoxylin-Eosin,HE)、高碘酸-无色品红(periodic acid solferino,PAS)、Masson、高碘酸乌洛托品银(periodic acid-silver-methenamine,PASM)进行染色,染色步骤严格按照试剂盒要求进行,光镜下观察肾组织形态结构变化及纤维化情况。
1.6 Western blot检测
取两组小鼠肾组织和肾小管上皮细胞,提取总蛋白,Western blot检测PPARγ、PTEN蛋白、EMT蛋白、α-SMA,CollagenⅢ、E-cadherin蛋白表达情况。
1.7 qRT-PCR检测
取两组小鼠肾组织和肾小管上皮细胞,提取RNA,qRT-PCR检测PPARγ、PTEN mRNA表达情况。PPARγ引物:上游为5′-CGCAGTTCTGAGCUGGCGACT-3′,下游为5′-TGGACAGACCCGAACTGATGG-3′;PTEN引物:上游为5′-CTTAAGTTCAGTCCGGAACTTG-3′,下游为:5′-GGCATCAGCATGGAACTAGAC-3′,内参引物:5′-GAATGCTGACTGGGAAATTGAG-3′,下游为:5′-ACATTCATCATGGCAGTAACT-3′。反应条件:95 ℃反应10 min后,在95 ℃ 15 s、72 ℃ 30 s、60 ℃ 30 s,共循环40次,重复3次,所得试验数据采用RQ=2-△△Ct计算PPARγ、PTEN mRNA表达情况。
1.8 荧光素酶检测PPARγ转录活性
氧化酶体增殖物反应原件荧光素酶报告质粒(Addgene plasmid 1015)由本实验室保存,取两组肾组织及肾小管上皮细胞,培养24 h后将相同数量各组系膜细胞裂解,加反应底物,检测荧光强度,将荧光强度进行对数转换后统计分析。
1.9 统计学分析
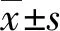
2 结 果
2.1 两组小鼠肾组织病理变化
如见图1所示,肾组织分别用HE、PAS、PASM染色,对照组小鼠肾小球及基底膜形态完整、结构清晰,肾小管未出现扩张、坏死、硬化等现象。实验组小鼠肾小球系膜增生、出现同心圆状的结节状硬化。肾小管管腔扩张、上皮细胞肿胀、变性、呈空泡状,基底膜不规则增厚,出现大量炎性细胞浸润,肾小管间质区PAS染色阳性物质增多。Masson染色显示,对照组未出现胶原沉积,实验组小鼠肾小管管腔明显扩张、肾小球及肾间质见大量被染成蓝紫色条索状的胶原纤维沉积。
图1 两组小鼠肾组织HE、PAS、Masson、PASM染色(400×)
2.2 小鼠肾组织及肾小管上皮细胞中PPARγ、PTEN蛋白的表达
Western Blot显示,与对照组比较,实验组肾组织及及高糖培养下肾小管上皮细胞中的PPARγ、PTEN蛋白表达水平显著降低(P<0.01,见图2)。
2.3 两组小鼠肾组织及肾小管上皮细胞中PPARγ、PTEN mRNA的表达
qRT-PCR结果显示,与对照组比较,实验组肾组织及高糖培养下肾小管上皮细胞中的PPARγ、PTEN mRNA表达水平显著降低(P<0.01,见图3)。
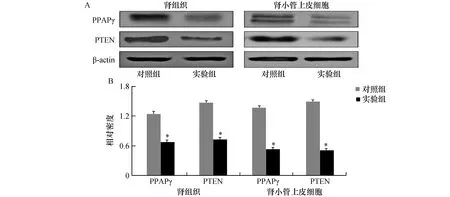
图2 两组小鼠肾组织及高糖培养下肾小管上皮细胞中的PPARγ、PTEN蛋白表达水平A:电泳图,B:PPARγ、PTEN与β-actin比值的相对密度图;与对照组比较,*P<0.01
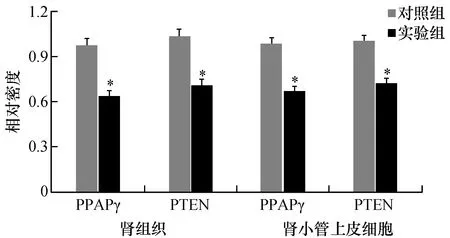
图3 两组小鼠肾组织及肾小管上皮细胞中PPARγ、PTEN mRNA表达水平与对照组比较,*P<0.01
2.4 小鼠肾组织EMT及纤维化
Western Blot显示,与对照组比较,实验组肾组织及高糖培养下肾小管上皮细胞中的E-cadherin蛋白表达水平显著降低(P<0.01),α-SMA、Collagen-Ⅲ蛋白表达水平显著增高(P<0.01,见图4)。
2.5 小鼠肾组织及及肾小管上皮细胞PPARγ转录活性
与对照组比较,实验组肾组织及及肾小管上皮细胞PPARγ转录活性均明显增高(P<0.01),见图5。
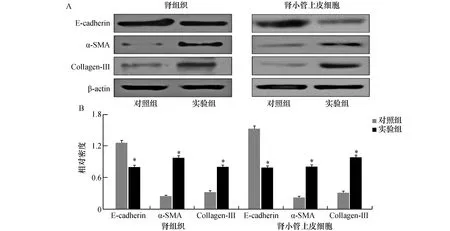
图4 两组小鼠肾组织及肾小管上皮细胞E-cadherin、α-SMA、Collagen-Ⅲ蛋白表达水平A:电泳图,B:三种检测蛋白与β-actin比值的相对密度图;与对照组比较,*P<0.01
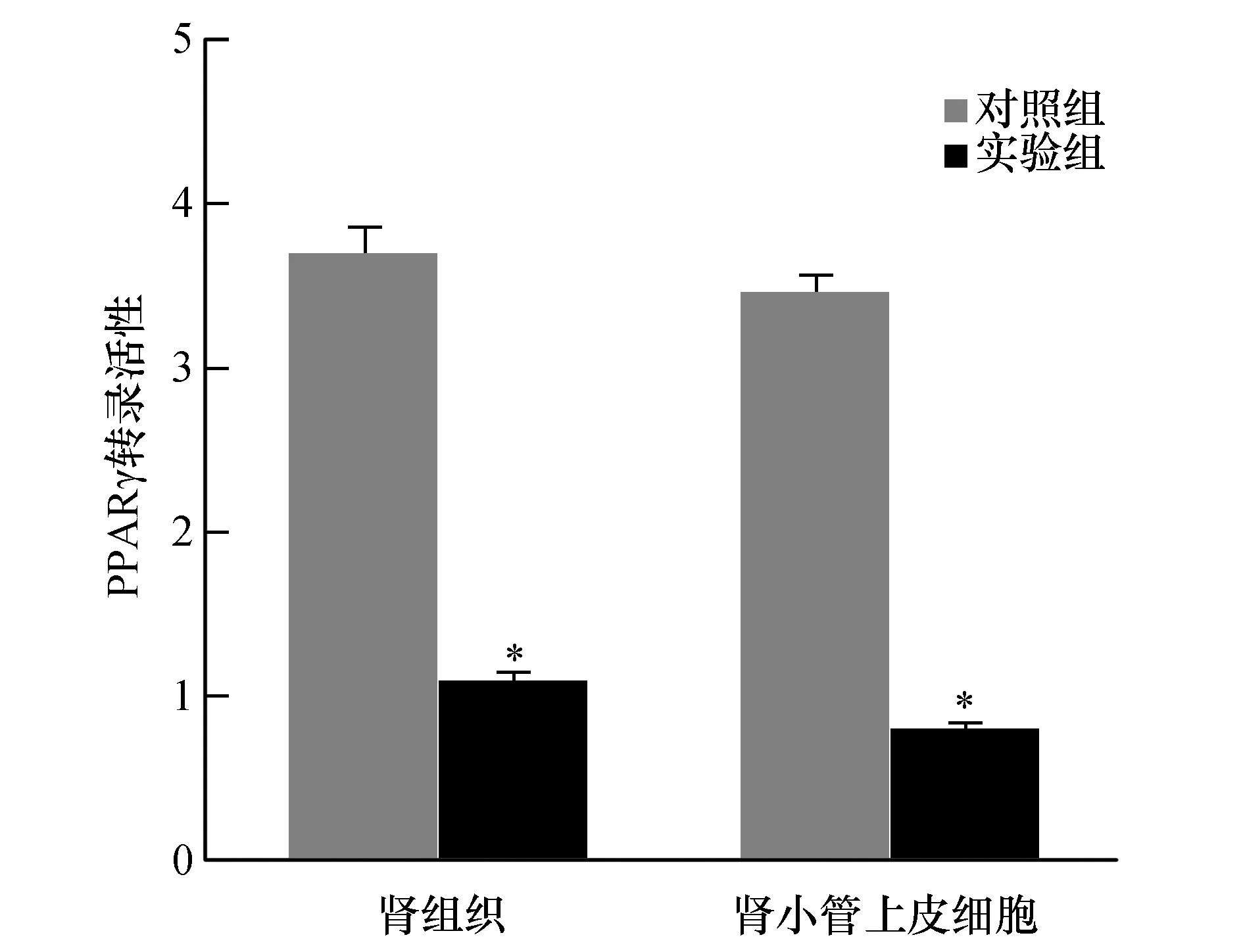
图5 两组小鼠肾组织及及肾小管上皮细胞PPARγ转录活性与对照组比较,*P<0.01
2.6 PTEN蛋白与PPARγ、E-cadherin、α-SMA、Collagen-Ⅲ蛋白表达的相关性
对体外培养肾小管上皮细胞中PTEN蛋白与PPARγ、E-cadherin、α-SMA、Collagen-Ⅲ蛋白表达量相关性进行分析,PTEN与PPARγ及E-cadherin呈显著正相关,与α-SMA、Collagen-Ⅲ呈显著负相关,见表1。

表1 PTEN蛋白与PPARγ、E-cadherin、α-SMA、Collagen-Ⅲ蛋白表达的相关性分析
3 讨 论
PTEN基因定位于人类第十号染色体上[5],该基因能编码具有脂质磷酸酶活性和蛋白磷酸酶活性的双重特异性磷酸酶,是一种双重活性抑癌基因[6]。过往对PTEN的研究主要集中于肿瘤,能参与调控多条信号通路及细胞周期蛋白通路,发挥抑制细胞增殖、迁移、黏附、诱导细胞凋亡,抑制血管生成等作用[7]。文献报道,PTEN是足细胞胰岛素敏感性调控的关键分子之一,是引发DN的重要因子[8]。DN发病时,PTEN表达降低,与肾组织纤维化密切相关[9]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一种核转录因子[10],是核受体超家族成员,有α、β、γ三种亚型[11]。其中,PPARγ在肾小球、近曲小管、肾脏纤维细胞等组织中有广泛表达[12],研究发现,在糖尿病小鼠模型中,PPARγ能直接降低尿蛋白而不降低血糖[13]。而且,PPARγ通过与PTEN上游的过氧化物酶体增生物反应元件结合,参与PTEN的调控[14]。本实验结果显示,经高糖处理后,DN小鼠肾组织及高糖培养下肾小管上皮细胞中的PPARγ、PTEN的蛋白及mRNA表达水平均较正常小鼠显著降低,提示高糖不仅使PPARγ表达水平降低,还降低PTEN的表达水平,且蛋白和mRNA降低水平和趋势相同。有文献报道,PPARγ转录活性在系膜细胞表型转化中具有重要作用,与DN发生发展密切相关,而高糖可抑制PPARγ转录活性。本文结果显示,DN小鼠肾组织及及高糖培养的肾小管上皮细胞,PPARγ转录活性均明显低于对照组。
Iwano等人[15]研究发现,36%的间质成纤维细胞来源于RTECs,说明间质成纤维细胞的重要来源是EMT。EMT发生时,EMT的标志性蛋白表达发生改变,如波形蛋白(Vimentin)被激活,α-SMA表达增加,E-cadherin表达减少[16]。本研究结果显示,正常小鼠肾组织和肾小管上皮细胞中的E-cadherin蛋白表达水平较高,α-SMA、Collagen-Ⅲ蛋白表达水平较低,DN小鼠肾组织及高糖培养下肾小管上皮细胞中的E-cadherin蛋白表达水平显著低于对照组,而α-SMA、Collagen-Ⅲ蛋白表达水平显著高于对照组,提示高糖能促进EMT的进展,促进肾组织和肾小管上皮细胞纤维化。对小鼠肾组织进行HE、PAS、PASM、Masson染色发现,与对照组比较,实验组小鼠肾小球系膜增生、出现同心圆状结节状硬化;肾小管管腔扩张、上皮细胞肿胀、变性、呈空泡状,基底膜不规则增厚,出现大量炎性细胞浸润,肾小管间质区PAS染色阳性物质增多,小鼠肾小管管腔明显扩张,肾小球及肾间质见大量被染成蓝紫色条索状的胶原纤维沉积,提示在发生EMT时,确实发生了肾小管间质纤维化。对肾小管上皮细胞中PTEN蛋白与PPARγ、E-cadherin、α-SMA、Collagen-Ⅲ蛋白表达量的相关性分析结果表明,PTEN与PPARγ(r=0.71)及E-cadherin(r=0.62)的表达呈正相关,与α-SMA(r=-0.66)、Collagen-Ⅲ(r=-0.59)的表达呈显著负相关,这与文献报道一致[17]。
综上所述,机体在高糖的环境中,肾组织和肾小管上皮细胞中的PPARγ与PTEN的表达水平显著降低,E-cadherin,上调α-SMA、Collagen-Ⅲ的表达下调,肾组织出现EMT及纤维化改变。其机制有待于进一步研究。

