慢性疲劳综合征孕鼠胎盘细胞增殖、凋亡情况及其分子机制探讨
赵海 吴延军 吴曙光 张健 姚刚
慢性疲劳综合征(Chronic fatigue syndrome,CFS)是因生活节奏紧张而出现的一组以长期疲劳为突出表现的全身性症候群,又称肌痛性脑脊髓炎(Myalgic encephalomyelitis,ME),主要表现为睡眠障碍,常伴有体重、运动能力下降、免疫功能受损及肠道菌群失调等临床症状[1]。流行病学调查结果显示CFS 危及我国人口的10%~25%,患者的线粒体出现氧化应激,ATP 能量生成降低[2,3]。研究表明神经内分泌、免疫系统、氧化应激和遗传因素等异常可诱导CFS 的发生,怀孕期、更年期和月经期等特殊时期会加重女性患者的临床症状,同时妊娠女性胎盘提取物中的抗氧化、抗炎等生物活性物质也显著降低[4~6]。
哺乳动物整个妊娠过程中子宫基质细胞蜕膜化、滋养层细胞侵袭迁移、胎盘细胞增殖凋亡、绒毛膜尿囊融合以及母胎血管重建等过程在胎盘形成进程中起到关键作用,胎盘发育异常与子宫内膜异位症、子痫和妊娠高血压等生殖性疾病息息相关[7]。目前研究发现采用复合刺激法复制的慢性疲劳综合征雌性鼠的血清中雌、孕激素水平和学习记忆功能显著降低,下丘脑-垂体-性腺轴功能紊乱,且其学习记忆功能降低[8~10],进一步研究发现CFS 孕鼠胎盘形态结构存在异常。研究表明细胞增殖和凋亡、氧化应激稳态和FoxO 信号通路在胎盘的形成中起着重要作用[11~13]。CFS 孕鼠胎盘细胞增殖和凋亡情况、氧化应激稳态和FoxO 信号通路因子表达是否存在异常,它们之间与CFS 孕鼠胎盘结构异常是否有内在关联,目前尚无相关报道。因此,本实验拟通过免疫组化、TUNEL 和比色法检测正常和CFS 孕鼠D8、D10、D12 和D14 胎盘细胞增殖凋亡、氧化应激稳态以及D13 胎盘细胞中FoxO 信号通路因子表达情况,初步探讨CFS 孕鼠胎盘的形态结构异常与胎盘细胞增殖凋亡、氧化应激稳态和FoxO 信号通路因子之间的关系,为阐明CFS 孕鼠胎盘结构异常,F1 代出现生长发育迟缓的分子机制奠定一定的理论和实验基础。
1 材料与方法
1.1 动物与试剂取SPF 级昆明小鼠,6~8 周龄,体重18.0~22.0g,共150 只,其中雌性100 只,雄性50只,由重庆医科大学实验动物中心提供[SCXK(渝)2012-0001]。
兔源性PCNA(bs-2006R)、FoxO-1(bs-2537R)和FoxO-4(bs-2766R)多克隆抗体均购自北京博奥森生物技术有限公司;TUNEL 细胞凋亡检测试剂盒(C1091)购自碧云天生物技术有限公司;SP kit 兔源试剂盒(SP9001)、辣根酶标记抗山羊IgG(ZB2306)及DAB 显色试剂盒(ZLI-9017)均购自北京中衫金桥有限公司;伊红染液(D019-1)和苏木素染液(D005-2)均购自南京建成生物工程研究所;氧化应激指标试剂盒活性氧(QY-X16254)、活性氮(QYY26312)和丙二醛(QY-Y23136),抗氧化应激指标试剂盒总抗氧化应激能力(QY-Y61124)、过氧化氢酶(QY-Y32512)、超氧化物歧化酶(QY-S13521)、谷胱甘肽过氧化物酶(QY-T11542)和过氧化物酶(QY-X35410)购自上海乔羽生物科技有限公司。
1.2 方法
1.2.1 动物分组及复制CFS 小鼠模型 将SPF 级100 只雌性小鼠随机分为正常组(不给予任何处理,n=50)和CFS 组(给予复合刺激,n=50)。每组孕鼠受孕时间点各10 只,从获取的每个时间位点组织中随机抽取9 个实验样本用于相应实验研究。复合刺激包括实施束缚、力竭、夹尾、低温、饥渴和明暗颠倒等处理,连续5 周,复制CFS 小鼠模型。
1.2.2 收集孕鼠血清、子宫及胎盘 CFS 小鼠模型复制成功后,采用摘除眼球法分别收集每组小鼠的血液,室温静置10min,离心,收集血清。此外脱臼处死每组小鼠各10 只,收集子宫。采用雄鼠与动情期雌鼠1:2 合笼,次日早上9:00 观察到阴栓者记为妊娠第1 天(记为D1),收集D8、D10、D12、D13 和D14 的胎盘组织,采用预冷的PBS 洗涤2 次,4%多聚甲醛固定24h 后,经梯度酒精脱水、常规石蜡包埋和切片。随后采用IHC 和比色法进行细胞增殖、凋亡、氧化应激和FoxO 相关指标的检测。
1.2.3 免疫组化 免疫组化步骤按北京中山金桥公司生产的SP 免疫组化染色试剂盒说明书进行。孕鼠D8、D10、D12、D13 和D14 植入位点石蜡切片(5 μm),切片进行脱蜡,复水,枸橼酸溶液抗原修复,山羊血清封闭,兔源性PCNA(1∶500 稀释)、FoxO-1(1∶400稀释)和FoxO-4(1∶400 稀释)的多克隆抗体,4℃孵育过夜,次日分别加入山羊抗兔的二抗,滴加辣根酶标记链酶卵白素工作液(S-A/HRP)室温孵育30min,DAB 显色,苏木精复染,封片,显微镜下观察D8、D10、D12 和D14 胎盘细胞PCNA 的表达,以及D13 胎盘细胞中FoxO-1 和FoxO-4 的表达情况。
1.2.4 比色法 比色法检测血清、子宫和孕鼠D13 胎盘组织中氧化应激和抗氧化应激指标含量,取出冻存的子宫和胎盘组织,采用匀浆机进行匀浆,过滤,收集滤液。将血清、子宫和胎盘的滤液分别加入96孔板内,分别设为测试的样品和空白组,每个孔重复3 次。随后向空白每孔添加50μl 试剂SinoBestBio缓冲液A,向待测样品孔内分别加入50μl 试剂SinoBestBio 染色液B。轻轻摇动96 孔板,使其混匀。放进 37℃培养箱里孵育30min,即刻放进酶标仪里,于580nm 波长处读取吸光度值(OD),根据吸光度值构建生成曲线,计算样品实际浓度。
1.2.5 TUNEL 将D8、D10、D12 和D14 的石蜡切片进行二甲苯脱蜡5~10min。换用新鲜的二甲苯,再脱蜡5~10min。无水乙醇5min。90%乙醇2min,70%乙醇2min,蒸馏水2min,滴加20μg/ml 不含DNase的蛋白酶K(20mg/ml),用P0106 免疫染色洗涤液37℃作用20min,PBS 洗涤3 次。滴加50μl 的生物素标记液(按照说明书进行配制),37℃避光孵育60min。用PBS 洗涤1 次,滴加0.1~0.3ml 标记反应终止液,室温孵育10min。用PBS 洗涤3 次,滴加0.5ml DAB 显色液(按照说明书进行配制DAB 显色液),室温孵育5~30min 或根据显色情况孵育适当时间。用PBS 洗涤3 次终止染色,随后采用苏木素染色液进行细胞核染色。再用PBS 洗涤3 次,用梯度乙醇进行脱水,二甲苯透明封片,显微镜下观察孕鼠D8、D10、D12 和D14 胎盘细胞凋亡情况。
1.3 统计学分析采用SPSS 17.0 软件,运用单因素方差分析法(ANOVA)比较PCNA、FoxO-1、FoxO-4和TUNEL 阳性细胞在不同组份胎盘中表达的差异性,P<0.05 为差异有统计学意义。
2 结果
2.1 CFS 孕鼠胎盘细胞增殖情况免疫组化实验检测胎盘细胞增殖情况,实验结果显示与正常组比较,CFS 组孕鼠D8、D10、D12 和D14 胎盘中增殖细胞核抗原表达呈逐渐降低趋势,见图1。Image Pro Plus图像分析显示,PCNA 在CFS 孕鼠D8 和D12 胎盘中阳性细胞的IOD 值与正常组比较,无统计学差异(P>0.05),但PCNA 在D10 和D14 胎盘中阳性细胞的IOD 值显著低于正常组(P<0.05),见表1。

图1 两组孕鼠D8、D10、D12 和D14 胎盘细胞增殖情况(×400)
表1 PCNA 在两组孕鼠D8、D10、D12 和D14 胎盘细胞中阳性细胞IOD 值比较()

表1 PCNA 在两组孕鼠D8、D10、D12 和D14 胎盘细胞中阳性细胞IOD 值比较()
注:与正常组比较,*P<0.05
2.2 CFS 孕鼠胎盘细胞凋亡情况采用TUNEL 法检测胎盘细胞凋亡情况,实验结果显示,与正常组比较,随着妊娠天数的增加,CFS 组D8、D10、D12和D14 胎盘蜕膜区中细胞凋亡呈逐渐增加趋势,见图2。Image Pro Plus 图像分析显示,CFS 组孕鼠D8胎盘蜕膜区中阳性凋亡细胞的IOD 值与正常组无统计学差异(P>0.05),CFS 组D10、D12、D14 胎盘细胞蜕膜区中凋亡阳性细胞的IOD 值显著高于正常组(P<0.05),见表2。
表2 凋亡细胞在两组孕鼠D8、D10、D12 和D14 胎盘蜕膜区细胞中阳性细胞IOD 值比较()

表2 凋亡细胞在两组孕鼠D8、D10、D12 和D14 胎盘蜕膜区细胞中阳性细胞IOD 值比较()
注:与正常组比较,*P<0.05

图2 两组孕鼠D8、D10、D12 和D14 胎盘细胞凋亡情况(×400)
2.3 CFS 孕鼠胎盘氧化应激稳态受损采用比色法检测两组小鼠血清、子宫和孕鼠D13 氧化应激与抗氧化应激指标表达情况,实验结果显示,CFS组小鼠血清、子宫和孕鼠D13 胎盘中氧化应激指标活性氧、活性氮和丙二醛的含量均显著高于正常组(P<0.05)。CFS 组小鼠血清、子宫和孕鼠D13胎盘中抗氧化应激指标总抗氧化应激能力、过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化物酶的含量均显著低于正常组(P<0.05),见表3。
2.4 CFS 孕鼠胎盘FoxO 信号表达增强免疫组化实验结果显示FoxO 信号通路中指标FoxO-1 和FoxO-4 在CFS 孕鼠D13 胎盘迷路区中的表达均强于正常组,见图3。Image Pro Plus 图像分析显示,FoxO-1 和FoxO-4 在CFS 孕鼠D13 胎盘中阳性细胞的IOD 值显著高于正常组(P<0.05),见表4。
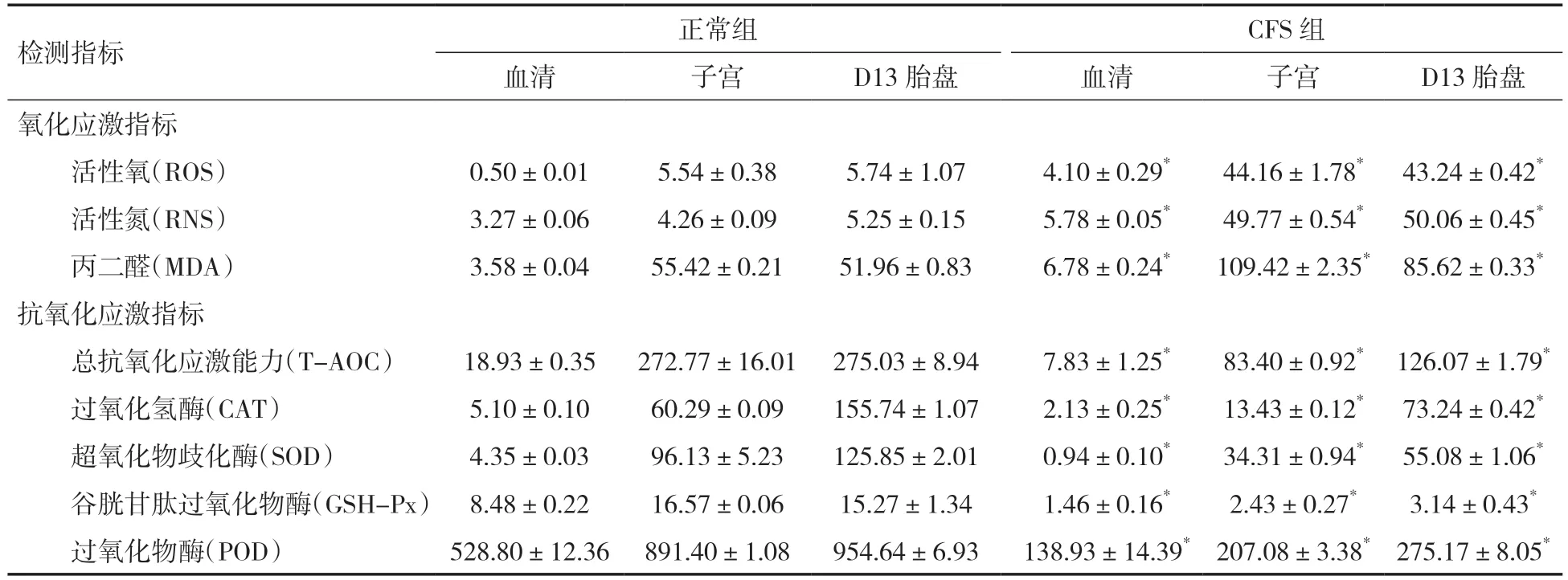
表3 两组小鼠血清、子宫和孕鼠D13 胎盘中氧化应激和抗氧化应激指标表达情况

图3 FoxO-1 和FoxO-4 在两组孕鼠D13 胎盘中的表达情况(×400)
表4 FoxO-1 和FoxO-4 在两组孕鼠D13 胎盘细胞中阳性细胞的IOD 值比较()

表4 FoxO-1 和FoxO-4 在两组孕鼠D13 胎盘细胞中阳性细胞的IOD 值比较()
注:与正常组比较,*P<0.05
3 讨论
慢性疲劳综合征已成为21 世纪影响人类身心健康的新杀手,给患者的工作和家庭带来很大困扰,在英国CFS 的发病率为0.19%,美国男性CFS发病率为2.3%,女性为1.9%,日本CFS 的发病率为1.5%,中国中学生的发病率为0.9%。CFS 与高压力的生活状态有关,随着人们生活节奏的加快、生活压力的增加,CFS 的发病率也越来越高,对生活质量产生了严重影响[14]。CFS 发病机制与病毒感染、能量代谢、大脑功能、精神心理因素、免疫系统功能、遗传易感性和神经内分泌系统等密切相关[15,16]。流行病学调查发现女性患者的月经不调、子宫内膜异位症、盆腔疼痛等妇科问题风险指标和性功能障碍发病率明显增高[17,18]。CFS 患者产科疾病的临床表现和分子机制研究成为目前生殖领域研究的热点。
哺乳动物胎盘不仅是母胎气体营养物质交换和胎儿代谢物排泄的场所,同时也是一个重要的内分泌器官。胎盘发育异常将导致自然流产、先兆子痫、宫内发育迟缓(intrauterine growth retardation,IUGR)和葡萄胎等妊娠性疾病的发生发展[19,20]。研究表明胎盘的形成与氧化应激稳态、FoxO、Tead 和Wnt等信号通路密切相关[21]。近年研究发现,氧化应激是导致多种疾病的主要因素,氧化应激相关指标与子痫前期、妊娠高血压及妊娠期糖尿病(GDM)等妊娠特有疾病密切相关[22~24]。氧化应激可加快胎盘滋养细胞的凋亡老化,进而影响滋养细胞的合体化、向浸润方向的分化和子宫螺旋动脉重塑,加剧胎盘缺氧状态形成的恶性循环,诱发病理妊娠[25]。氧化应激可以通过增加促炎因子、线粒体损伤及下游基因表达参与胎盘细胞增殖凋亡、侵袭迁移和血管生成等进程,致使胎盘功能障碍[26,27]。氧化应激可造成人滋养细胞氧化损伤,增殖和侵袭能力下降,致使胎盘发育异常[28]。过氧化物酶体增殖物激活受体γ(PPARγ)可能通过诱导胎盘滋养细胞的凋亡参与子痫前期的发生[29]。
FoxO 属于叉头框蛋白(Forkhead proteins)家族,其成员包括FoxO-1、FoxO-3、FoxO-4 和FoxO-6,研究表明FoxO 家族信号参与转录、激活、抑制多个靶基因,参与调控动物的生长发育、代谢、细胞周期、增殖凋亡、自噬、炎症、氧化应激、抑制肿瘤等[30~32]。研究表明FoxO-4、FoxO-1 和FoxO-3a 的过量表达可诱导细胞增殖停滞,促进凋亡[33]。此外FoxO 还参与胎盘的发育进程,FoxO 是保护母胎免受氧化损伤的关键因子[34]。氧化应激可以通过调控Wnt/β-catenin 信号因子影响胎盘滋养细胞的侵袭迁移,从而参与胎盘的形成[35]。FoxO-3a 在早孕小鼠子宫内膜蜕膜化中起着关键作用,FoxO-1 可调节绒毛滋养层细胞JAR 的增殖和迁移,胎盘FoxO-1过度表达可能参与妊娠期糖尿病胰岛素抵抗的发生发展[36,37]。由此可见氧化应激和FoxO 信号通路共同参与调控胎盘的形成。
本实验通过采用免疫组化和TUNEL 方法检测不同妊娠时期CFS 孕鼠胎盘增殖和凋亡情况,同时检测氧化应激指标和FoxO 信号因子的表达情况,探讨CFS 孕鼠胎盘形态结构异常的分子机制。实验结果显示,PCNA 在CFS 孕鼠D8 和D12胎盘中阳性细胞的IOD 值与正常组无显著性差异,但PCNA 在D10 和D14 胎盘迷路区中阳性细胞的IOD 值显著低于正常组(P<0.05)。与此同时CFS组小鼠D10、D12 和D14 胎盘细胞蜕膜区中凋亡阳性细胞的IOD 值显著高于正常组(P<0.05),由此推测CFS 孕鼠胎盘增殖降低、凋亡增加可能致使胎盘结构异常,但其具体的分子机制有待深入研究。
本研究采用比色法和免疫组化检测两组孕鼠D13 胎盘氧化应激与抗氧化应激指标及FoxO 信号表达情况,实验结果显示,CFS 小鼠血清、子宫和孕鼠D13 胎盘中氧化应激指标含量均显著高于正常组(P<0.01);CFS 小鼠血清、子宫和孕鼠D13 胎盘中抗氧化应激指标含量均显著低于正常组(P<0.01)。免疫组化实验结果显示FoxO 信号通路中指标FoxO-1 和FoxO-4 在CFS 孕鼠D13 胎盘迷路区中的表达量均显著高于正常组(P<0.05)。据此,推测孕鼠FoxO 信号表达异常,胎盘抗氧化能力降低,致使胎盘增殖降低、凋亡增加,诱导胎盘结构异常,最终导致CFS 孕鼠F1 代生长发育缓慢,本实验以期为CFS 女性患者的妊娠疾病治疗提供新的实验基础和理论依据。

