血管紧张素(1-7)对ox-LDL诱导人脐静脉内皮细胞凋亡和炎症反应的影响
赖莎,陈丽丽,叶嘉俊,黄会平,易润青,潘芸芸
(1.广东药科大学附属第一医院,广东 广州 510080; 2.广州市医药职业学校,广东 广州 510000)
动脉粥样硬化(atherosclerosis,AS)是最常见的疾病之一,由AS病变引起的脑卒中和冠心病已经成为全世界引起死亡的重要原因,找到更好的治疗方法是目前的迫切需要[1]。血管紧张素(1-7)[angiotensin(1-7),Ang(1-7)]是肾素-血管紧张素系统的新成员,主要由血管紧张素转化酶-2(ACE 2)分解血管紧张素II(Ang II)生成的一种具有生物活性的肽[2-3]。研究发现,Ang(1-7)可能通过改善血管内皮功能、抑制平滑肌细胞增殖及迁移、降低血脂水平、减轻炎症反应,在AS发生和发展过程中起到重要的保护作用[4]。因此,本研究从抑制血管内皮细胞损伤和凋亡、炎症反应等方面,验证Ang(1-7)对氧化低密度脂蛋白(ox-LDL)诱导人脐静脉内皮细胞(HUVECs)的保护作用,为研究药物经Ang(1-7)调节途径抗AS的机制提供参考。
1 材料与方法
1.1 实验细胞
人脐静脉内皮细胞(HUVECs)(Life Technologies,InvitrogenTM)。
1.2 实验试剂
DMEM培养基(美国Gibco公司);ox-LDL(北京协生生物科技有限公司);胎牛血清(FBS,美国Gibco公司);二甲基亚砜(DMSO,美国Sigma公司);Ang(1-7)(美国Sigma公司);Ang(1-7)抑制剂(A779,美国Sigma公司);MTT细胞增殖检测试剂盒(美国Sigma公司);Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);人血管生成素(Ang)、人内皮型一氧化氮合成酶(NOS3/eNOS)、人肿瘤坏死因子α(TNF-α)、人白介素1β(IL-1β)人白介素6(IL-6)酶联免疫吸附测定试剂盒(Elabscience);NO测试盒(南京建成)。
1.3 主要仪器
台式低温高速离心机(Z323K)(德国HERMLE公司,TGL-16G);水平离心机(上海安亭科学仪器厂,TDL-80-2B);普通培养箱(日本SANYO公司,XMTD203);HH-1数显恒温水浴锅(金坛市晨阳电子仪器厂,XMTD203);Thermo酶标仪(美国Thermo公司,MULTISKAN MK3);FACScan流式细胞仪(美国Becton Dickinson公司,AMG0002073)。
1.4 方法
1.4.1 HUVECs 培养与处理 HUVECs用含10%(φ) FBS的DMEM培养基的培养瓶,在37 ℃、6%(φ) CO2的恒温培养箱中孵化。倒置显微镜下观察,待培养瓶中细胞生长至覆盖瓶底90%以上时,进行传代,收集原代培养3代以内的HUVEGs,采用适当方法储存。
1.4.2 细胞接种 按照1×106个/mL 的密度,在六孔板上加入HUVECs细胞悬浮液,每个孔中补充完全培养液至2 mL,轻轻晃动六孔板混匀细胞悬液,并置于细胞培养箱中培养,待细胞密度达90%以上时,即可加药干预并分组。
1.4.3 实验分组 细胞分为:对照组(HUVECs+PBS)、模型组(HUVECs+100 μg/mL ox-LDL)、Ang(1-7)组[HUVECs+100 μg/mL ox-LDL+100 nmol/L Ang(1-7)]、A779组(HUVECs+100 μg/mL ox-LDL+100 nmol/L A779)。
1.4.4 细胞存活率的检测 各组细胞悬液移植到96孔板,每孔0.09 mL,加入0.02 mL MTT试剂(5 mg/mL),37 ℃培养箱中培养4 h。吸出各孔液体加入0.2 mL DMSO,摇床震荡10 min,于490 nm 波长处读取其吸光度(A)。根据公式:细胞存活率=(实验组A490-空白组A490)/(对照组A490-空白组A490)×100%,计算各组细胞存活率。
1.4.5 细胞凋亡的检测 各组细胞悬液移植到六孔板,于室温下避光加入Annexin V-FITC,染色10 min,同样避光条件下再加入PI染色5 min,双染色后采用流式细胞仪检测细胞凋亡率。
1.4.6 血管内皮因子、炎症因子水平的检测 加待测样品0.1 mL于反应孔中,采用酶联免疫吸附法(ELISA),用酶标仪在450 nm波长处读取吸光度(A)值,检测各组Ang(1-7)、eNOS、NO、TNF-α、IL-1β、IL-6水平。
1.5 统计学方法

2 结果
2.1 各组HUVECs的细胞存活率
与对照组细胞存活率(99.98±4.27)%比较,ox-LDL诱导的HUVECs模型组细胞存活率(38.75±2.34)%明显下降,差异具有统计学意义(P<0.05);与模型组比较,Ang(1-7)组细胞存活率(68.36±3.30)%显著升高;而与Ang(1-7)组相比,A779组细胞存活率(40.62±2.63)%显著下降,差异均具有统计学意义(P<0.05),见图1。

150100500细胞存活率/%对照组模型组Ang(1-7)组A779组***#
2.2 各组细胞凋亡率
与对照组细胞凋亡率(8.10±3.27)%比较,ox-LDL诱导的HUVECs模型组细胞凋亡率(33.20±3.32)%明显增高,差异具有统计学意义(P<0.05);与模型组比较,Ang(1-7)组细胞平均凋亡率(24.10±3.97)%显著下降,差异具有统计学意义(P<0.05);而与Ang(1-7)组相比,A779组细胞平均凋亡率(40.60±4.18)%显著升高,差异均具有统计学意义(P<0.05),见图2。
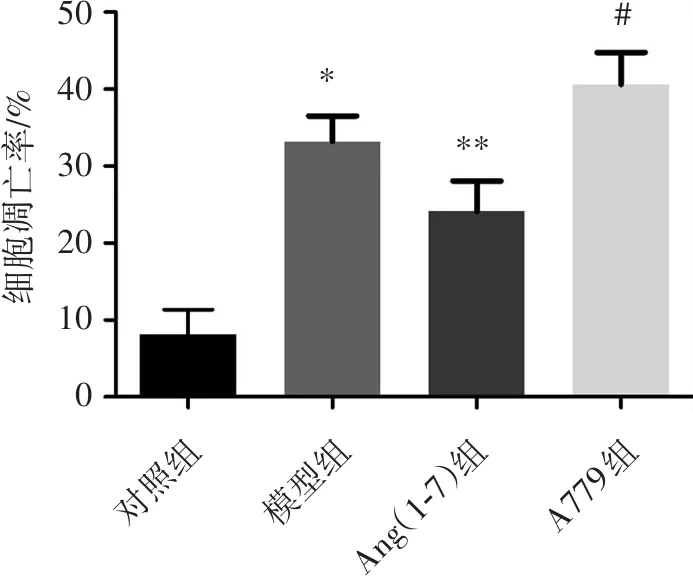
***#细胞凋亡率/%50403020100对照组模型组Ang(1-7)组A779组
2.3 各组Ang(1-7)、血管内皮因子NO、eNOS水平
如表1所示,与对照组比较,ox-LDL诱导的HUVECs模型组Ang(1-7)、NO、eNOS水平显著降低,差异具有统计学意义(P<0.05);与模型组比较,Ang(1-7)组Ang(1-7)、NO、eNOS水平显著升高,差异具有统计学意义(P<0.05);而与Ang(1-7)组相比,A779组显著降低,差异均具有统计学意义(P<0.05)。

表1 HUVECs的Ang(1-7)、NO、eNOS水平
2.4 各组炎症因子TNF-α、IL-1β、IL-6水平
如表2所示,与对照组比较,ox-LDL诱导的HUVECs模型组TNF-α、IL-1β、IL-6水平显著升高,差异具有统计学意义(P<0.05);与模型组比较,Ang(1-7)组TNF-α、IL-1β、IL-6水平显著下降,差异具有统计学意义(P<0.05);而与Ang(1-7)组相比,A779组显著升高,差异均具有统计学意义(P<0.05)。

表2 HUVECs的TNF-α、IL-1β、IL-6水平
与对照组比较:*P<0.05;与模型组比较:**P<0.05;与Ang(1-7)组比较:#P<0.05。
3 讨论
AS作为一种常见疾病,可以在人体内存储多年,却无任何病态显现,然后会引起突发性局部组织缺血、心绞痛、心肌梗死、中风或心力衰竭等症状[5-7],严重影响人类的健康,已成为死亡的主要原因之一[1]。Ang(1-7)是由Asp-Arg-Val-Tyr-Ile-His-Pro组成的一种具有生物活性的肽[2-3],在多种病理生理过程中拮抗Ang II,对于RAS系统过度激活所导致的病变起保护作用,如高血压、心力衰竭和AS等[8-12]。
内皮功能失调是AS发生的重要机制之一,包括NO合成明显减少、内皮源性血管舒张和收缩因子失衡。血管内皮细胞不仅是Ang(1-7)的产生部位,还是其作用的主要靶点。研究发现,Ang(1-7)具有内皮依赖性血管舒张活性,通过与VEC结合刺激NO、缓激肽或内皮舒张因子产生[13-15]。本研究结果证实,在ox-LDL诱导的人脐静脉内皮细胞中,Ang(1-7)可通过调节内皮型eNOS活化,诱导NO释放,发挥调节内皮功能,保护动脉粥样硬化损伤,并且这些作用能被Ang(1-7)的特异性拮抗剂(A779)全部阻断。
自Ross[16]提出AS是一种慢性炎症性疾病之后,炎症在AS发生发展中的作用逐渐得到公认。TNF-α、IL-1β、IL-6均是参与局部动脉斑块和外周血循环的炎症标志物,参与调控细胞的存活、增殖、死亡等多种功能[17-18]。本研究结果显示,Ang(1-7)可拮抗ox-LDL诱导的人脐静脉内皮细胞炎症因子TNF-α、IL-1β、IL-6的表达,减少细胞凋亡,发挥了抑制炎症的作用,而这种作用能被Ang(1-7)的特异性拮抗剂A779阻断。
综上所述,本研究采用ox-LDL诱导人脐静脉内皮细胞损伤模型,分别用Ang(1-7)、A779进行干预,观察过表达和阻断Ang(1-7)后各组细胞存活和凋亡情况,Ang(1-7)的含量,NO、eNOS水平,以及相关炎性因子TNF-α、IL-1β、IL-6的表达。结果表明,Ang(1-7)可调节eNOS活化,诱导NO释放,并减少TNF-α、IL-1β、IL-6等炎症因子的释放,明显降低ox-LDL诱导的人脐静脉内皮细胞凋亡和损伤的作用,具有抗AS的作用。

