渭河干流和秦岭北麓典型支流底栖动物群落结构及水质生物评价*
杨海强,潘保柱,朱朋辉,蒋万祥,蒋小明,侯易明
(西安理工大学西北旱区生态水利国家重点实验室,西安 710048)
渭河是黄河的第一大支流,担负着供水、灌溉、生态、旅游等功能,在区域经济发展中具有重要的地位. 秦岭为典型生态交错带,发源于其北麓的溪流为渭河南岸的支流,孕育了许多珍稀保护水生生物,是我国重要的生物多样性保护基地,也是居民生活生产的水源地. 然而近些年来,由于气候干旱和人类活动的加剧,渭河面临着水量减少、水质退化、生物多样性降低等问题[1-2]. 秦岭北麓地区由于水利工程的建设、区域经济的发展及现代化进程的加剧,使得自然水文情势及水环境特征发生改变[3]. 而水生生物受水文情势、水体理化特征等多种环境因素的综合影响,其群落结构对环境变化的响应具有高度敏感性,能快速反映不同时空尺度上水体的变化特征,是表征河流生态环境状况的重要指标[4-6].
在水生生物中,生活史的全部或大部分时间生活于水体底部且个体大于500 μm的水生动物群被称之为大型底栖无脊椎动物或大型底栖动物[7]. 大型底栖动物移动能力较弱,生活史较长,各个类群的生境倾向性差异很大,群落结构能够很好地指示水体环境质量,被广泛用于环境响应分析[8-10]及水生态系统健康评价的研究中[11-14]. 在温暖湿润的区域,受人类干扰小的自然河流大型底栖动物群落明显特征是生物多样性相对较高、生物量相对较大[15-16],而少雨干旱、年内一定时期温度较低的区域(如渭河流域),底栖动物一般资源量较低. 渭河干流因其特有的地理位置、气候条件以及人类活动的影响致使其突显出高含沙、污染较重等特点,以致水生态环境比较脆弱;源于秦岭的溪流对维系渭河流域生物多样性起着举足轻重的作用,然而近年来由于水电站建设、挖沙、部分生活污水流入等原因导致某些河段生态状况堪忧. 鉴于大型底栖动物对水生态健康水平的良好指示作用以及渭河干流和秦岭北麓溪流的重要性,以底栖动物作为指示生物全面系统地评估此区域的水生态健康水平是非常有必要的. 然而,仅殷旭旺等在渭河流域开展过底栖动物群落结构及水体环境分析的相关研究[17-18],其绝大多数样点布设于渭河北岸支流,渭河干流和秦岭北麓支流仅布设15个样点,且每个样点只采集了2个平行样品,由此可见,以往研究比较薄弱,不足以全面地了解渭河干流及源于秦岭北麓支流的生态环境现状.
鉴于此,本研究选取渭河干流全河段及发源于秦岭北麓的5条支流作为研究对象,于2017年10月及2018年5月开展了系统的、大尺度的水环境和水生生物调查研究. 本文的研究目标为:1)摸清渭河干流及秦岭北麓典型支流大型底栖动物的群落特征;2)分析渭河干流及秦岭北麓典型支流大型底栖动物群落差异及其成因;3)以大型底栖动物作为指示生物对渭河干流及秦岭北麓典型支流进行水质生物学评价.
1 研究区域与方法
1.1 研究区域概况及样点设置
渭河是黄河最大的支流,发源于甘肃省渭源县鸟鼠山,主要流经甘肃省的天水市、陕西省的宝鸡、咸阳、西安、渭南等地,至渭南市潼关县汇入黄河,全长818 km,流域面积13.43万km2. 该流域位于东西走向的秦岭北部,其上段流经黄土高原沟壑区,挟带大量的泥沙,河道山峡相间纵横,下段主要为秦陇山区,流域地貌复杂. 渭河年际径流量变化表现为北部大,南部小;季节变化明显,干流以秋季流量最大,约占年径流的38%~40%[19]. 近些年来,渭河流域非点源污染物排放量增大,加上关中地区水资源缺乏,大多数城市供水,工农业用水主要来源于渭河干流和支流,导致渭河生态需水量减少且多年来生态环境建设不足,严重降低了渭河的生态自净能力[20-21].
本研究于2017年10月及2018年5月共两次以渭河干流和秦岭北麓的石头河、黑河、灞河、石堤河、罗敷河5条典型支流作为研究对象,开展了系统的、大尺度的生态调查. 在具有不同生境、流速、水深的地方布设具有代表性的采样点,干流共设15个采样点,每条支流各设5个采样点,每个采样点均采集5个平行样品,两次调查共采集到400个样品. 研究区域及调查河流见图1.

图1 渭河干流及秦岭北麓支流采样点分布 (W-渭河干流,ST-石头河,H-黑河,B-灞河,SD-石堤河,LF-罗敷河)Fig.1 Distribution of sampling sites in the Weihe River mainstream and its tributaries from the northern Qinling Mountains
1.2 样品采集与处理
在各个水生态调查位点处选取河流代表河段100 m范围内,用筛网孔径420 μm、网口宽度30 cm的手持D型网采集大型底栖动物,每个样方面积为0.3 m2. 采集到的底栖动物于室内进行人工挑拣,分拣出的底栖动物标本放入50 mL的样品瓶中,并加入浓度为75%的酒精固定. 将样品带回实验室后依照国内外相关参考资料在体视镜和显微镜下进行种类鉴定[22-24]、计数和称湿重. 鉴定完成的底栖动物,继续放回样品瓶中,方便后期鉴定和复核.
1.3 环境因子测定
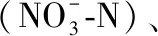
1.4 水质生物评价
利用Margalef丰富度指数(R)和生物指数BI进行水质生物评价[28].
(1)
式中,ni是样本中第i种的个体数;ti是样本中第i个分类单元的耐污值;N是样本总个体数.
参考Karr等[29-32]使用的水质生物评价指数值与分值的转化方法,计算BI指数水质评价分级标准. 具体选择方法为:应用所有样点的BI值,通过频数分析,以5%分位数对应的值作为标准,小于该值表示水质最清洁(Ⅰ),对大于该值至最大值的数值四等分,分值从小到大依次分别代表清洁(Ⅱ)、轻污染(Ⅲ)、中污染(Ⅳ)和重污染(Ⅴ). 计算使用的大型底栖动物耐污值参考文献[33-36].
1.5 数据分析
采用Shannon-Wiener多样性指数(H′)[37]、Margalef丰富度指数(R)[38]和Pielou均匀度指数(J)[39]分析渭河流域底栖动物的多样性;用Berger-Parker优势度指数(Y)判定优势度[40]:
(2)
R=(S-1)/lnN
(3)
J=H′/log2S
(4)
Y=Pi·fi
(5)
式中,S为样本中的总物种数;N为总个体数;Pi=ni/N,ni为第i种个体数,Pi为第i种在总数量中的比例;fi为该种出现的样点数占总样点的百分比.Y≥ 0.02时,该种即为优势种.
对渭河干流和秦岭北麓典型支流的两次大型底栖动物采样数据做平均处理,用两个季度的平均值反映底栖动物一整年的情况. 对服从正态分布的数据,使用单因素方差分析(One-way ANOVA)比较环境参数、生物多样性指数、底栖动物不同种类类群的密度和生物量在不同河流间(渭河干流和5条支流)的差异性. 若组间差异显著,则用LSD法(方差齐性)和Games-Howell法(方差不齐)进行多重比较. 对不服从正态分布的数据则利用Kruskal-Wallis Test(H)进行非参数检验. 最后,采用Pearson相关性分析和多元线性逐步回归分析(Multiple linear regression analysis)探究底栖动物的群落特征与环境因子的关系. 以上分析均在IBMSPSS 25.0软件中进行. 绘图使用的软件为OriginPro 9.1.
2 结果
2.1 水环境特征
本次调查共监测环境因子19项,调查结果如表1. 对不同河流间环境因子的差异性分析表明,水温、浊度、电导率、pH、总磷、总氮、氨氮、硝酸盐氮、淤泥、沙和卵石底质等环境参数在渭河干流及秦岭北麓典型支流间具有显著差异(P<0.01),而其他环境参数在调查河流间的差异不显著(P>0.05).
表1 渭河流域调查河流的环境参数*
*同一行上标不同小写字母表示存在显著差异(P<0.05).
2.2 底栖动物物种组成
调查期间于渭河干流及秦岭北麓典型支流40个样点采集并鉴定大型底栖动物210种,隶属于5门8纲75科187属,其中节肢动物192种(昆虫纲187种,蛛形纲1种,甲壳纲4种),环节动物11种(寡毛纲9种,蛭纲2种),软体动物5种,扁形动物1种,线虫动物1种.
在渭河干流与5条秦岭北麓典型支流的大型底栖动物中,底栖动物的物种数表现为支流多于干流,且以水生昆虫为绝对优势的类群. 渭河干流底栖动物物种数为68种,水生昆虫占84.1%;石头河的物种数为107种,水生昆虫占89.7%;黑河的物种数为109种,水生昆虫占91.7%;灞河的物种数为80种,水生昆虫占88.8%;石堤河的物种数为70种,水生昆虫占88.6%;罗敷河的物种数为63种,水生昆虫占87.3%.
由优势度指数分析表明(表2),四节蜉属一种(Baetissp.)在6条河流中均为绝对优势种,霍甫水丝蚓(Limnodrilushoffmeisteri)作为优势种均出现在渭河干流、灞河及石堤河中,韦特直突摇蚊(Orthocladiuswetternsis)作为优势种均出现在渭河干流及灞河中,其余优势种在调查河流中仅出现1次.

表2 渭河流域调查河流中底栖动物的优势种
2.3 底栖动物的密度和生物量
渭河干流和秦岭北麓典型支流中大型底栖动物各种类类群的密度、生物量及百分比如表3所示,调查发现,底栖动物总密度和昆虫纲的密度表现为石头河最高、渭河干流最低;在6条调查河流不同种类类群中,对水环境质量具有良好指示作用的EPT类(E:蜉蝣目,P:襀翅目,T:毛翅目)均为绝对优势的类群,密度和生物量占比均以罗敷河最高,分别达78.3%和92.1%. 对调查河流不同河流间各种类类群差异性分析显示,寡毛纲的生物量、腹足纲的密度和生物量在调查河流间无显著差异(P> 0.05)外,其他种类类群的密度和生物量在调查河流间均具有显著差异(P< 0.05).

表3 渭河流域调查河流底栖动物各类群的密度(ind./m2)和生物量(g/m2)以及其占比*
2.4 生物多样性
在渭河干流中,H′、R和J的均值分别为1.16、1.69和0.77,范围分别在0.27~2.07、0.47~3.16和0.51~0.97之间. 在发源于秦岭北麓典型支流中,H′、R和J均值分别为1.86、3.28和0.74,范围分别在0.93~2.85、1.42~6.73和0.53~0.90之间. 在空间尺度上,调查河流中H′和R变化规律表现出高度的一致性(图2),且除J的差异性在不同河流间不显著外(P> 0.05),H′和R的差异性均极显著(P< 0.001). 在具体河流中,石头河、黑河的H′和R指数值要明显高于其他河流,且5条秦岭北麓典型支流的H′和R指数值均高于渭河干流.

图2 调查河流各采样点底栖动物多样性指数Fig.2 Macroinvertebrate diversity indices of each site in studied rivers
2.5 水质生物学评价
2.5.1 基于Margalef丰富度指数的水质评价 由Margalef丰富度指数水质等级划分标准(表4)进行的水质评价结果显示(图3),在渭河干流和秦岭北麓典型支流的40个样点上,最清洁(Ⅰ)、清洁(Ⅱ)、轻污染(Ⅲ)和中污染(Ⅳ)的样点数量分别为9个、12个、3个和16个,水质评价等级为重污染(Ⅴ)的样点数为0个. 从调查河流不同河流间来看,渭河干流水质较差,水质等级处于轻污染(Ⅲ)及以上的样点仅占27.0%;秦岭北麓溪流中的石头河、黑河、灞河、石堤河水质较好,水质等级处于清洁(Ⅱ)及以上的样点均占80%.
2.5.2 基于底栖动物BI指数的水质评价 根据水质生物评价指数值与分值的转化方法,计算得出BI指数最小值为2.45,最大值为8.22,5%分位数为2.47,再由水质评价分级标准划分水质等级,得出BI指数的水质评价标准(表4).
由BI指数法进行的水质评价结果显示(图3),在渭河干流和秦岭北麓典型支流的40个采样点中,水质评价为最清洁(Ⅰ)、清洁(Ⅱ)、轻污染(Ⅲ)、中污染(Ⅳ)和重污染(Ⅴ)的采样点数量分别为2个、16个、13个、6个和3个. 从不同调查河流间来看,渭河干流比秦岭北麓典型支流水质明显要差,大多数采样点水质为轻污染(Ⅳ)到重污染(Ⅴ),污染较为严重;秦岭北麓典型支流的水质明显要好,在5条支流的25个采样点中,有64.0%的采样点水质等级处于清洁(Ⅱ)及以上.

表4 生物评价指数与水质等级划分标准
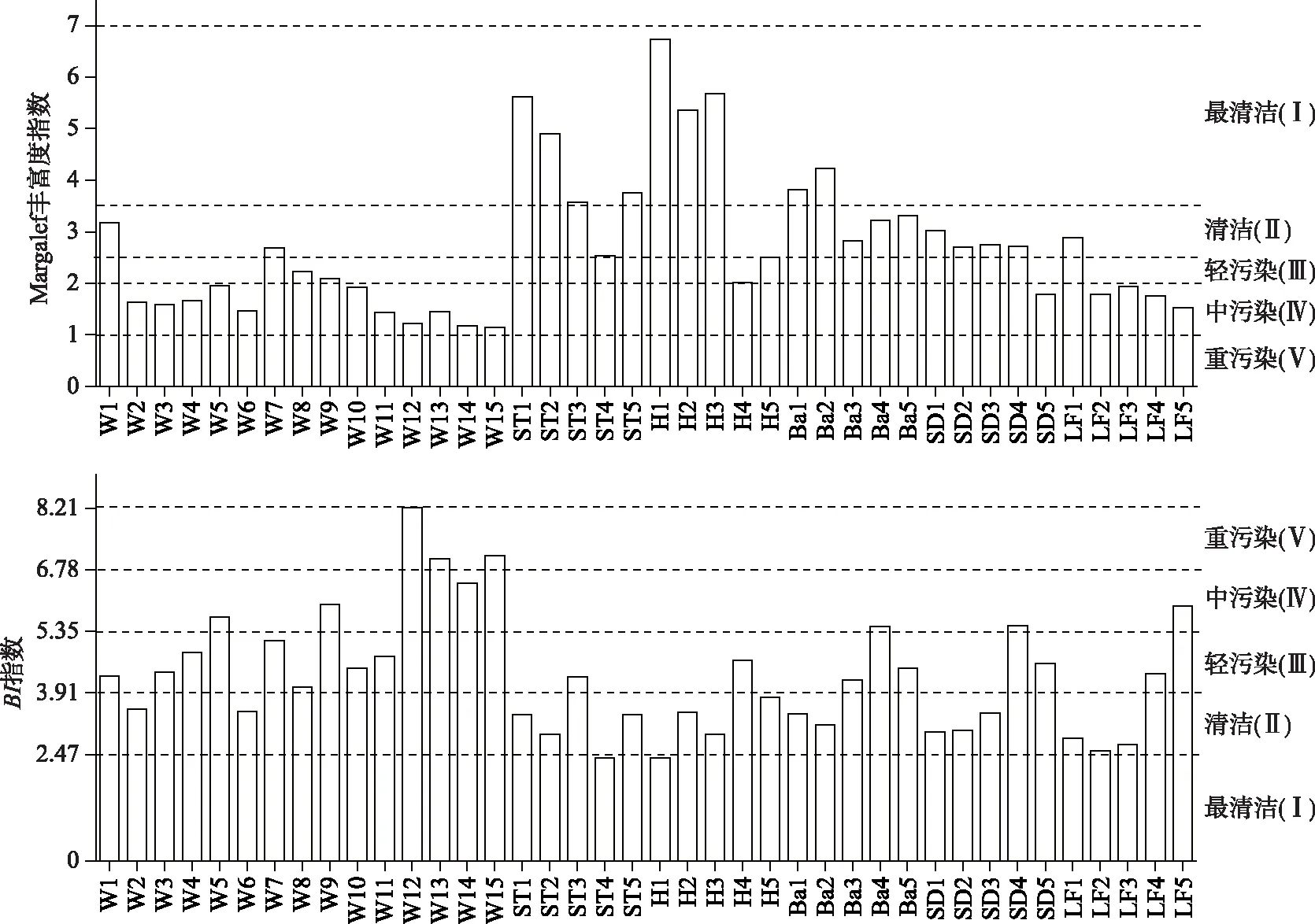
图3 Margalef丰富度指数和BI指数水质评价结果Fig.3 Results of water quality evaluation by Margalef index and BI method
2.6 底栖动物与环境因子的相关性分析
大型底栖动物的群落特征与环境因子的Pearson相关性分析(表5)表明,水温、浊度、流速、电导率、溶解氧、pH、总氮、氨氮、硝酸盐氮、叶绿素a等水环境因子以及淤泥、沙、卵石和大石等底质因子对底栖动物的群落特征具有显著影响(P< 0.05),其他环境因子对底栖动物群落特征影响不显著(P> 0.05).
通过多元逐步回归分析筛选出对渭河流域底栖动物密度、生物量、多样性指数和BI指数变化相对重要的水环境参数,建立最优多元线性回归方程. 由表6可知,底栖动物密度的回归方程有淤泥1个因子入选;底栖动物生物量的回归方程有电导率1个因子入选;底栖动物的H′有硝酸盐氮、pH、浊度和流速共4个因子入选;底栖动物的R有硝酸盐氮、pH、氨氮、大石共4个因子入选;底栖动物的J有流速1个因子入选;BI指数有叶绿素a、淤泥和氨氮共3个因子入选. 方程的第一个自变量是因变量的绝对影响因子,表明淤泥、电导率、硝酸盐氮、流速、叶绿素a这5种环境因子对底栖动物群落特征变化起决定性作用. 经F检验,方差分析F值的显著水平P<0.05,表明回归显著.

表5 渭河流域调查河流底栖动物群落特征与环境因子的相关系数(r)和概率水平(P)

表6 底栖动物群落特征与环境因子的逐步回归分析
3 讨论
3.1 渭河干流及秦岭北麓典型支流大型底栖动物群落结构特征
渭河流域共鉴定大型底栖动物210种,水生昆虫占89.0%,这与殷旭旺等[18]于2013年在渭河全流域共45个样点的调查结果相似(水生昆虫占78.4%),但本研究所鉴定的物种数要高于其调查的116种,这可能归因于秦岭水系中底栖动物的多样性高. 研究发现,调查河流中不同河流间的优势种具有较大的差异性,渭河干流、石头河均有5种优势种,黑河有3种优势种,灞河、石堤河有4种优势种,罗敷河优势种较少,仅2种,四节蜉属一种(Baetissp.)作为优势种均出现在6条河流中. 5条源于秦岭北麓典型支流的物种数(平均86种)要高于渭河干流的69种,丰富度指数和多样性指数也都高于渭河干流,这说明了秦岭山区支流的大型底栖动物生物资源量较为丰富,生态环境质量要好于渭河干流. 密度和生物量是衡量底栖动物现存量的重要指标[41],渭河干流底栖动物的密度和生物量为125.6 ind./m2和0.289 g/m2,而支流底栖动物的密度和生物量处于159.1~616.3 ind./m2和0.376~5.265 g/m2之间,并且EPT类水生昆虫是造成干支流密度和生物量具有显著差异的主要类群. 渭河干流及秦岭北麓典型支流底栖动物群落组成具有很大区别,这主要归因于干支流的自然背景及人类活动造成的污染不同.
3.2 渭河干流及秦岭北麓典型支流大型底栖动物与环境因子的关系
大量研究表明,底质是影响大型底栖动物群落分布的重要环境因子,因为绝大多数底栖动物都需要依附于底质度过其大部分的生活史[42]. 相关性分析结果显示,淤泥底质显著降低了渭河干支流底栖动物的现存量和多样性水平(P<0.05),而卵石和大石等大石块底质类型对底栖动物的生物量及多样性水平呈显著的正相关关系(P<0.01). 在本研究中,渭河干流样点的底质类型多以淤泥和沙为主,这种细碎的底质以及简单的小生境会直接降低EPT类底栖动物的现存量. 而支流样点则具有较多的卵石及大石,微生境异质性高,为大型底栖动物提供了更多的生存空间以及捕食、避难和产卵场所[43],这些都有助于底栖动物抵御外界环境的干扰并维系其较高的多样性及丰富度水平. 河流中的大型底栖动物受水体污染胁迫的响应比较敏感,水质的改变会影响其群落的时空分布[44]. 一般而言,水体透明度越高,底栖动物的生物多样性越高. 浊度是通过影响光照透射率从而影响附着藻类和浮游植物的生长,最终影响以此为食的底栖动物[45-46]. 本研究也发现,底栖动物的多样性指数与浊度呈极显著的负相关关系,浊度水平较低的秦岭北麓支流底栖动物的多样性和丰富度指数均要高于渭河干流. pH过高或过低都会影响底栖动物的生存,多数大型底栖无脊椎动物喜生存于略偏碱性的水体中,而酸性水体对其生存不利[47-48]. 渭河干流及秦岭北麓5条典型支流pH的差异性不大(pH 7.6~8.5),水体均呈弱碱性,说明渭河流域水体的酸碱性在一定范围内是适合底栖动物生存的.
相关性分析结果表明,pH与H′和R指数具有极显著的正相关关系,说明水体的酸碱性对维持底栖动物群落结构的稳定性具有重要意义. 水体中溶解的各种阴阳离子的浓度决定了水体电导率的高低,而较多的研究也证明水生生物类群受电导率的影响显著,特别是对底栖动物物种生存和群落结构的稳定性[49-50]. 殷旭旺等[18]在渭河流域底栖动物的研究中发现电导率显著影响了底栖动物的空间分布,本文的研究结果也证实了这一结论. 除此之外,本文研究结果发现电导率与BI值呈极显著的正相关关系,说明底栖动物对电导率的变化反应较敏感,使得水体中耐污耐受性物种增多. 这与赵茜等对浑太河流域底栖动物的研究结果一致,电导率的升高显著降低了大型底栖动物敏感物种的的出现频率[51].
本研究调查的40个样点水质监测的结果表明,渭河干流及5条支流中水体N、P等营养盐水平较高,人为干扰造成的营养盐污染较为严重,且干流受污染程度要高于支流. 四节蜉往往在轻度污染的水体中占优势,而颤蚓和摇蚊幼虫容易在中度-重度污染水体中占优势[28]. 在调查河流中四节蜉作为绝对优势的物种出现,霍甫水丝蚓和摇纹幼虫作为优势种均出现在了N、P浓度最高的渭河干流、灞河和石堤河中. 襀翅目、线虫等清洁种则只出现在水质较为清洁,人类干扰较小的支流中,在渭河干流中没有分布. 这表明人类干扰已对渭河干支流底栖动物群落结构特征产生了较大的影响. 研究结果也显示,N、P等营养盐水平与底栖动物的多样性指数呈负相关关系,硝酸盐氮浓度是影响底栖动物多样性指数和丰富度指数的绝对影响因子,说明调查河流水体营养盐污染导致了底栖动物生物多样性的降低.
N、P等营养盐水平的变化在一定程度上也会影响藻类的生长,而叶绿素a浓度作为衡量藻类密度及生物量的重要指标之一,与藻类含量变化密切相关. 水体中适量的藻类可以为底栖动物提供充足的食物来源,促进其生长和繁殖,提高物种丰度和生物量;而藻类含量到达一定阈值后,含量越高溶解氧浓度会越低,会致使底栖动物敏感种的多样性和物种丰富度下降[52]. 相关性分析表明,叶绿素a与底栖动物的物种多样性呈极显著的负相关关系(P<0.01). 但本研究发现,调查河流的溶解氧浓度较高(平均值9.2 mg/L),且叶绿素a浓度与溶解氧浓度之间并无明显的相关性(r=0.077,P=0.637);但与电导率、总氮和硝酸盐氮浓度呈显著正相关(P<0.05),与水深、流速呈显著负相关(P<0.05). 说明叶绿素a浓度的变化并不是造成底栖动物多样性降低的直接原因. 推测其原因,一方面这可能是因为喜急流、高溶解氧的EPT类的物种多样性会随着流速的降低、水深的增加而发生明显下降,另一方面还是因为营养盐水平的增高以及电导率的增加造成底栖动物整体多样性的降低. 此外,本文研究结果发现,调查河流中底栖动物的群落特征与水深、水温、流速、溶解氧等水环境因子没有明显的相关关系,这主要是因为这4种水环境因子在采样点间的变化梯度差异性不大造成的.
3.3 渭河干流及秦岭北麓典型支流水质生物评价
水质生物评价是指通过对水体中水生生物的调查或对水生生物的直接检测来评价水体的生物学质量[53]. 本文选用底栖动物Margalef丰富度指数和BI指数对渭河干流及秦岭北麓典型支流的水体进行评价. 评价结果显示,渭河干流水质基本呈轻度-中度污染状态,5条秦岭北麓典型支流基本呈无污染-轻度污染状态. 水质评价结果既有相似性又有差异性. 在渭河流域的40个采样点上,两种水质评价结果趋势相同,有27.5%的采样点2种水质评价结果一致,有92.5%的采样点水质评价等级差异不超过两级,具体差异为Margalef丰富度指数法水质评价结果稍微优于BI指数法. 从渭河干流与支流间来看,2种水质评价结果均显示秦岭北麓典型支流水质要好于渭河干流. 群落丰富度指数法的水质评价结果显示,石堤河和灞河中的采样点水质评价等级多为清洁(II)及以上,而BI生物指数法却显示2条河流的水质评价多为轻污染(III)及以下. 造成2种评价结果差异的原因主要是两种水质评价方法的评价方式和评价内容不同. 物种多样性指数水质评价方法是通过研究群落中各物种的组成情况来反映水体受环境污染的胁迫对群落造成的影响,而BI指数既考虑了底栖动物的物种多样性又考虑了底栖动物的耐污能力[54]. 石堤河和灞河的物种丰富度指数值相对较高,说明了河流中底栖动物的物种数较为丰富;但BI指数值也高,说明在这2条河中底栖动物的敏感性相对于秦岭水系的其他河流整体较低、耐受性相对较高. 底栖动物行动缓慢、生活场所比较固定,对逆境的逃避较缓慢. 虽然EPT类等清洁物种会随着污染程度的增加而逐渐消失,但是摇蚊类、霍甫水丝蚓、软体动物等耐污值较高的物种却会在不健康的水环境中存活下来并繁殖,这样就使得丰富度指数变化幅度不大. 结合理化监测数据来看,石堤河和灞河的总氮、硝酸盐氮浓度和电导率等相对于其他支流较高,这与BI指数反映出的水质结果具有一致性. 这也在一定程度上可以说明,相对于Margalef丰富度指数法,BI法水质评价结果是对水环境质量更为真实的反映. 因此,河流的水质生物评价应该在多样性指数评价的基础上与生物指数评价相结合,并参考水环境参数检测结果,才能更全面更可靠地体现大型底栖动物对流域水生态环境的指示情况.

