富营养化对湖泊消费者群落碳源和氮源的影响
——以白洋淀为例*
秦 珊,崔建升,2,申立娜,张璐璐,2**,剧泽佳,付 雨
(1:河北科技大学环境科学与工程学院,石家庄 050018) (2:河北省污染防治生物技术实验室,石家庄 050018)
我国是一个多湖泊的国家[1],目前共有1.0 km2以上的自然湖泊2693个,约占全国国土面积的0.9%[2]. 湖泊在维护区域生态与环境安全方面具有特殊地位[3],其作为具有明确边界的独立生态系统,极易受到环境变化的影响[4]. 然而,近年来随着社会经济发展以及人为活动增强,湖泊富营养化趋势加剧[5-6]. 据2017年水利部水资源公报,在全国117个监测湖泊中,富营养化湖泊占76.9%[7]. 值得关注的是,富营养化会改变湖泊食物网结构,进而影响湖泊生态系统的功能(能流和物流)[8-12].
国际湖沼学的长期研究发现,一个完整的湖泊食物网应包括底栖食物网和浮游食物网[13]. 在底栖和浮游食物网关系研究中,Vadeboncoeur等建立了相互独立、种间资源竞争、物质传递和相互耦合4种关系的概念模型[14],实证研究结果表明鱼类是湖泊中底栖和浮游食物网的整合者. 在鱼类的食物来源中,浮游动物占20%,底栖动物占48%[15];此外,浮游藻类和底栖动物间的捕食关系等都证明了底栖-浮游食物网为相互耦合关系. 如:在美国密歇根湖,沉降的浮游藻类是底栖端足类(Amphipoda)的主要碳源[16],而这些端足类的生物量占底栖无脊椎动物总生物量的65%,同时端足类也是浮游鱼类的主要食物来源[17]. 而营养条件变化会显著改变底栖-浮游食物网的结构和功能[18],进而影响湖泊生态系统的能流和物流,特别是在底栖-浮游食物网耦合关系较紧密的浅水湖泊中,这种影响尤为显著. 如:在贫营养条件下,浅水湖泊是以底栖初级生产力为主,底栖藻类占比高达80%~98%;而在富营养化条件下,则向以浮游初级生产力为主转变,浮游藻类占比接近100%[19],浮游藻类生物量的增加会显著增强底栖动物与浮游藻类的耦合关系[20]. 可见,湖泊富营养化会显著改变底栖生物群落与浮游生物群落之间的能流和物流关系.
湖泊富营养化对湖泊生态系统能流和物流的影响存在不确定性[21],目前研究多关注富营养化对浅水湖泊食物网结构的影响[18],而有关富营养化对湖泊消费者群落碳源和氮源的影响及其时空分异特征则较少关注. 近年来,碳、氮稳定同位素技术被用于定量分析生态系统中的能量流动和物质循环[22-23]. 通过比较消费者和潜在食物来源之间的碳、氮稳定同位素比值,可定量估算消费者不同食物来源的相对贡献[24]. 白洋淀作为华北地区最大的浅水草型湖泊,在维持区域生物多样性和生态安全中发挥着重要的作用[25]. 近年来由于自然因素和人为干扰的影响,白洋淀总体营养状态呈现轻度-中度富营养[26]. 目前有关白洋淀富营养化对消费者种群碳源和氮源的影响尚未研究. 鉴于此,本研究于2018年4月(平水期)和8月(丰水期)在白洋淀32个采样点进行样品采集,分别收集水体、沉积物、浮游和底栖生物样品,基于碳、氮稳定同位素分析技术,分析白洋淀消费群落碳源和氮源贡献百分比的时空分布特征,揭示富营养化对白洋淀生态系统能流和物流的影响,为白洋淀生态系统修复提供数据和理论支撑,也为构建蓝绿交织的雄安新区提供生态保障.
1 材料与方法
1.1 研究区概况
白洋淀是华北地区最大的内陆浅水湖泊,由藻苲淀、马棚淀、腰葫芦淀等143个大小不等的淀泊组成,总面积366 km2,平均水深2~4 m[27-30]. 白洋淀有8条主要入淀河流,其中仅府河和孝义河常年有水,来水均为城镇污水处理厂处理后尾水[31]. 本研究在白洋淀8个区共选取了32个采样点(图1),分别采集浮游生物、底栖生物和鱼类等生物样品,以及水体和沉积物样品.

图1 白洋淀采样点分布(Ⅰ-藻苲淀区,Ⅱ-南刘庄区,Ⅲ-烧车淀区,Ⅳ-枣林庄区,Ⅴ-光淀区,Ⅵ-圈头区,Ⅶ-采蒲台区,Ⅷ-端村区)Fig.1 Distribution of sampling sites in Lake Baiyangdian
1.2 样品的采集与处理
在2018年4月和8月,分别采集了白洋淀32个样点的表层水体、沉积物、浮游植物、浮游动物、沉水植物、底栖藻类、底栖大型无脊椎类动物和鱼类. 沉水植物样品用镰式采草器在水样采样点的周围采集;在采样点用采水器采集浮游动物和浮游植物样品,分别经112 μm和64 μm孔径浮游生物网过滤,得到的浮游动物(个体>112 μm)和浮游植物样品(大小为64~112 μm)[12];底栖藻类采用人工放置基质的方法采集[12]. 将采集的沉水植物、底栖藻类、浮游动物和浮游植物低温保存后带回实验室[32],用10%盐酸酸化处理,然后用蒸馏水清洗干净,在-70℃下冷冻干燥72 h至恒重,用研钵研磨成均匀粉末后放入细菌保存管中保存[12];鱼类样品均来自当地渔民直接捕捞或垂钓,将采集的鱼样现场密封充氧气后运回实验室进行前处理,常温下将鱼样分类平摊拍照并鉴定其种类,测量并记录鱼体体长和体重(表1和表2). 每尾鱼样测量全长、体重后,取背部白肌. 对于个体较小的鱼类,则测定其全鱼的同位素值[33]. 底栖大型无脊椎类动物利用改良的1/16 m2彼得森采泥器进行定量采样,根据相关方法对其进行鉴定、分类和计数[34-35]. 将鱼类和底栖大型无脊椎类动物在真空干燥仪中冷冻干燥至恒重(-70℃,72 h左右),使用研钵研至均匀粉末,放入干燥器中保存待测[36].
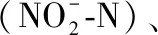
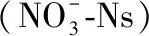
1.3 稳定同位素比值分析
所有生物样品均运用元素分析仪(Elementar Pyro Cube,德国)与美国Thermo公司的EA-DELTA plus XP稳定同位素比率质谱仪进行分析. 碳、氮稳定同位素标准值分别以拟箭石(VPDB)中的碳和纯化的大气中N2作为参考标准,碳、氮稳定同位素值(δ值)的计算公式分别为[40]:
(1)
(2)
为确保实验结果的精度和准确度,每测定10个样品插入1个标准样品,并随机挑选1~2个样品进行复测,分析精度为δ13C<0.2‰,δ15N<0.3‰. 样品测试分析均在中国科学院植物研究所完成.
1.4 数据处理与分析
1.4.1 营养级的计算 消费者和食物间的δ15N差异就是营养分馏值,随着营养级的增加δ15N不断增加,不同营养级间的δ15N富集的平均值为3.4‰. 营养级(TL)的计算公式为[41-42]:
(3)
式中,Δδ15N=3.4‰,δ15NConsumer是消费者δ15N测定值,δ15NBase是生态系统食物网的初级生产者或初级消费者的氮稳定同位素值(λ=1时,δ15NBase为初级生产者的δ15N值,λ=2时,δ15NBase为初级消费者的δ15N值),本研究根据Post[42]的建议选取螺类作为基线生物来计算各生物群落的营养级.
1.4.2 浮游和底栖生物对消费者群落氮贡献百分比的计算 运用同位素混合模型估算浮游生物对消费者群落食物来源的贡献,并比较消费者群落对底栖氮源和浮游氮源依赖程度的差异[42],计算公式为:
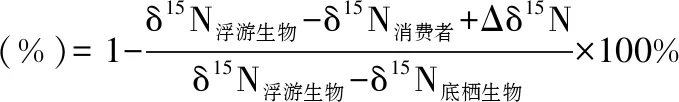
(4)
式中,Δδ15N表示每递增一个营养级的富集常数,通常假定为3.4‰;底栖生物的百分比(%)=1-浮游生物的百分比(%).
1.4.3 浮游和底栖生物对消费者群落碳贡献百分比的计算 运用稳定同位素混合方程可估算消费者群落碳源的百分比. 本研究运用二元同位素混合模型计算底栖/浮游生物对消费者群落碳源贡献百分比(f)[43-44],计算公式为:
(5)
式中,δ13C浮游生物初级生产者和δ13C底栖生物初级生产者是主要初级生产者的碳值;f浮游生物(%)=1-f底栖生物(%).
1.4.4 统计分析 进行统计分析前对数据进行正态分布检验与数据标准化转换的预处理,采用双变量Pearson等级相关系数识别消费者群落δ13C和δ15N值的驱动因子,采用单因素(One-way ANOVA)方差分析(P=0.05)对不同时间不同种类的水生生物和营养级进行差异性检验. 所有的数据处理及统计分析均在SPSS 24.0统计软件中进行[45],利用Origin 8.6软件进行绘图.
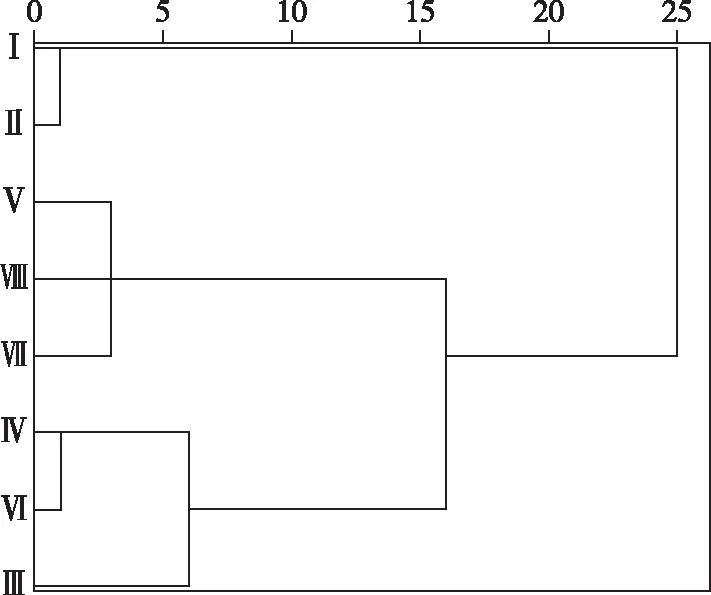
图2 白洋淀不同区域水体和 沉积物理化参数聚类图Fig.2 The cluster map of physical and chemical parameters of water and sediment in different areas of Lake Baiyangdian
2 结果与讨论
2.1 白洋淀3类生境理化参数时空分异特征
根据8个区域水体和沉积物理化参数,运用聚类分析将32个采样点分为3类生境(图2):第1类生境主要受城市污水影响(Ⅰ和Ⅱ区);第2类生境主要受养殖业和农村生活污水影响(Ⅴ、Ⅶ和Ⅷ区);第3类生境较少受人为干扰(Ⅲ、Ⅳ和Ⅵ区). 就水体和沉积物理化参数季节变化而言,除pH相对稳定外,COD、NH3-N、TN和TPs 4月高于8月,而其他理化参数的值则8月高于4月;就空间分布而言,T、WD,DO和TCs值在生境3中最高,而其他理化参数的值则在生境1中最高(图3). 由于2018年4月白洋淀实行生态补水,使8月白洋淀水位升高,有效降低了富营养化程度.

图3 白洋淀不同时空水体和沉积物主要理化参数Fig.3 Main physical and chemical parameters of water and sediment in different time and space in Lake Baiyangdian
2.2 白洋淀3类生境碳、氮稳定同位素值时空分异特征
2.2.1 白洋淀3类生境碳、氮稳定同位素值空间分异特征 δ13C通常用来判断生态系统中消费者的食物来源[46-47],不同食物来源的δ13C值存在差异. 本研究4月共采集16种消费者(表1、表2),生境1采集了3种,其δ13C值为-32.25‰~-28.37‰(均值-30.38‰±1.59‰);生境2采集了12种,其δ13C值为-33.49‰~-29.14‰(均值-31.47‰±1.38‰);生境3采集了15种,其δ13C值为-32.41‰~-28.56‰(均值-30.62‰±1.23‰)(图4). 对于同一消费者而言,如克氏原螯虾在生境3中的δ13C值最高(-30.14‰)其次为生境2(-30.48‰)和生境1(-30.52‰). 8月共采集19种消费者(表1、表2),其中生境1
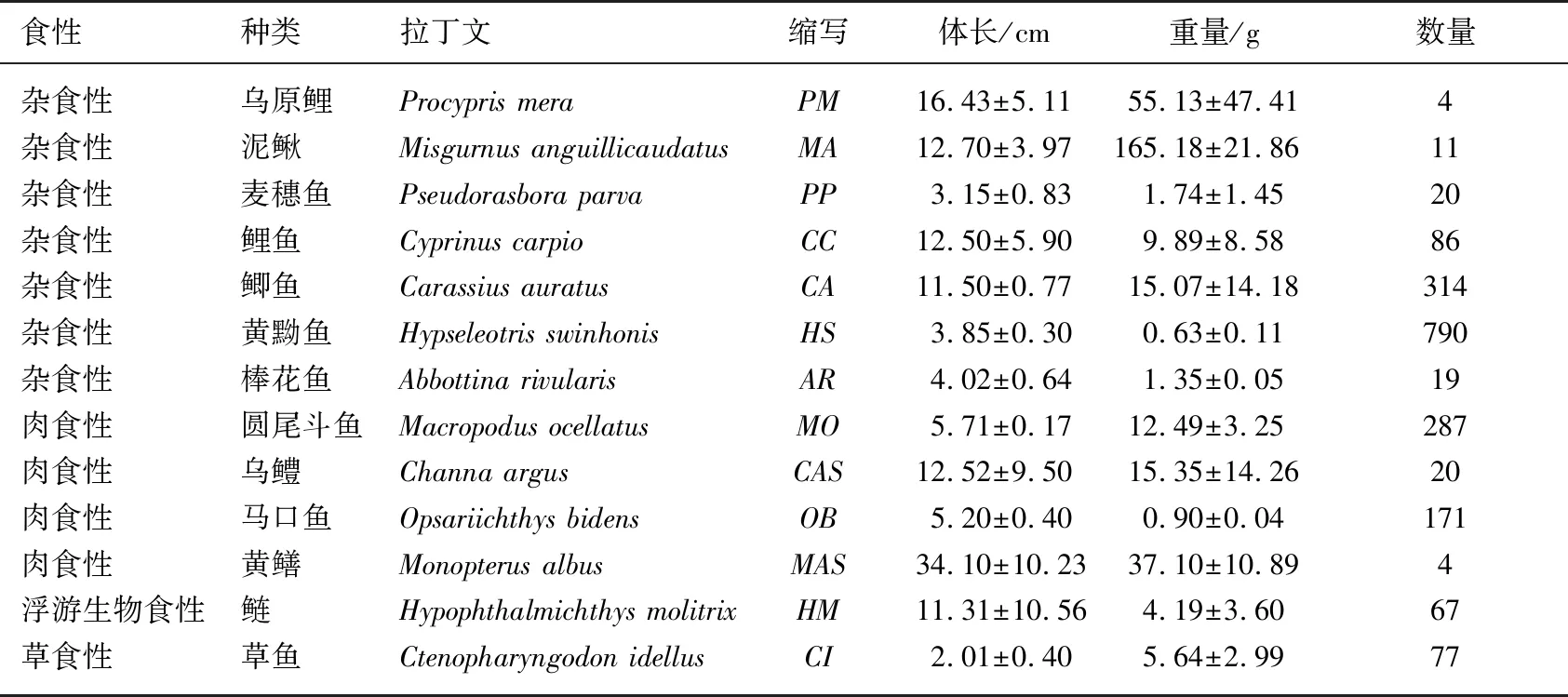
表1 白洋淀鱼类群落样品采集名录
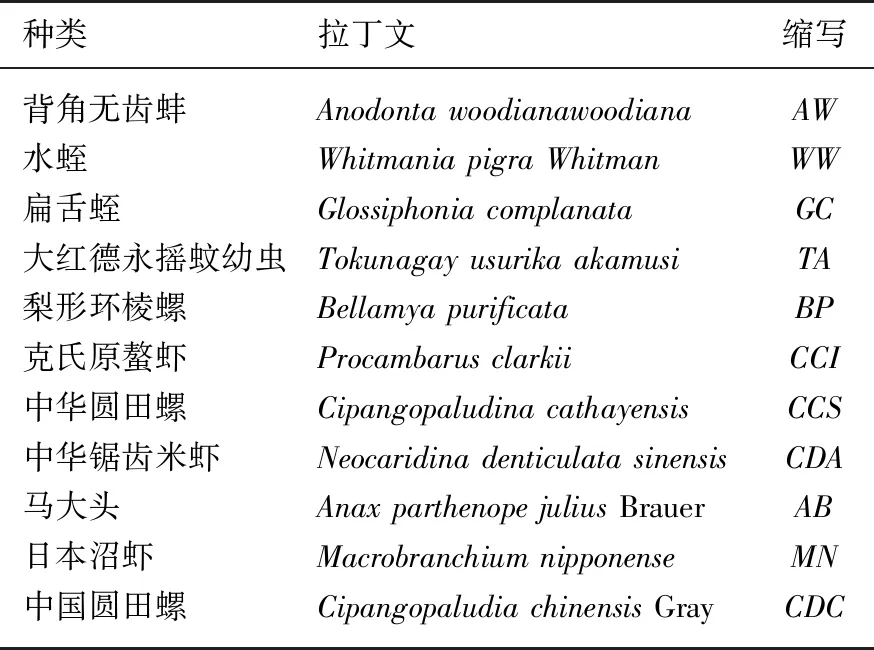
表2 白洋淀底栖动物群落样品采集名录
采集了8种,其δ13C值为-33.73‰~-26.66‰(均值-30.43‰±2.46‰),生境2采集了12种,其δ13C值为-31.80‰~-26.15‰(均值-29.20‰±1.66‰);生境3采集了15种,其δ13C值为-33.17‰~-25.19‰(均值-28.73‰±1.91‰)(图4). 对于同一消费者而言,如日本沼虾在生境1、生境2和生境3中的δ13C值分别为-29.81‰、-29.77‰和-28.54‰.
就消费者群落δ15N值而言:在4月,生境1的δ15N值 为12.61‰~14.36‰(均值13.64‰±0.75‰),生境2的值为7.06‰~13.62‰(均值10.68‰±1.99‰),生境3的值为6.31‰~12.51‰(均值9.76‰±1.88‰). 对于同一消费者而言,如鲤鱼δ15N值在生境1中最高(14.36‰),而在生境3中最低(8.71‰)(图4). 通过方差分析,结果表明3类生境消费者群落的δ15N值存在显著差异(F=3.362,P<0.05). 随着富营养化程度增加,从生境3到生境1的δ15N值逐渐偏正. 在8月,生境1的 δ15N值为11.01‰~15.34‰(均值12.46‰±1.36‰),生境2的值为9.05‰~14.80‰(均值12.22‰±1.80‰),生境3的值为8.13‰~15.99‰(均值11.47‰±2.26‰). 对于同一消费者而言,如梨形环棱螺的δ15N值在生境1最高(11.40‰),而在生境3最低(8.48‰)(图4). 人为活动引起的营养物质输入导致初级生产者δ15N值升高[48-49],通过捕食-被捕食关系,进而传递到整个食物网. 因而在白洋淀对同种消费者而言,δ15N值呈现显著的空间差异,其值在生境1中最高,而在生境3中最低.

图4 4月、8月不同生境底栖动物群落(三角形)和鱼类群落(正方形)的δ13C和δ15N值Fig.4 The δ13C and δ15N for consumer benthic communities (triangles) and fish communities (squares) in different habitats in April and August
2.2.2 白洋淀3类生境碳、氮稳定同位素时间分异特征 δ13C能够表征生物中碳元素的来源[50-51]. 4月白洋淀消费者群落的δ13C值为-33.49‰~-28.37‰,而8月为-33.73‰~-25.18‰,结果表明消费者群落8月的食物来源比4月更广[33]. 白洋淀消费者群落的δ13C值低于草海湿地食物链底栖动物(-27.40‰~-24.53‰)和鱼类(-26.10‰~-14.69‰)[52],这可能与地理环境和生态系统碳源的差异有关. 在4月,白洋淀消费者群落δ15N值(11.36‰±1.54‰)比胶州食物网(11.98‰±1.77‰)[48]和三峡水库鱼类的δ15N值(11.98‰±2.25‰)低[40];而在8月,白洋淀消费者群落的δ15N值(12.05‰±1.81‰)略高于胶州食物网(11.98‰±1.77‰)和三峡水库鱼类的δ15N 值(11.98‰±2.25‰). 在8月(丰水期),进入雨季,由河流向湖泊生态系统迁移的氮迅速增加[52-55],使沉水植物等初级生产者的δ15N值增大,通过食物网的传递,进而使白洋淀消费者的δ15N值增大. 运用单因素方差分析,不同季节消费者群落的δ13C值存在显著差异(F=5.752,P<0.05),而δ15N值未呈现显著差异(P>0.05),这与东洞庭湖鱼类的δ15N值[33]研究结果一致. 且消费者群落的δ13C和δ15N呈显著负相关(P<0.01);这与草海湿地食物链的[50](r=-0.423,P<0.01)研究结果一致,而与东太湖的研究结果却相反[56]. 相反的结果说明了不同湖泊同位素对环境变化的响应不同. 由于白洋淀受人为活动干扰较大,使得白洋淀中基底物质的氮同位素值变化较大[52].
2.3 白洋淀消费者群落营养级时空分异特征
2.3.1 白洋淀消费者群落营养级空间分异特征 在4月,消费者群落在生境1中的营养级为3.54~4.06,生境2中的营养级为1.91~3.84,生境3中的营养级为1.69~3.51. 对于同一消费者而言,如克氏原螯虾,其营养级在生境1(TL=3.94)中最高,其次为生境2(TL=3.46)和生境3(TL=3.28)(图5). 运用方差分析,结果表明3类生境消费者群落的营养级存在显著差异(F=3.348,P<0.05). 在8月,消费者群落在生境1中的营养级为2.38~3.66,生境2中的营养级为1.81~3.50,生境3中的营养级为1.53~3.85(图5). 同一消费者营养级在生境1最高,而在生境3中最低(图5). 这主要是因为生境1中处于强人为干扰,富营养化程度较高,城市污水的排放使消费者的δ15N值增高,因此消费者群落营养级会受生境条件的影响[57]. 人为干扰会影响水生生态系统中生物的营养级[40],例如鱼类营养级在强人为干扰的水库中要显著高于低人为干扰的水库[40],且消费者群落的δ15N值与农业生产、生活排放的污水呈较高的相关性[58].

图5 4、8月不同生境营养级Fig.5 Trophic level in different habitats in April and August
2.3.2 白洋淀消费者群落营养级时间分异特征 在生境1中,4月和8月未见同种消费者;生境2中同种消费者的营养级4月高于8月,但差异不显著;生境3中同种消费者营养级4月低于8月,但差异也不显著. 因此,白洋淀消费者群落营养级没有明显的季节变化,这与东洞庭湖鱼类的研究结果相同[33].
2.4 白洋淀浮游和底栖生物对消费者群落碳源和氮源贡献百分比的时空分异特征
4月和8月,白洋淀浮游生物对消费者群落氮源贡献百分比在生境1、生境2、和生境3中分别为45%和43%、39%和31%、20%和15%;底栖生物对消费者群落氮源贡献百分比分别为55%和57%、61%和69%、80%和85%(图6). 浮游生物对消费者群落氮源贡献百分比4月高于8月,且最大值出现在生境1. 这可能是由于生境1受人为活动影响较大,导致水体和生物的δ15N值升高[59],且浮游动物氮稳定同位素值与水体中氮浓度有关[60]. 底栖生物对消费者种群的氮源贡献百分比在8月高于4月,这可能是因为沉水植物在夏季生长旺盛,对消费者的食物贡献也随之加大.
就浮游和底栖生物对消费者群落碳源贡献百分比而言(图7),底栖生物对消费者的碳源贡献百分比在8月高于4月,且生境3高于其他生境;浮游生物对消费者的碳源贡献百分比在4月高于8月,且生境1高于其他生境.

图6 底栖和浮游生物对消费者群落氮源贡献占比Fig.6 Pelagic and benthic communities contribute percentages of nitrogen sources to consumer populations

图7 底栖和浮游生物对消费者群落的碳源贡献占比Fig.7 Pelagic and benthic communities contribute percentages of carbon sources to consumer populations
2.5 富营养化对白洋淀消费者群落碳、氮稳定同位素特征的影响
不同种类消费者群落的δ13C和δ15N组成呈现显著差异,δ13C和δ15N值主要受食物来源、各来源比例以及生境等因素影响[61]. 湖泊生境变化会改变浮游植物等生产者的δ15N值,进而影响消费者的δ15N值[62],有研究表明在磷输入负荷增加后,初级生产者对氮的吸收也同时增加,降低了氮同位素分馏,使得15N值上升,进而造成消费者种群的δ15N值也随之增加[63-64]. 因此,湖泊富营养化会改变生产者的δ13C和δ15N,进而影响消费者群落的δ13C和δ15N值.
表3 白洋淀消费者群落的碳、氮稳定同位素值 与环境因子相关性分析
Tab.3 Correlation analysis of carbon and nitrogen stable isotope values of consumer populations and environmental factors in Lake Baiyangdian

环境因子4月8月δ13Cδ15Nδ13Cδ15N水环境因子TP0.798∗-0.784∗∗0.762∗∗沉积物因子TCs-0.782∗0.864∗-0.958∗∗0.843∗∗TNs0.786∗-0.967∗∗0.889∗∗TOCs-0.842∗0.885∗∗-0.951∗∗0.879∗∗TPs-0.954∗∗0.944∗∗-0.713∗0.656∗
“-”表示不相关. 本研究运用相关性分析来明晰富营养化对白洋淀消费者群落碳、氮稳定同位素特征的影响,结果表明白洋淀消费者群落的δ13C值与TP、TCs、TNs、TOCs、TPs等环境因子呈现负相关关系;而δ15N值与TP、TCs、TNs、TOCs、TPs呈现正相关关系(表3). 近年来白洋淀接受了流域大量的工业废水、生活污水和农业污水,导致白洋淀水体和沉积物中TP、TN等含量升高,湖泊富营养化较为严重,长期生活在这种重污染水体中的生物体内δ15N值偏正[65]. 这与其他研究的结论一致[12],即δ15N值会随着湖泊富营养化水平的增加而逐渐偏正. 湖泊富营养化伴随着大量的有机质分解、溶解氧浓度降低,导致湖泊沉积物中微生物反硝化作用的增强,产生了较大的δ15N分馏[66]. 在反硝化过程中较轻的氮同位素随着氮气而释放,较重的氮同位素保留在剩余水体氮库中,导致水体15N偏正,进而使生活在其中的生物其δ15N值偏正[66]. 湖泊富营养化会影响浮游生物等食物源的δ13C值,进而影响消费者的δ13C值. 相关研究表明外源碳(δ13C值偏正)对浮游动物碳源的贡献量在贫营养湖泊中较高[67],致使浮游植物和浮游动物的δ13C值存在一定程度上的差异,即浮游动物碳源因受外源碳影响进而使其δ13C值偏正;而在富营养湖泊中,浮游动物有机碳源主要受内源碳(如浮游植物)的影响[68],导致有机碳传输过程中浮游植物与浮游动物之间有较强的耦合作用并且δ13C显著相似. 浮游生物δ13C值的变化,最终会影响以其为食物源的消费者的δ13C值. 这些结论进一步证实富营养化会影响水生生物的δ13C和δ15N值,进而影响底栖和浮游生物对消费者群落碳源和氮源贡献的百分比.
3 结论
1)白洋淀消费者群落的δ13C值呈现显著的时空差异,消费者群落的δ13C值受季节变化和生境条件的影响;而δ15N值和营养级呈现显著的空间差异,季节变化不显著,其主要与生境条件有关.
2)白洋淀浮游生物和底栖生物对消费者群落碳源和氮源贡献百分比受到季节变化和生境条件的影响. 富营养化越强,则浮游生物对消费者群落碳源和氮源贡献百分比的值越高,底栖生物对消费者群落碳源和氮源贡献百分比的值越低,反之亦然.
3)湖泊富营养化会影响消费者群落浮游生物/底栖生物对消费者群落碳源和氮源贡献的百分比,进而影响湖泊生态系统的能流和物质流.

