ε-聚赖氨酸对柑橘酸腐菌的抑菌活性及作用机制
肖 媛,潘兆平,尹春晓,苏 瑾,胡 筱,朱向荣,,单 杨,付复华,
(1.湖南大学研究生院隆平分院,湖南 长沙 410125;2.湖南省农业科学院农产品加工研究所,湖南 长沙 410125;3.果蔬贮藏加工与质量安全湖南省重点实验室,湖南 长沙 410125)
柑橘是世界第一大水果,我国是柑橘的主要生产和消费大国[1]。柑橘果实富含多种营养物质及生物活性成分,深受消费者喜爱[2]。但由于柑橘类水果成熟期集中,含水量较高且营养成分丰富,采后极易感染病原菌而发生霉变、腐烂,降低品质,造成了较大资源浪费和环境污染问题[3]。由柑橘酸腐菌(Geotrichum citri-aurantii)引起的酸腐病是柑橘类果实在采后贮运中最重要的病害之一,其发病率仅次于绿霉病和青霉病[4],几乎影响到世界各产地所有柑橘类作物与栽培品种[5]。柑橘酸腐菌有较强的侵染力,且具有生长周期短、繁殖快、对环境适应能力强、不易被杀菌剂杀死、难以控制等特点[6]。酸腐病在柑橘采后贮藏后期易爆发,染病后果实腐烂液化易相互影响造成交叉感染,引起大面积的腐烂,危害巨大[7]。目前,化学杀菌剂是生产上防治柑橘采后病害的主要技术,大部分杀菌剂如咪鲜胺、抑霉唑、噻菌灵、嘧霉胺等可有效控制柑橘青绿霉病,但对柑橘酸腐病的防治有限[8]。联苯酚钠在一定浓度下能够有效防治酸腐病,但因其对果实有损伤作用,使用量逐渐减少[9]。双胍盐类对酸腐病的控制有特定效果,因不明确其代谢途径,无法有效检测其残留量,使其使用范围受限[5,7]。化学杀菌剂防治技术具有高效、广谱和使用方便等特点,其广泛使用的同时,安全性等问题也引起了人们的高度关注。许多化学杀菌剂有致癌性、毒性大、易残留等问题,处理不当会对人的身心健康和生态环境安全有害[10]。另外,若长时间用一种或几种药剂,极易增强病原菌对药剂的耐药性,最终导致病害更难防治[11]。因此,亟需寻找安全、有效的防治措施来控制柑橘采后酸腐病的发生。
ε-聚赖氨酸(ε-polylysine,ε-PL)来源于白色链霉菌(Streptomyces albulus)发酵产生的代谢产物[12],是一种高安全性的天然食品保鲜防腐剂。ε-PL是一种均聚氨基酸,是由单个赖氨酸分子α-位羰基和ε-位氨基通过酰胺键结合的聚合物,其有25~30 个赖氨酸残基[13]。与化学防腐剂相比,ε-PL是生物发酵产物,更安全,其在体内能分解为人体需要的赖氨酸[14]。而且,ε-PL还具有抑菌谱广、耐高温、水溶性好、pH值使用范围广等优点[15]。ε-PL已被中国与美国等国家批准为安全食品保鲜剂[14,16],广泛用于熟肉制品、蛋制品以及果蔬汁等多种食品的保鲜防腐。近年来,关于ε-PL的抑菌特性与抑菌机理的研究得到了广泛的关注。Lin Lin等[17]研究了ε-PL对李斯特菌的抗菌机制,结果表明经质量浓度为200 mg/L的ε-PL处理能抑制99.99%李斯特菌的生长繁殖,带正电荷的ε-PL与李斯特菌细胞膜表面的脂磷壁酸等带负电荷的基团结合使细胞膜的结构发生变化,引起胞内酶与可溶性蛋白的外流,菌体正常呼吸代谢功能紊乱,最终导致细胞凋亡。Bo Tao等[18]研究报道质量浓度为50~200 mg/L的ε-PL处理导致酿酒酵母细胞膜的一系列变化,包括增加麦角甾醇含量,改变脂肪酸组成,对膜蛋白的构象与功能造成影响,引起菌体渗透胁迫作用和质壁分离的发生。Li Hua等[19]发现质量浓度150~450 mg/L的ε-PL处理对灰霉菌的细胞膜具有损伤作用,膜完整性的破坏能够引起胞内可溶性碳水化合物及核酸的渗漏,促进其体内活性氧的积累,并导致菌体内BcXyn11A与BcRAS1等致病基因的表达下调,最终抑制灰霉菌的生长繁殖,有效降低红枣灰霉病的发病率。
ε-PL是一种安全、健康、绿色的防腐保鲜剂,对多种细菌和真菌有直接抑制作用,具有广阔的商业应用前景[20]。ε-PL对大肠杆菌O157:H7[21]、金黄色葡萄球菌等[22]食源性病原菌及灰霉菌[19]、粉红单端胞霉[23]、指状青霉[24]等常见的果蔬采后致病真菌均有较好的抑菌活性,但目前鲜有关于ε-PL抑制柑橘酸腐菌的研究报道。本实验以柑橘酸腐菌为材料,分析了ε-PL对柑橘酸腐菌的抑制效果及抑菌特性,并进一步探讨了ε-PL对柑橘酸腐菌的抗菌机制,旨在为柑橘采后酸腐病的控制研究提供新思路,为研发适合柑橘贮藏的新型防腐保鲜剂提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
柑橘酸腐菌(Geotrichum citri-aurantii) 中国科学院华南植物园微生物实验室;沙糖橘为市场采购,产自广西桂林。
ε-聚赖氨酸 上海富源生物科技有限公司;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、马铃薯葡萄糖(potato dextrose broth,PDB)液体培养基郑州亚世生物科技有限公司;碘化丙啶(propidium iodide,PI)、磷酸盐缓冲液(phosphate buffered saline,PBS)北京索莱宝科技有限公司。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机 长沙平凡仪器仪表有限公司;SW-CJ-1C型净化工作台 苏州净化设备有限公司;血细胞计数板 上海求精生化试剂仪器有限公司;DDS-307A电导率仪 上海仪电科学有限公司;TS-100B台式空气浴摇床 金坛市精达仪器制造有限公司;XSP-36X型显微镜 凤凰光学仪股份有限公司;UV-180型紫外-可见分光光度计 岛津仪器(苏州)有限公司;JSM-6360LV型高低真空扫描电子显微镜、JFD-320冷冻干燥仪 日本电子株式会社;SP8 STED 3X型激光共聚焦显微镜 徕卡显微系统(上海)贸易有限公司。
1.3 方法
1.3.1 ε-PL对柑橘酸腐菌的最小抑菌浓度的测定
将柑橘酸腐菌接种至PDA培养基上,放置于28 ℃恒温培养箱培养7 d,用无菌水将柑橘酸腐菌洗入三角瓶中,用普通玻璃珠将孢子打散、过滤,将滤液充分摇匀制成孢子悬浮液。采用微量肉汤稀释法研究ε-PL对柑橘酸腐菌最小抑菌浓度(minimum inhibitory concentration,MIC)[8,25-26]。用无菌的96 孔微量板进行实验,分别加入100 μL PDB培养基。吸取100 μL质量浓度为51 200 mg/L的ε-PL溶液加入A1号孔板,采用倍半浓度稀释法依次从A2号孔板稀释至A11号孔板。在A1~A10号孔板和A12号孔板中加入100 μL含柑橘酸腐菌孢子浓度为107CFU/mL的PDB培养基,使A1~A10号孔板中ε-PL质量浓度为12 800~25 mg/L。A11号孔板为空白对照,只加入培养基和ε-PL溶液,不接种菌液。A12号孔板为菌液对照组,不含ε-PL溶液28 ℃培养48 h后,用显微镜观察其菌丝生长,以A1~A10号孔板中仍保持澄清的最低ε-PL质量浓度为ε-PL对柑橘酸腐菌的MIC,每个质量浓度设置8 个平行。
1.3.2 ε-PL处理对柑橘酸腐菌菌丝体生长的抑制效果
将PDA培养基于高压蒸汽灭菌锅中121 ℃灭菌20 min后取出,在培养皿中分别加入不同质量浓度的ε-PL和PDA培养基,充分混匀,使每个平板培养基中ε-PL溶液的质量浓度分别为0(对照组)、50、100、200、400、600、800 mg/L(均为处理组),备用。从用PDA培养基培养7 d的柑橘酸腐菌菌落边缘取直径为6 mm的菌饼,将菌饼分别接种于平板培养基正中央,每个平板接种一个菌饼,菌丝面朝下,28 ℃培养箱中培养7 d[27]。每组重复3 次。菌落增长直径与菌丝体生长抑制率分别按公式(1)、(2)计算。以ε-PL质量浓度的对数值作为横坐标,菌丝体生长抑制率为纵坐标,计算ε-PL对柑橘酸腐菌菌丝体生长的毒力方程和半最大效应浓度(half maximal effective concentration,EC50)[28]。

1.3.3 ε-PL处理对柑橘酸腐菌孢子萌发抑制率的测定
采用涂布平板法测定ε-PL处理对柑橘酸腐菌孢子萌发的影响。柑橘酸腐菌在PDA平板上28 ℃培养7 d后,用无菌水洗下孢子,用无菌纱布过滤除去菌丝,将滤液在5 000 r/min下离心10 min,去除上清液,将柑橘酸腐菌孢子重悬于PBS溶液中,用血球计数板调节孢子浓度至106CFU/mL,制成孢子悬浮液备用。吸取50 μL孢子悬液涂布在含质量浓度0(对照组)、50、100、200、400、600、800 mg/L(均为处理组)的ε-PL平板上[29],每个处理3 次重复,置于28 ℃培养箱中培养6 h,直到对照组的萌发率达到95%以上,每皿随机观察100 个孢子,统计孢子萌发数/个,以芽管长度超过孢子最大直径的一半作为萌发标准[30]。孢子萌发率和孢子萌发抑制率分别按公式(3)、(4)计算。以ε-PL质量浓度的对数值作为横坐标,柑橘酸腐菌孢子萌发抑制率为纵坐标,计算ε-PL对酸腐菌孢子萌发的毒力方程和EC50[31]。

1.3.4 柑橘酸腐菌细胞膜通透性的测定
将1×106CFU/mL的柑橘酸腐菌孢子悬浮液接种于PDB培养基中,于28 ℃且转速为200 r/min的摇床中进行振荡培养3 d。4 000 r/min离心20 min后用无菌水离心冲洗3 次。将离心后的菌丝体置于25 mL的无菌水中,加入ε-PL使其质量浓度分别为1×MIC、2×MIC,于28 ℃且转速为200 r/min摇床培养并测定处理0、2、4、6、8、10、12 h时的胞外电导率L/(μS/cm)。最后用沸水煮沸处理10 min,冷却至室温,再次测定的电导率为L’,实验重复3 次。用相对电导率表示细胞膜通透性,相对电导率按公式(5)计算[32-33]。
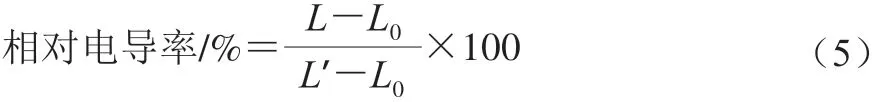
式中:L为各时间点的电导率/(μS/cm);L0为0 h的电导率/(μS/cm);L’为沸水处理后的电导率/(μS/cm)。
1.3.5 柑橘酸腐菌胞内物质释放量的测定
将1×106CFU/mL的柑橘酸腐菌孢子悬浮液接种于25 mL的PDB培养基中,于28 ℃且转速为200 r/min的摇床中进行振荡培养3 d。4 000 r/min离心20 min后用无菌水离心冲洗3 次。将离心后的菌丝体置于25 mL的无菌水中,加入ε-PL使其质量浓度分别为1×MIC、2×MIC,加入等量无菌水为对照组[8,34]。于28 ℃且转速为200 r/min摇床培养,于0、2、4、6、8、10、12 h时取样,将样品置于12 000 r/min离心3 min收集上清液2 mL,在260 nm波长处测定吸光度,实验重复3 次。
1.3.6 柑橘酸腐菌细胞膜完整性的测定
将柑橘酸腐菌孢子添加到ε-PL质量浓度分别为1×MIC、2×MIC的PDB培养基中,调整孢子浓度为1×107CFU/mL,以无菌水作对照。置于28 ℃且转速为200 r/min的摇床中孵育6 h后,4 000 r/min离心3 min去上清液,加入500 μL的PI染色液,37 ℃水浴避光染色10 min。用PBS清洗3 次,去除多余染色液,置于激光共聚焦显微镜下观察[35-36]。
1.3.7 扫描电子显微镜观察
采用扫描电子显微镜观察ε-PL处理后真菌菌丝的形态学变化。将6 mm的菌饼接种到质量浓度为0、1×MIC、2×MIC的ε-PL的PDA培养基中28 ℃恒温培养7 d后,取平板中的菌丝(6~8 mm3)[27],用体积分数2.5%磷酸戊二醛与2%多聚甲醛固定2 h以上,放置于4 ℃冰箱。用体积分数0.1% PBS清洗戊二醛3 次,每次40 min。将样品放置于体积分数1%锇酸固定2 h后,用体积分数1% PBS清洗3 次,每次5 min。样品于体积分数30%、50%、70%、90%乙醇和无水乙醇梯度脱水,每隔10 min一次。最后将样品放置于真空冷冻干燥机中干燥,取出贴台后喷金镜检。
1.3.8 柑橘果实酸腐病发病率和病斑直径的测定
挑选无损伤、大小着色一致的柑橘果实,随机分为4 组,每组10 个果实。在其表面喷洒体积分数75%乙醇进行消毒,用无菌水冲洗后,晾干。用灭过菌的打孔器在果实腰部等距离刺两个直径为3 mm、深3 mm的伤口,接种浓度为2×104CFU/mL孢子悬浮液20 μL,晾干后,处理组分别加入20 μL质量浓度为1 600、3 200 mg/L和6 400 mg/L的ε-PL溶液至伤口,对照组加入20 μL无菌水。接种后置于塑料盒,用自封袋密封置于25 ℃、相对湿度为90%~95%的条件下培养8 d后,测定柑橘果实的发病率,用十字交叉法测量柑橘果实的病斑直径,实验重复3 次[4,9]。
1.4 数据统计分析
实验平行测定3 次,采用Excel软件进行统计数据,结果以平均值±标准差表示。采用DPS 7.05软件绘制标准曲线,利用Origin 2018软件进行制图,应用SPSS 17.0软件对数据进行方差分析,利用邓肯氏多重比较进行差异显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 ε-PL对柑橘酸腐菌的MIC
表1 列出了ε-P L 对柑橘酸腐菌的M I C 值,质量浓度≥400 mg/L的ε-PL对柑橘酸腐菌有较好的抑菌效果。经微量肉汤稀释法测定可知,ε-PL对柑橘酸腐菌的MIC为400 mg/L。

表1 ε-PL对柑橘酸腐菌的MICTable 1 MIC of ε-PL against Geotrichum citri -aurantii
2.2 ε-PL处理对柑橘酸腐菌菌落形态、菌落直径的影响
由图1A、B可知,随着ε-PL质量浓度的升高,对柑橘酸腐菌菌丝体生长的抑制作用逐渐增强。培养7 d后,当ε-PL的质量浓度≥400 mg/L时,可明显抑制菌丝体的生长(图1A1~A7)。培养2 d后,与对照组相比ε-PL处理组可以显著抑制酸腐菌菌丝体的生长(P<0.05),当ε-PL的质量浓度≥400 mg/L时,柑橘酸腐菌基本无生长。培养7 d后,对照组菌丝体生长迅速,菌落直径达到了(76.83±0.14)mm(图1B)。
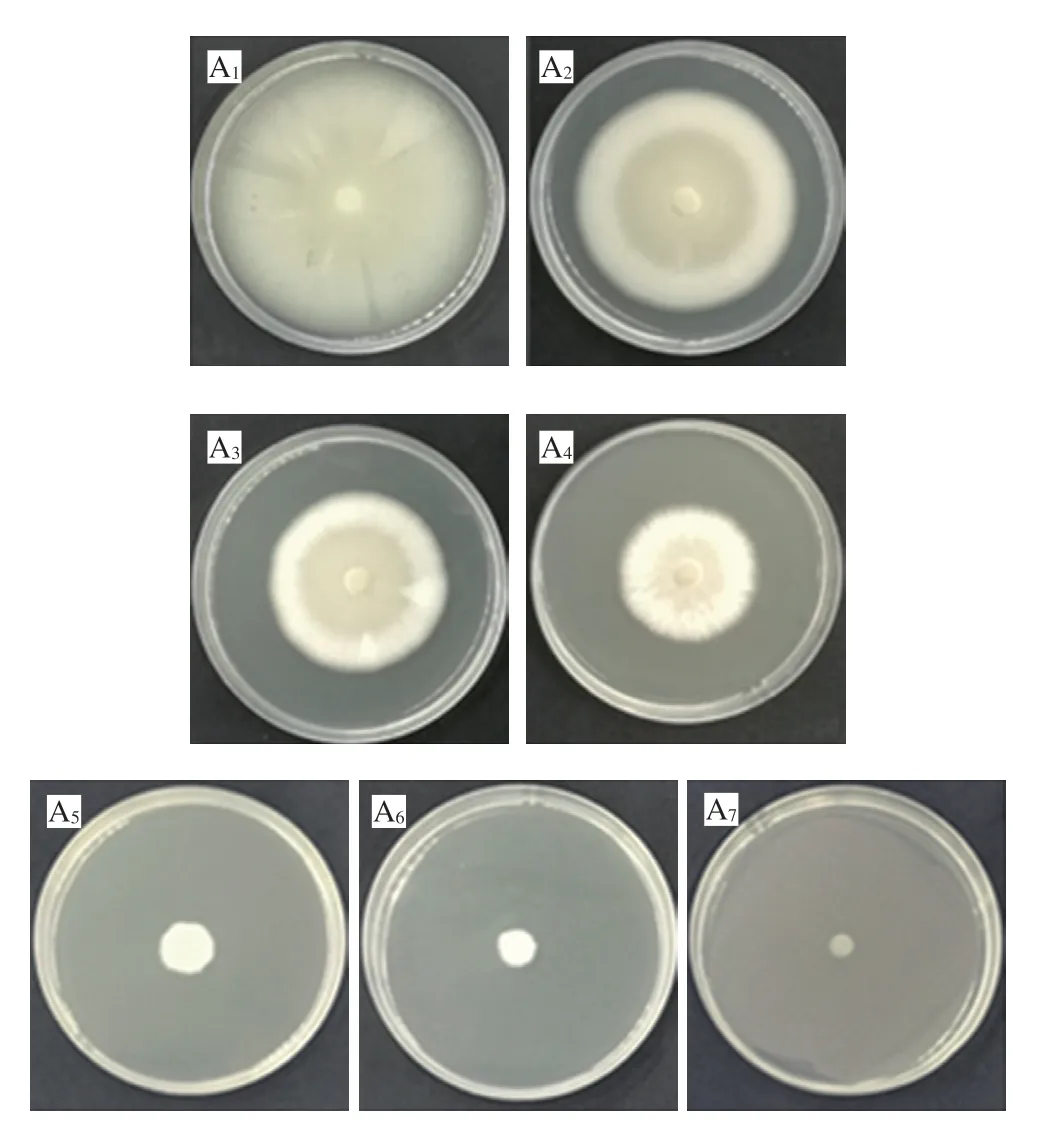
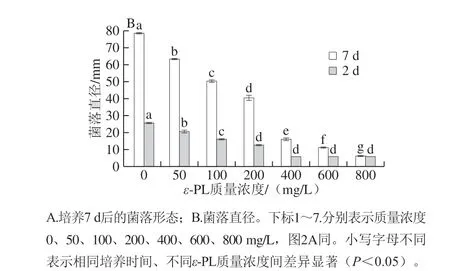
图1 ε-PL对柑橘酸腐菌菌落形态、菌落直径的影响Fig. 1 Effect of ε-PL treatment on colony morphology and diameter of Geotrichum citri-aurantii
2.3 ε-PL处理对柑橘酸腐菌孢子萌发、菌丝体生长的影响
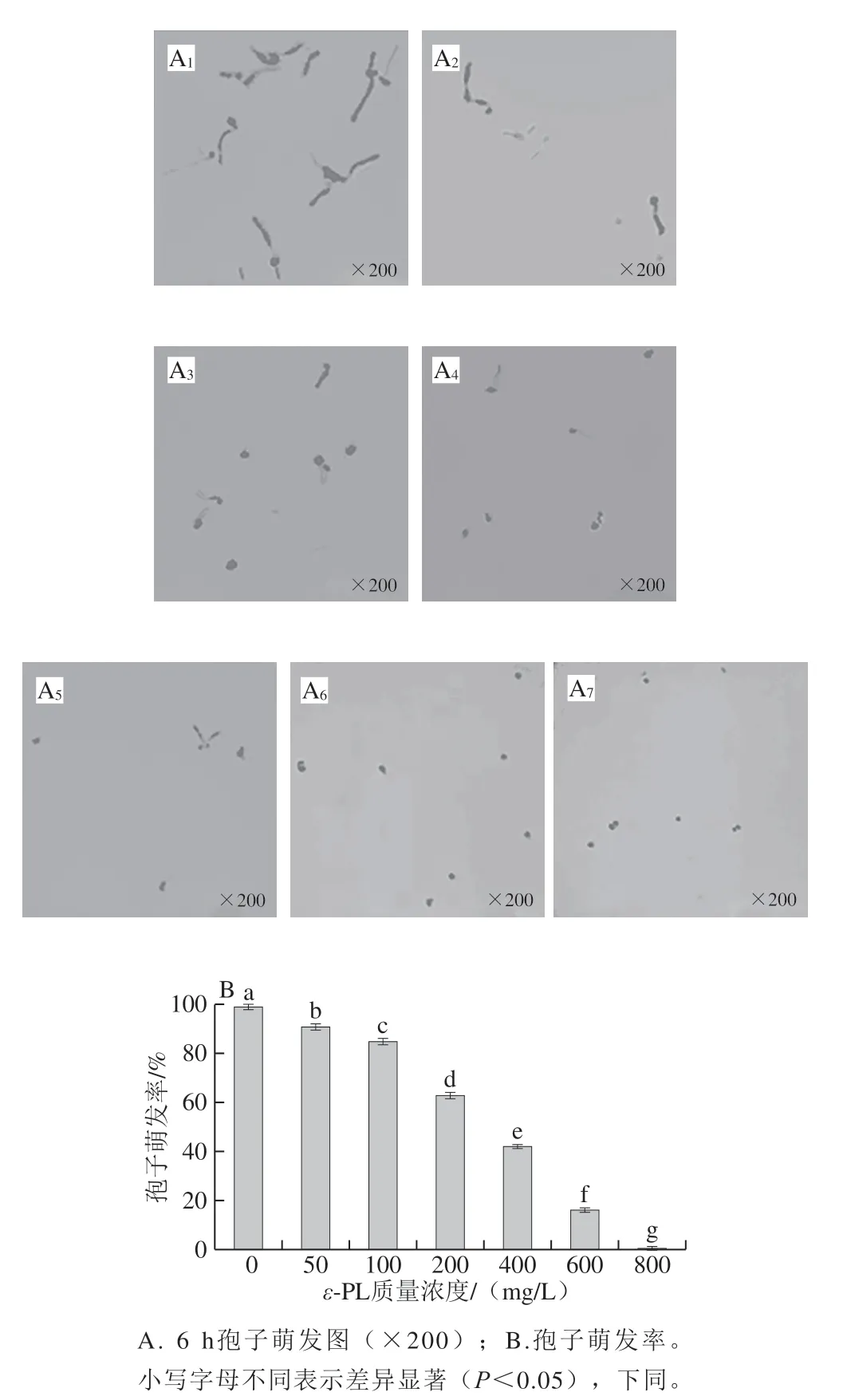
图2 ε-PL处理对柑橘酸腐菌孢子萌发的影响Fig. 2 Effect of ε-PL treatment on spore germination rate of Geotrichum citri-aurantii
由图2和图3可知,ε-PL处理可显著降低柑橘酸腐菌的孢子萌发率。图2A1~A7为6 h时,200 倍的光学显微镜下,各组柑橘酸腐菌的孢子萌发情况,对照组的柑橘酸腐菌孢子萌发率较高,芽管伸长明显,ε-PL处理组孢子萌发、芽管伸长受到明显抑制。随着ε-PL质量浓度的增加,对柑橘酸腐菌孢子萌发率显著下降(P<0.05),呈现出明显的量效关系(图2B)。由图3可知,当ε-PL的质量浓度为200、400 mg/L和600 mg/L时,对柑橘酸腐菌菌丝体生长的抑制率分别为(52.42±1.40)%、(85.83±0.66)%与(92.63±0.38)%。经质量浓度800 mg/L的ε-PL处理后,能抑制99.50%以上的菌丝体生长,抑制率达(99.32±0.59)%,经质量浓度为400 mg/L与600 mg/L的ε-PL处理,对柑橘酸腐菌孢子萌发抑制率分别达到了(57.42±1.01)%和(84.80±1.01)%,与对照组差异显著(P<0.05),用质量浓度800 mg/L的ε-PL处理后,基本无孢子萌发。

图3 ε-PL处理对柑橘酸腐菌的菌丝体生长和孢子萌发的抑制率Fig. 3 Mycelium growth and spore germination inhibitory rates of Geotrichum citri-aurantii by ε-PL treatment
表2 ε-PL对柑橘酸腐菌的毒力回归方程和C50Table 2 Virulence regression equation and EC50 ofε-PL against Geotrichum citri-aurantii

表2 ε-PL对柑橘酸腐菌的毒力回归方程和C50Table 2 Virulence regression equation and EC50 ofε-PL against Geotrichum citri-aurantii
95%置信区间/(mg/L)菌丝 Y=2.785 8X-0.877 8 0.932 2 128.79 82.694 3~200.586 1孢子 Y=2.839 8X-1.622 4 0.930 1 214.77 146.409 5~315.042 5指标 毒力回归方程 决定系数R2 EC50/(mg/L)
由表2可知,ε-PL处理对柑橘酸腐菌菌丝体生长有抑制作用,其毒力回归方程为Y=2.785 8X-0.877 8,EC50为128.79 mg/L。ε-PL处理对柑橘酸腐菌对孢子萌发的毒力回归方程为,Y=2.839 8X-1.622 4,EC50为214.77 mg/L。
2.4 ε-PL处理对柑橘酸腐菌细胞膜通透性的影响
细胞膜为菌体的保护屏障,具有保护、识别、物质交换等功能,能使菌体细胞维持相对稳定的内环境[37-38]。当细胞膜的通透性发生变化,细胞膜的结构被破坏,细胞内的电解质渗漏到培养液中,致使培养液的电导率升高,相对电导率值的变化可以反映菌体细胞膜通透性的变化[39]。由图4可知,对照组菌丝体的胞外相对电导率缓慢上升,至12 h时,相对电导率达(4.64±0.13)%。经过ε-PL处理的菌丝体的胞外相对电导率在培养过程中上升较快,且随着ε-PL处理时间的延长与ε-PL质量浓度的增大,相对电导率增幅呈上升趋势。至12 h时,经质量浓度为1×MIC和2×MIC的ε-PL处理,菌丝体的胞外相对电导率分别达(13.99±1.15)%、(35.82±0.64)%,与对照组相比差异显著(P<0.05)。本实验表明ε-PL处理可引起柑橘酸腐菌细胞膜的通透性发生改变,使细胞膜丧失其正常的功能。

图4 ε-PL处理对柑橘酸腐菌细胞膜通透性的影响Fig. 4 Effect of ε-PL treatment on cell membrane permeability of Geotrichum citri-aurantii
2.5 ε-PL处理对柑橘酸腐菌细胞成分释放的影响
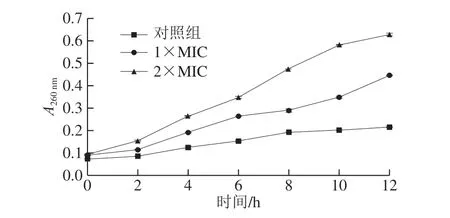
图5 ε-PL处理对柑橘酸腐菌A260 nm细胞成分释放的影响Fig. 5 Effect of ε-PL treatment on A260 nm of Geotrichum citri-aurantii
当菌体处于不利环境中时,其生长受到抑制,细胞结构被破坏,膜内的K+、PO43-等小离子物质会连同DNA、RNA等大分子物质泄漏[40]。因此,可通过测定260 nm波长处的吸光度来表征菌体经ε-PL处理后酸腐菌核酸等胞内物质的释放情况。由图5可知,在0~12 h内,经ε-PL处理后的酸腐菌菌丝体的胞外A260nm明显增加,且始终高于对照组。处理12 h后,对照组的A260nm(0.215±0.001)显著低于1×MIC处理组(0.445±0.002)以及2×MIC处理组(0.628±0.006)(P<0.05)。1×MIC、2×MIC处理组260 nm波长处的吸光度随着作用时间的延长呈现上升趋势,1×MIC、2×MIC处理组的作用效果与ε-PL质量浓度正相关。说明ε-PL处理显著增加了酸腐菌细胞成分的释放,造成柑橘酸腐菌菌体内部的核酸等物质外泄,细胞内含物泄漏速率与ε-PL质量浓度呈正相关。
2.6 ε-PL处理对柑橘酸腐菌细胞膜完整性的影响
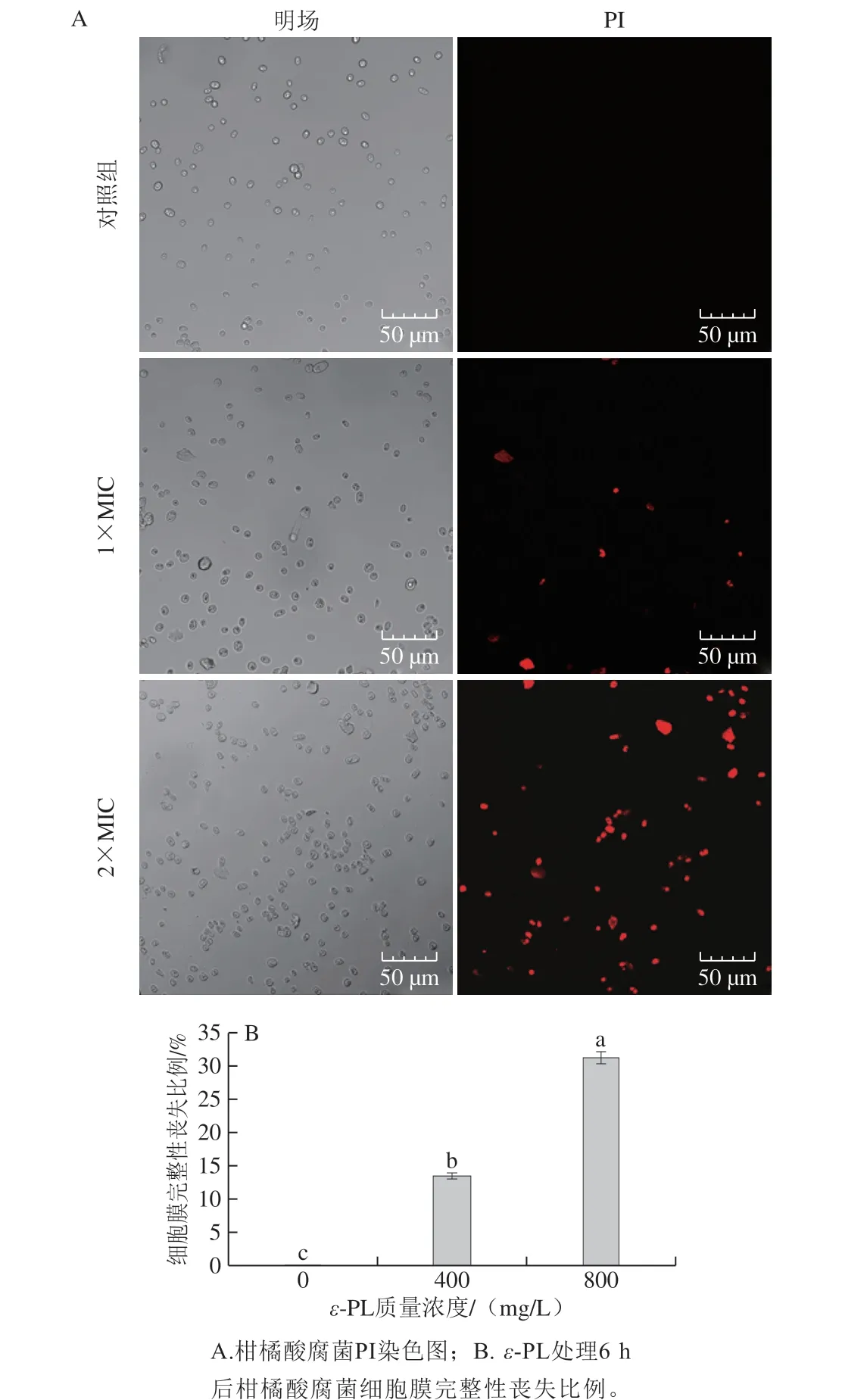
图6 ε-PL处理对柑橘酸腐菌细胞膜完整性的影响Fig. 6 Effect of ε-PL treatment on membrane integrity of spores of Geotrichum citri-aurantii
荧光染料PI可用于检测ε-PL是否引起细胞膜完整性丧失[41]。PI是一种可对DNA染色的细胞核染色试剂,PI不能通过健康的活细胞膜,但能穿过破损的细胞膜与细胞中的DNA结合产生红色荧光,在显微镜下观察到发出红色荧光的细胞已经死亡[42]。从图6A可以看出,明场下观察,对照组孢子长势良好、结构完整,而ε-PL处理组的孢子细胞部分出现破裂,产生细胞碎片等溶出物;暗场(PI染色)下观察,对照组孢子基本无红色荧光,ε-PL处理组则显现出较强的荧光,且荧光强度随ε-PL质量浓度增加而增强,ε-PL处理能够破坏酸腐菌孢子细胞膜的完整性。酸腐菌孢子失去细胞膜完整性的比例与ε-PL质量浓度呈正相关,当用质量浓度为1×MIC(400 mg/L)、2×MIC(800 mg/L)的ε-PL处理6 h后,分别有约(13.46±0.47)%、(31.29±0.78)%的酸腐菌孢子细胞膜完整性丧失(图6B)。
2.7 扫描电子显微镜观察ε-PL处理对柑橘酸腐菌菌丝体形态的影响
改变病原菌菌丝体形态是杀菌剂及抑菌活性物质重要的作用途径之一,抑菌剂可使菌丝呈多种畸形变化甚至断裂,从而阻碍其正常的生长发育。由图7可知,ε-PL处理对柑橘酸腐菌丝体形态存在明显影响。对照组菌丝饱满表面光滑、结构完整、形状规则、隔膜明显,处于正常生长状态。而经1×MIC和2×MIC处理的柑橘酸腐菌菌丝体发生多种形态变化。1×MIC处理组的菌丝体表面粗糙、出现皱缩变形。相比之下,2×MIC处理组的菌丝体形态变化更为剧烈,菌丝体表面严重褶皱、膨大凸起、整体扭曲变形、菌丝断裂,从而使细胞内容物质泄漏,这与ε-PL处理对柑橘酸腐菌细胞膜的影响部分结果一致。ε-PL处理对柑橘酸腐菌菌丝体具有损伤作用。

图7 柑橘酸腐菌扫描电子显微镜图Fig. 7 SEM images of Geotrichum citri-aurantii
2.8 ε-PL处理对柑橘果实酸腐病的防治效果
从图8 A、B 可知,贮藏8 d 后,对照组发病率达(9 8.3 3±2.8 9)%,柑橘果实病斑直径达(39.33±1.53)mm。与对照组相比,ε-PL处理能有效控制柑橘果实酸腐病的发生,达到了一定的防治效果。增加ε-PL的质量浓度可以有效地减小柑橘果实的病斑直径(P<0.05),控制效果随ε-PL质量浓度的增加而增强。用1 600 mg/L的ε-PL处理柑橘果实后,病斑的生长直径明显减小,当ε-PL的质量浓度达到6 400 mg/L时,病斑直径减小到(5.24±0.29)mm,发病程度明显减轻。采用1 600、3 200 mg/L和6 400 mg/L ε-PL处理柑橘果实,发病率分别显著降低到(83.33±2.89)%、(55.00±5.00)%和(21.67±2.89)%(P<0.05)。因此,ε-PL处理对柑橘采后酸腐病的发生有一定的防治效果。图8C表明贮藏8 d同孔接种不同质量浓度ε-PL的柑橘果实病斑直径的扩展情况。可以看出,与对照组相比,随着ε-PL质量浓度的增加柑橘果实酸腐病的病斑直径扩展被抑制,质量浓度为6 400 mg/L时处理效果最好。

图8 ε-PL处理对柑橘果实酸腐病发病率和病斑直径的影响Fig. 8 Effect of ε-PL treatment on sour rot incidence and lesion diameter of citrus fruit
3 讨 论
本实验探讨了不同质量浓度的ε-PL对柑橘酸腐菌的抑制作用。体外实验表明ε-PL对柑橘酸腐菌具有良好的抑制作用,ε-PL对柑橘酸腐菌的MIC为400 mg/L,对菌丝体生长和孢子萌发抑制的EC50分别为128.79 mg/L和2 1 4.7 7 m g/L,当ε-P L 的质量浓度为2×M I C(800 mg/L)时,对菌丝生长和孢子萌发抑制率分别为(99.88±0.20)%和(99.32±0.59)%,基本抑制了孢子的萌发,菌丝体发生扭曲、断裂现象,生长繁殖受阻。这与Liu Kewei等[24]研究发现ε-PL处理对粉红单端胞霉菌的孢子萌发以及菌丝体生长具有抑制作用的研究结果一致。在活体实验中,当ε-PL质量浓度达到1 600、3 200、6 400 mg/L时能显著降低酸腐病的发病率与果实病斑的生长直径,减轻酸腐病的发病程度,各处理组与对照组差异显著(P<0.05),可有效控制柑橘酸腐病的发生。Li Hua等[19]的研究结果表明,ε-PL处理可以有效防治红枣采后灰霉病的发生,这与本实验的研究结果具有一致性。离体和活体实验均能说明ε-PL对柑橘酸腐菌有着较好的抑制作用。
细胞膜是细胞与周围环境进行物质交换和信息传递的通道和屏障,它的通透性和完整性在细胞进行正常生理活动中具有重要的作用,细胞膜是常见的抗真菌剂的重要作用靶标[31,43]。据相关研究报道ε-PL具有多价阳离子特性,可对微生物细胞表面产生静电吸附作用,破坏微生物的细胞膜结构,引起细胞物质、能量与信息传递中断,抑制微生物的生长繁殖[19,44]。本实验也存在类似的研究结果,当添加1×MIC和2×MIC的ε-PL后,酸腐菌菌丝体胞外相对电导率与260 nm波长处的吸光度都有显著上升(P<0.05)。相对电导率增加与细胞膜通透性异常变化有关。抑菌剂作用于细胞膜后,使细胞质离子稳态遭到破坏,电解质泄漏、电导率上升,损坏了细胞质膜的屏障,影响菌体的代谢繁殖。Su Ruihua等[45]研究发现经ε-PL处理后的蜡状芽孢杆菌培养液电导率会增大、菌体细胞裂解率增加,Zhang Xiaowei等[21]用ε-PL处理大肠杆菌O157:H7后,发现处理组的大肠杆菌O157:H7细胞膜通透性发生改变,细胞内含物外渗,本实验也得到相似的结果。在0~12 h内,ε-PL作用于柑橘酸腐菌细胞,引起细胞膜通透性异常变化,造成细胞内外渗透压失衡,K+、Mg2+、Ca2+等小分子物质渗出、胞外离子含量升高,相对电导率增加,1×MIC、2×MIC的ε-PL处理组显著高于对照组(P<0.05),相对电导率增加是ε-PL处理对病原菌产生损伤作用的早期表现。260 nm是核酸的特征波长,在处理12 h后,随着ε-PL质量浓度升高与作用时间延长,A260nm显著升高,说明外源性的ε-PL与菌体细胞膜结合后,改变了细胞膜的结构,导致细胞质流失、引起胞内核酸等大分子物质泄露。通过激光共聚焦显微镜观察酸腐菌孢子核酸荧光染色,结果表明1×MIC、2×MICε-PL作用后的柑橘酸腐菌红色荧光信号明显高于对照组(P<0.05),进一步证实了ε-PL对细胞膜的损伤作用与抑菌活性。这一结果与Tan Zhilei等[22]研究报道的ε-PL处理对金黄色葡萄球菌细胞膜的损伤作用及Wei Lianhua等[46]关于ε-PL处理对白色念珠菌细胞膜完整性的破坏作用的结论一致。扫描电子显微镜观察结果表明,ε-PL处理后酸腐菌菌丝体的形态结构发生褶皱、肿大畸形、断裂、内容物外泄等裂解现象,这与Liu Kewei等[24]研究发现ε-PL处理对指状青霉菌菌丝体形态结构具有损伤作用的研究结果具有一致性。因此,ε-PL具有抑菌作用,其可能是通过破坏菌体细胞膜结构导致内容物外泄,进而影响细胞的生长代谢或造成细胞死亡,从而抑制其生长。一些抑菌活性成分也有相似的抑菌作用机制,如α-水芹烯及壬醛对圆孤青霉菌的抑菌机制[47]与柠檬醛对柑橘酸腐菌的抗真菌机制可能是破坏细胞膜的完整性和引发细胞成分的泄漏[8],α-松油醇对意大利青霉的抑制作用也表现出相似的抑菌机制[48]。
4 结 论
实验结果表明,质量浓度800 mg/L的ε-PL对菌丝生长和孢子萌发抑制率分别为(99.88±0.20)%和(99.32±0.59)%,可有效抑制柑橘酸腐菌的菌丝体生长,延缓病原菌孢子萌发。质量浓度为1 600、3 200、6 400 mg/L的ε-PL能显著降低柑橘果实酸腐病的发病率与病斑直径(P<0.05)。ε-PL通过破坏柑橘酸腐菌细胞膜的结构,使其通透性增加、完整性丧失,对细胞膜的稳定性及细胞内环境造成一定的影响,引起细胞破损胞内物质外渗溢出,进而抑制了菌体细胞的生长与繁殖。ε-PL能抑制柑橘酸腐菌的生长,可用于柑橘采后酸腐病的防治,有望开发成环境友好复合型的新型保鲜剂,本实验为柑橘果实采后酸腐病的控制提供了理论依据。

