复合微生物菌剂处理高浓度氨氮废水的强化作用
吴 岩, 任相浩, 寇莹莹, 成 宇
(北京建筑大学环境与能源工程学院, 北京 100044)
近些年随着中国经济的发展,制革废水、畜牧废水、垃圾渗滤液等高浓度氨氮废水的逐渐增多,污水处理面临的问题更加严重[1]。国内外研究为应对高浓度污水带来的问题,污水工艺自身的改进与革新受到多数学者的青睐,Chang等[2]应用膜生物反应器与小球藻处理高氨氮废水,成功高效脱氮并将氮源回收;而沼液生物强化工艺、短程硝化-反硝化工艺等,被证明都可有效处理不同种类的高浓度氨氮废水[3-4]。但是面对更高浓度废水,单一工艺难以满足要求,所以辅助强化工艺同样成为研究的侧重点。中国研究表明投加化学药剂、吹脱法等[5-6]作为辅助预处理工艺可强化高浓度污水的处理效果。但从微生物方向强化污水处理的研究较为不足。
复合微生物菌剂自20世纪70年代诞生至今,已经应用在众多环保领域。刘志刚等[7]将菌剂应用于河道治理,成功解决黑臭水体问题。而污水处理领域,Chon等[8]将复合菌剂应用于MBR工艺中,有效解决原工艺造成的膜污染问题;在处理模拟制革废水工艺中投加菌剂,也可强化系统脱氮效果[9]。所以复合菌剂从生物工艺角度强化污水的处理效果具有可行性,而其能否应用于高浓度污水也需进一步研究。因此采用传统A/O工艺结合短硝化-反硝化工艺,期间通过投加复合微生物菌剂处理高氨氮污水,研究复合菌剂对高浓度污水的处理效果及对功能菌群的强化作用。
1 材料与方法
1.1 实验材料
1.1.1 实验菌剂
实验菌剂为韩国生物资源中心(Daejeon, Republic of Korea)生物科学和生物技术研究所生产的BMc-1复合菌剂,应用于强化污水处理、污泥堆肥、污泥原位减量等。菌剂为粉末状,加入糖蜜(碳源)和水厌氧25 ℃下培养10 d后获得原液。原液继续与糖蜜混合在保证0.5 mg/L溶解氧(DO)下继续培养10 d获得激活液,经检测激活液中每毫升细胞数可达108~109个。
1.1.2 人工废水组成
实验运行期间反应器使用为高氨氮人工废水,模拟垃圾渗滤液。进水水质中氨氮浓度为碳酸氢铵(NH4HCO3)提供,碳源由乙酸钠(CH3COONa)提供,NH4HCO3投加量3 g/L(浓度为1 000 mg/L)、CH3COONa投加量为5.72 g/L(浓度为2 200 mg/L)、KH2PO40.058 g/L、CaCl20.027 g/L、MgSO4·7H2O 0.051 g/L、FeSO4·7H2O 0.009 g/L、EDTA-2Na 0.025 g/L。微量元素浓度为1.25 mg/L,成分如表1所示。

表1 人工污水微量元素组成Table 1 Element composition of synthetic wastewater
1.2 实验装置
实验装置为传统A/O工艺反应器,有效池容积为27.3 m3,通过控制DO、pH及游离氨达到短程硝化。具体如图1所示,反应器包括一个厌氧池(B)、两个好氧池(C)、沉淀池(D)、污泥浓缩池(A:SDC池)及空气泵(E),外回流非传统直接回流,而是先一步回流到A池中再流入厌氧池。水力停留时间设定为18 h,pH控制在7.7~8.0,好氧池DO控制在1.5~2.0 mg/L。

图1 实验A/O反应器Fig.1 Experiment of A/O reactor
1.3 实验方法

1.4 分析方法
实验中氨氮使用双辉CM-05水质测定仪快速测定;亚硝态氮测定采用N-(萘基)-乙二胺光度法;总氮、硝态氮采用紫外分光度法;pH、DO使用YSL-500A便携式测定仪。
活性污泥中菌落相关分析,由上海生工公司完成(Sangon,China)。包括细菌总RNA提取、PCR扩增与16sRNA测序。扩增区域V3-V4,PCR所用的引物为:341F引物:CCCTACACGACGCTCTTCCGATCTG;805R引物:GACTGGAGTTCCTTGGCACCCGAGAATTCCA。
2 结果与讨论
2.1 脱氮效果与分析
氨氮去除效果如图2所示,实验组氨氮去除率变化出现在投加菌剂约2周后,证明菌剂需要其内部微生物对原有环境产生适应,以及相关功能菌群的富集,才会有强化效果同多数菌剂一样。运行约21 d后,实验组对氨氮去除率增高,稳定后的实验组氨氮去除率最高达99.6%平均去除率约为98.83%,较对照组氨氮平均去除率97.12%提升1.7%。表明两组反应器氨氮氧化程度均表现良好,反应器处于稳定运行状态,氨氧化细菌(AOB)活性充足,保障了后续反硝化脱氮。菌剂有一定强化效果,但由于进水为人工废水且驯化过程使得原先反应器内相关菌种对氨氮负荷适应性较强,固两组氨氮去除表现均良好,实验组对氨氮去除提升效果不明显。
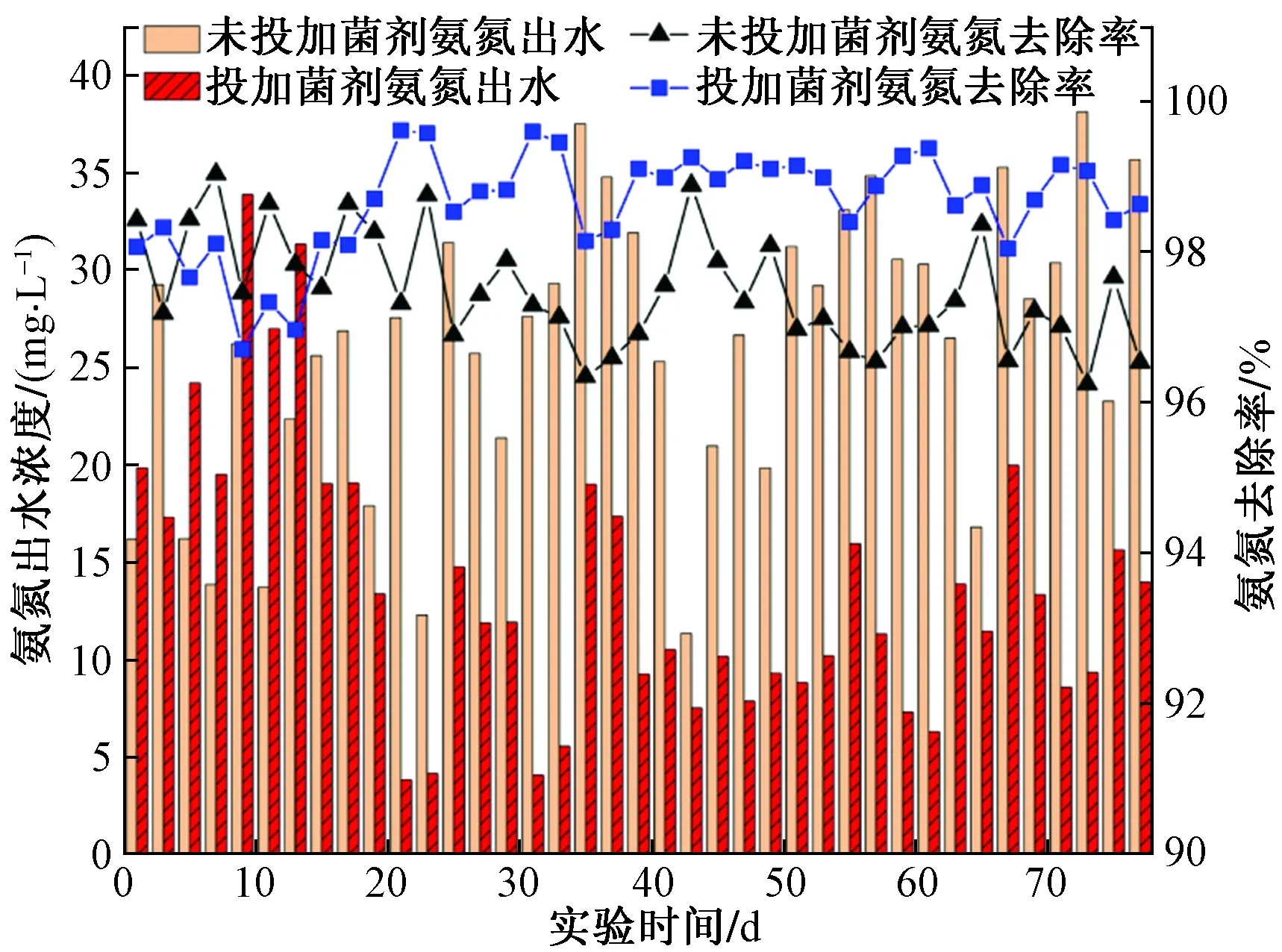
图2 氨氮去除结果Fig.2 Results of ammonia nitrogen removal
两组反应器总氮去除率结果如图3趋势同氨氮相同。对照组反应器运行期间内,出水TN平均浓度252.1 mg/L,平均TN去除率为75.45%。结果近似学者王永庆等[11]的研究,在应用短程硝化-反硝化AOOA工艺处理晚期垃圾渗滤液中,控制稳定的亚硝酸盐累积条件下TN去除率为66.5%~73%。而本实验为人工污水,水质中氮源较易被微生物分解与利用,因此较高于其他学者的研究结论。实验组加入菌剂2周内其TN去除率在误差内波动变化,之后去除率稳定增长最终较为稳定。3周后出水TN达稳定,最大去除率达84.67%,平均TN去除率为81.97%,较对照组增长6.52%。

图3 TN去除结果Fig.3 Results of total nitrogen removal
2.2 功能菌群变化与分析
2.2.1 菌群多样性变化对比分析
污泥样品A1、A2、O1和O2,为从两组组反应器中厌氧池(A)和好氧池(O)取得,A1、O1为对照组,A2、O2为实验组。由高通量测序结果可知,4个样品有效测序条带为37246~47975,覆盖率均超过98%以上,表明序列很少未被检测出,菌落丰度与多样性良好,结果见表2。

表2 细菌群落多样性指数Table 2 Bacterial community diversity indices
Simpson指数与Shannon指数在生态学中可定量的描述一个区域的生物多样性。Simpson 指数值越大,说明群落多样性越低,而Shannon指数相反,其值越高多样性越高。ACE指数和Chao1指数可估算样品中微生物丰度,二者表达方式相同,其值越大代表种群丰度越高。OTUs代表不同的16sRNA序列,可间接代表一种微生物种。从结果可知,投加菌剂的实验组的物种数多于对照组,而在好氧池中的体现较厌氧池更为明显。而 Simpson指数的下降和Shannon指数的上升同样体现这一结果。后观察到两组样品的ACE和Chao1指数均有明显提升,厌氧池Chao1指数从1 744.38升高为2 432.74,好氧池从2 217.35升高为2 730.72,说明投加菌剂可使得微生物种群丰度同样得到提高。
微生物菌群随序列的变化如图4所示,丰度选取ACE指数、多样性选取Shannon指数。可知随着序列的增大ACE指数逐渐提高,且增长趋势区别明显,只有样品O2测试序列数量超过40000以趋近平缓,不同的趋势代表各个序列区间丰度不同,Shannon指数均明显饱和,表明有效序列深度可有覆盖现样品间全部微生物菌落,两指数结果也可体现两系统内微生物群落变化明显。
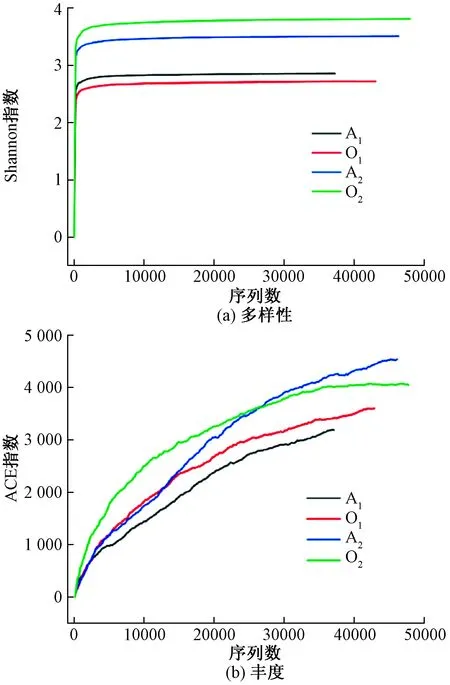
图4 细菌群落丰富度稀疏曲线Fig.4 Rarefaction curves of bacterial community abundance
用聚类热图表明微生物菌落变化绘制如图5所示,区块的颜色代表两样品菌落差异的距离值,如果两者相似度非常接近,则区块呈现为红色,反之则会趋近蓝色。由图5可知,相同反应器取得的样品群落差异偏小,不同反应器间样品的群落存在异较,区块偏红说明两组反应器间群落差异适中,菌剂对原有群落冲击较小。此结果与反应器投加菌剂后最初的脱氮效果变化相对应,波动较小系统同稳定菌落差异。
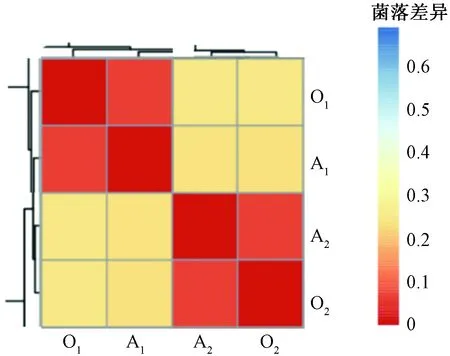
图5 细菌群落结构相关性图Fig.5 Corrlation of bacterial community composition
2.2.2 反应器微生物门水平的变化对比
选取门水平的微生物成分进行对比结果见图6,每个样品分别取占比前7的门进行对比。由结果可知4个样品中前三位的门均相同可判定为共有的优势门,均为Proteobacteria、Bacteroidetes和Chloroflexi,其中Proteobacteria占有绝对比重,A1、A2、O1、O2占比分别为77.2%、73.51%、80.85%、75.49%,其次Bacteroidetes为13.79%、18.93%、11.85%、16.56%,第三的Chloroflexi占比分别为4.05%、1.69%、2.13%、1.79%。Proteobacteria广泛包括了应用于污水处理污水处理固氮脱氮菌,Bacteroidetes则包括较多的厌氧菌存在于污水处理工艺[12]。投加菌剂使得实验组Bacteroidetes占比获得少量提升,Proteobacteria无明显变化。结果与楼菊青等[13]研究一致,高氨氮脱氮污泥中Proteobacteria会占主要部分,Chloroflexi由于氨氮抑制仅会有较少量占比。

图6 细菌群落结构门水平上的组成Fig.6 Bacterial community composition at phylum level
样品后4位所属门不同,对照组厌氧池(A1)为Ignavibacteriae、Planctomycetes、Verrucomicrobia、Spirochaetes,分别占比0.82%、0.63%、0.50%和0.23%。实验组厌氧池(A2)为Planctomycetes、Verrucomicrobia、Firmicutes、Ignavibacteriae,分别占比0.91%、0.59%、0.45%和0.28%。对照组好氧池(O1)为Ignavibacteriae、Planctomycetes、Spirochaetes、Verrucomicrobia,分别占比0.91%、0.71%、0.26%和0.23%。实验组好氧池(O2)为Planctomycetes、Verrucomicrobia、Firmicutes、Ignavibacteriae,分别占比0.70%、0.53%、0.44%和0.22%。综合分析,投加菌剂对脱氮相关的3个优势门主要地位不造成影响,剩余的门类会有变化,例如出现Firmicutes等新优势门类,对原系统稳定性影响很小。
2.2.3 反应器微生物属水平的变化分析
4个样品属水平丰度如图7所示。从图7可得,对照组反应器内Thauera、Nitrosomonas、Solitalea、Ignavibacterium为优势属,A1中占63.12%、2.30%、2.95%及0.82%,O1中占比65.41%、2.20%、1.98%及0.91%。投加菌剂后反应器内Thauera、Thiopseudomonas、Nitrosomonas、Acinetobacter为优势属,A2中占46.55%、4.42%、2.03%和2.67%,O2中占48.54%、3.60%、1.85%和1.87%。并且实验组检测出了原先不存在的如Thermomonas、Flavobacterium、Acinetobacter等菌。总起来讲,实验组较对照组而言实验组微生物多样性与丰度明显更高,这也印证了前两节的结论。
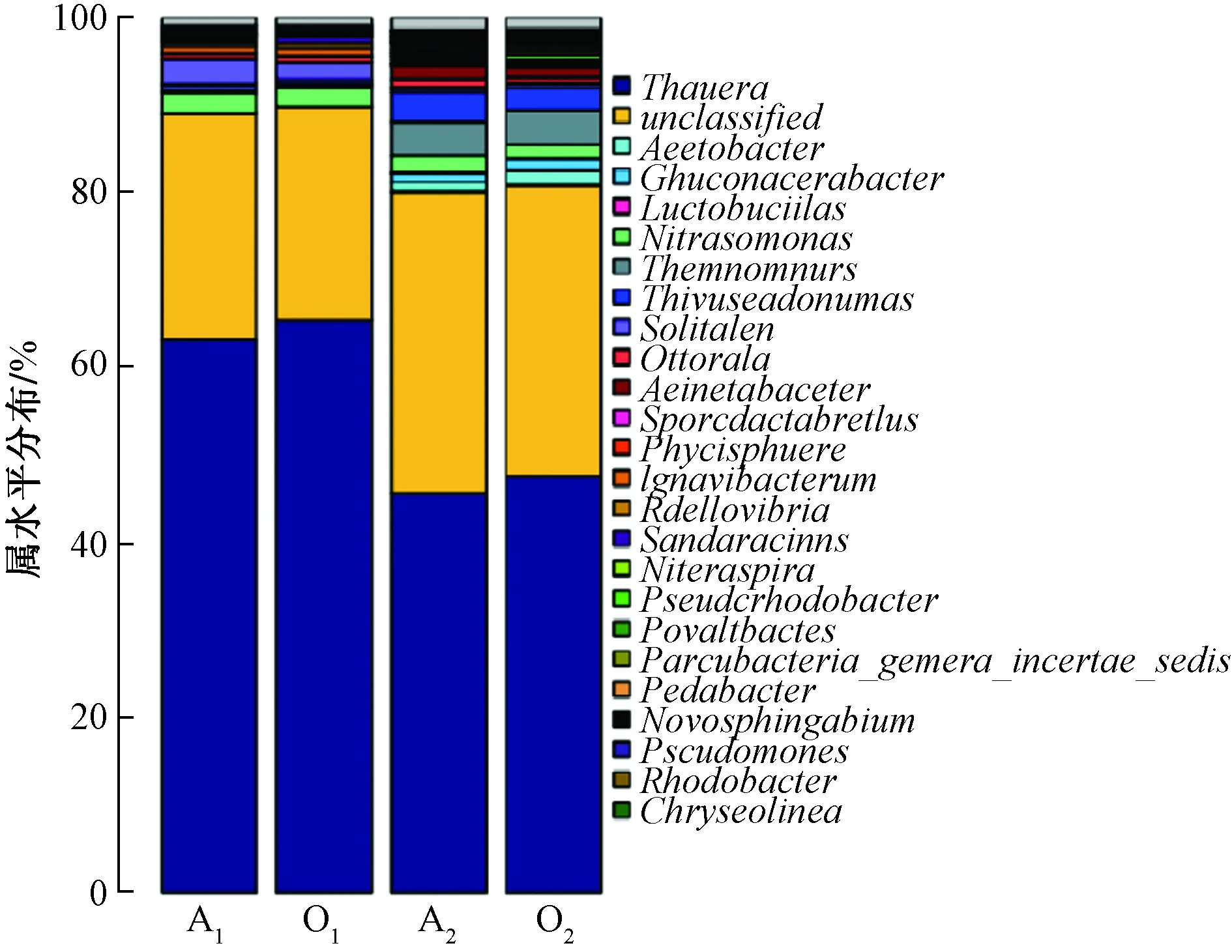
图7 细菌群落结构属水平上的组成Fig.7 Bacterial community composition at genus level
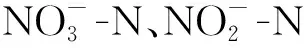

表3 微生物组成变化Table 3 Changes in the microbial components during different stages

综合分析实验组内微生物丰度多样性提高,但反应器内微生物的优势门不变。属水平结果表明,Thauera为主要反硝化菌,均在两组反应器内所占主要比重。实验组内检测出Thiopseudomonas,Acinetobacter与Nitrosomonas,作为典型反硝化菌、硝化菌和AOB,说明该系统具有良好的脱氮性能。系统内脱氮功能菌种类数量均变多,与对氨氮、TN的去除率提升相对应。
3 结论
(1)在A/O短程硝化-反硝化工艺中投加BMc-1复合微生物菌剂,能够有效地强化系统地脱氮效果,处理高氨氮废水效果良好。
(2)菌剂的投加,使得系统内微生物总量增多,且微生物的丰度、多样性均得到提高。未改变Proteobacteria、Bacteroidetes、Chloroflexi为主导细菌门,对原微生物菌落的冲击较小,可较为稳定的发挥作用。
(3)系统中Thauera与Nitrosomonas占比下降但数量稳定,Pseudomonas、Pedobacter、Thiopseudomonas、Terrimonas这4种反硝化菌被检测出占比提升,以及检测出Nitrosomonas、Acinetobacter、Candidatus、Hydrogenedens等其他脱氮相关功能菌,解释了菌剂对系统脱氮的强化效果。

