lncRNA FLVCR1-AS1靶向miR-381-3p对结直肠癌细胞增殖、凋亡的影响及其分子机制
许国彩,刘芝兰,逯艳艳
青海省人民医院,西宁810002
结直肠癌(CRC)是威胁人类生命安全的恶性肿瘤之一,其发生发展的分子机制较为复杂,癌基因或抑癌基因异常表达与CRC发生及发展密切相关[1,2]。因此,进一步探究CRC发生发展的分子机制有助于提高疗效及改善患者预后。长链非编码RNA(lncRNA)在CRC等恶性肿瘤中异常表达,并可发挥癌基因或抑癌基因作用[3]。有研究发现,lncRNA FLVCR1-AS1在肺癌细胞中高表达,沉默表达后可抑制肺癌细胞增殖、迁移及侵袭[4];另外,FLVCR1-AS1还可作为miR-155的竞争性内源RNA促进胃癌的发生[5]。但是,FLVCR1-AS1在CRC发生发展过程中的作用机制尚未见报道。Starbase预测FLVCR1-AS1与微小RNA-381-3p(miR-381-3p) 存在结合位点,而miR-381-3p可通过靶向LRP6表达抑制乳头状甲状腺癌细胞增殖、迁移及侵袭[6],或通过靶向FGFR2的表达从而抑制口腔鳞状细胞癌细胞的增殖[7]。但是,CRC中是否存在FLVCR1-AS1靶向调控miR-381-3p表达尚未可知。2017年2月~2019年10月,我们通过检测FLVCR1-AS1、miR-381-3p在CRC细胞中的表达水平,探讨其对CRC细胞增殖及凋亡的影响及其可能的调控作用机制,旨在为CRC的靶向治疗提供新方向。
1 材料与方法
1.1 材料与试剂 正常结肠上皮细胞FHC购自美国ATCC细胞库;CRC细胞SW480、DLD-1、HCT116购自中国科学院细胞库。RPMI 1640培养基、胎牛血清(FBS)、胰蛋白酶均购自美国Gibco公司;FLVCR1-AS1小干扰RNA(si-FLVCR1-AS1)及乱序无意义序列(si-con)、miR-381-3p模拟物(mimics)及阴性对照mimic NC序列(miR-con)、miR-381-3p特异性寡核苷酸抑制剂(anti-miR-381-3p)及其阴性对照(anti-miR-con)均购自上海吉玛制药技术有限公司;Lipofectamine2000购自上海阳光生物科技有限公司;TRIzol、反转录试剂盒与SYBR荧光染料试剂盒均购自美国Thermo Fisher公司;MTT购自武汉艾美捷科技有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自大连美仑生物技术有限公司;双荧光素酶报告基因检测试剂盒购自北京全式金生物技术有限公司;RIPA蛋白裂解液、TBST溶液、BCA蛋白定量检测试剂盒、ECL均购自美国Sigma公司;兔抗人细胞周期蛋白D1(Cyclin D1)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved-Caspase-3)抗体均购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司。
1.2 实验方法
1.2.1 细胞培养 取冻存的FHC、SW480、DLD-1、HCT116,置于37 ℃恒温水浴锅内融解,于含10% FBS的RPMI 1640培养基中培养;以1 000 r/min转速离心5 min,弃上清,置于37 ℃、5% CO2培养箱培养;每3 d更换1次培养液,细胞传代培养。
1.2.2 细胞中FLVCR1-AS1、miR-381-3p表达检测 采用qRT-PCR法。取对数生长期的细胞,根据TRIzol试剂盒提取细胞总RNA;利用紫外分光光度计检测RNA浓度与纯度,参照反转录试剂盒将总RNA反转录合成cDNA。FLVCR1-AS1正向引物为5′-GTGGCTCTCTCGTTCCC-3′,反向引物为5′-CCGTCCTTCGGTAGTGTC-3′;miR-381-3p正向引物为5′-CTAGTGATATACTTTATGTCACTT-3′,反向引物为5′-CATCATAGAAATAGAGTGTTTAAG-3′,均由上海生工生物工程股份有限公司设计合成。再以cDNA为模板,参照SYBR荧光染料试剂盒说明书配置反应体系,置于PCR仪进行扩增。反应条件:95 ℃ 2 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共循环40次。FLVCR1-AS1以β-actin为内参,miR-381-3p以U6为内参,采用2-ΔΔCt计算FLVCR1-AS1、miR-381-3p相对表达量。
1.2.3 细胞分组与转染处理 取FLVCR1-AS1表达最高的对数生长期CRC细胞,以胰蛋白酶消化;调整细胞密度至5×103/mL;以200 μL/孔接种于6孔板,随机分为7组:NC组不处理,si-con组转染si-con,si-FLVCR1-AS1组转染si-FLVCR1-AS1,miR-con组转染miR-con,miR-381-3p组转染miR-381-3p mimics,si-FLVCR1-AS1+anti-miR-con组共转染si-FLVCR1-AS1与anti-miR-con,si-FLVCR1-AS1+anti-miR-381-3p组共转染si-FLVCR1-AS1与anti-miR-381-3p;转染前1 h更换为不含FBS的培养基,参照Lipofectamine2000转染试剂盒说明书操作,转染6 h后更换为含10% FBS的RPMI 1640培养基继续培养48 h。
1.2.4 细胞增殖情况观察 采用MTT法。收集各组细胞,以100 μL/孔(3×105/mL)接种96孔板;分别于接种24、48、72 h时,加入5 mg/mL的MTT溶液20 μL室温孵育4 h。弃上清,加入二甲基亚砜(DMSO)溶液150 μL,37 ℃摇床内孵育10 min;置于酶标仪上检测490 nm波长下各孔吸光度(A),每组实验均重复3次。细胞存活率(%)=(实验孔A值-空白对照孔A值)/(正常对照孔A值-空白对照孔A值)×100%。
1.2.5 细胞凋亡情况观察 采用流式细胞术。收集各组细胞,以预冷的PBS洗涤,用胰蛋白酶消化;以10 000 r/min离心5 min,PBS洗涤,加入1 mL结合缓冲液;再以10 000 r/min离心5 min,加入100 μL结合缓冲液;分别加入5 μL Annexin V-FITC与PI,室温避光孵育20 min;加入400 μL结合缓冲液,置于流式细胞仪检测算细胞凋亡率。
1.2.6 细胞中Cyclin D1、Cleaved-Caspase-3蛋白检测 采用Western blotting法。取各组细胞,加入RIPA裂解液,冰上裂解30 min;常规离心后提取细胞总蛋白,BCA定量蛋白;制备浓缩胶与分离胶,进行SDS-PAGE电泳分离蛋白;转膜、封闭后分别加入各蛋白一抗稀释液,其中Cyclin D1稀释1∶500、Cleaved-Caspase-3稀释1∶1 000,4 ℃孵育24 h;TBST洗涤,加入二抗(1∶2 000)孵育1 h;TBST洗涤,ECL显影,以凝胶成像系统及Quantityone软件检测条带灰度值;以β-actin为内参,用目的蛋白与内参灰度值比值表示目的蛋白相对表达量。
1.2.7 FLVCR1-AS1与miR-381-3p的调控关系分析 先用Starbase对FLVCR1-AS1和miR-381-3p结合进行预测,将含有结合位点的片段插入PGL3荧光素酶报告基因载体构建野生型载体WT-FLVCR1-AS1;利用基因突变技术将结合位点进行突变,将含有突变位点的片段插入PGL3荧光素酶报告基因载体构建突变型载体MUT-FLVCR1-AS1。在结肠癌细胞中转染miR-381-3p mimics/miR-con和FLVCR1-AS1野生型/突变型报告基因载体,按照双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
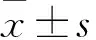
2 结果
2.1 正常结肠上皮细胞与CRC细胞中FLVCR1-AS1、miR-381-3p表达比较 与FHC比较,SW480、DLD-1、HCT116中FLVCR1-AS1表达水平均升高而miR-381-3p表达水平均降低(P均<0.05);其中SW480的FLVCR1-AS1表达最高,因而选用SW480细胞进行后续研究。见表1。
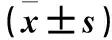
表1 正常结肠上皮细胞与CRC细胞中FLVCR1-AS1、miR-381-3p表达比较
2.2 各组SW480细胞增殖、凋亡情况及细胞中Cyclin D1、Cleaved-Caspase-3蛋白表达量比较 与NC组、si-con组、miR-con组比较,si-FLVCR1-AS1组、si-FLVCR1-AS1+anti-miR-con组细胞存活率降低、细胞凋亡率升高,细胞中Cyclin D1蛋白表达量降低、Cleaved-Caspase-3蛋白表达量升高(P均<0.05);miR-381-3p组细胞存活率降低、细胞凋亡率升高,细胞中Cyclin D1蛋白表达量降低、Cleaved-Caspase-3蛋白表达量升高(P均<0.05);NC组、si-con组、miR-con组两两比较,差异均无统计学意义;与si-FLVCR1-AS1+anti-miR-con组比较,si-FLVCR1-AS1+anti-miR-381-3p组细胞存活率升高、细胞凋亡率降低,细胞中Cyclin D1蛋白表达量升高、Cleaved-Caspase-3蛋白表达量低(P均<0.05)。见表2。
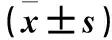
表2 各组SW480细胞增殖、凋亡情况及细胞中Cyclin D1、Cleaved-Caspase-3蛋白表达量比较
2.3 FLVCR1-AS1与miR-381-3p的调控关系 Starbase预测显示,FLVCR1-AS1与miR-381-3p存在靶向结合位点,见图1。双荧光素酶报告实验结果显示,在转染野生型载体WT-FLVCR1-AS1的SW480细胞中,共转染miR-381-3p mimics的荧光素酶活性低于共转染miR-con的细胞(P<0.05);在转染突变型载体MUT-FLVCR1-AS1的SW480细胞中,共转染miR-con或miR-381-3p mimics的荧光素酶活性无明显变化。见表3。

图1 FLVCR1-AS1和miR-381-3p结合的Starbase预测示意图
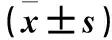
表3 miR-381-3p mimics/miR-con和WT/MUT-FLVCR1-AS1报告基因载体共转染SW480细胞后荧光素酶活性比较
3 讨论
lncRNA不具有编码蛋白质的功能,但可通过与miRNA或蛋白质相互作用从而调控细胞增殖、分化等过程。研究表明,lncRNA可通过调控肿瘤细胞生长、凋亡及转移等生物学行为从而影响CRC发生发展进程[8~10]。目前CRC发病率及病死率仍逐年上升,CRC的基因治疗虽取得一定效果,但患者生存期仍较短。因此,本研究积极探寻新型lncRNA分子,通过分析其在CRC发生及发展中的分子机制,为CRC基因治疗提供潜在靶点。
研究发现,FLVCR1-AS1可通过调控miR-513/YAP1分子轴促进卵巢癌细胞迁移、侵袭及EMT转化过程[11];另外,FLVCR1-AS1还可充当miR-485-5p的海绵分子从而促进胆管癌细胞增殖、迁移及侵袭[12],或充当miR-573的海绵分子而促进肺癌细胞增殖及侵袭[13]。但是,FLVCR1-AS1在CRC中的表达水平尚未可知。本研究结果显示,FLVCR1-AS1在CRC不同细胞中的表达水平均高于正常结肠上皮细胞,提示FLVCR1-AS1表达升高可能促进CRC的发生。本研究通过体外细胞实验发现,抑制FLVCR1-AS1的表达可降低CRC细胞活力,提高细胞凋亡率,提示抑制FLVCR1-AS1表达可抑制CRC细胞增殖、促进细胞凋亡。众所周知,细胞增殖与细胞凋亡失衡是导致肿瘤发生发展的重要原因之一。研究表明,Cyclin D1与CDK6结合形成复合物可促进细胞周期由G1期进展为S期,从而加速细胞增殖[14];细胞收到凋亡信号时,Caspase-3被激活形成Cleaved-Caspase-3从而促进细胞凋亡[15]。本研究结果显示,抑制FLVCR1-AS1表达后,CRC细胞中Cyclin D1表达水平降低而Cleaved-Caspase-3表达水平升高。这提示抑制FLVCR1-AS1表达可能通过上调Cleaved-Caspase-3表达及下调Cyclin D1表达,从而抑制CRC细胞增殖并诱导细胞凋亡。
研究表明,lncRNA可通过充当miRNA竞争性结合内源性RNA而发挥作用。本研究通过Starbase预测显示,FLVCR1-AS1与miR-381-3p存在靶向结合位点;双荧光素酶报告实验证实,FLVCR1-AS1能够特异性结合miR-381-3p。研究发现,miR-381-3p在宫颈癌细胞中呈低表达,并可通过下调FGF7表达而抑制宫颈癌的进展[16];膀胱癌细胞miR-381-3p表达量降低,还可促进膀胱癌细胞周期转换[17]。相关报道显示,敲减SETDB1后可通过上调miR-381-3p表达以抑制乳腺癌进程[18]。本研究结果显示,miR-381-3p在CRC细胞中的表达水平降低;进一步研究发现,miR-381-3p过表达后,CRC细胞活力降低,细胞凋亡率升高,Cyclin D1蛋白表达量降低,Cleaved-Caspase-3蛋白表达量升高,提示miR-381-3p过表达可抑制CRC细胞增殖并促进细胞凋亡。为探究FLVCR1-AS1是否通过调控miR-381-3p影响CRC发生及发展进程,我们对SW480共转染si-FLVCR1-AS1与anti-miR-381-3p;结果显示,抑制miR-381-3p表达可逆转抑制FLVCR1-AS1表达对CRC细胞增殖及凋亡的影响。这提示抑制FLVCR1-AS1的表达可通过上调miR-381-3p的表达,从而抑制CRC细胞增殖并诱导细胞凋亡。
综上所述,在CRC中FLVCR1-AS1呈高表达,miR-381-3p表达下调;FLVCR1-AS1可能通过充当miR-381-3p竞争性内源性RNA而抑制其表达,从而促进CRC细胞增殖并抑制细胞凋亡,该作用可通过上调Cleaved-Caspase-3表达及下调Cyclin D1表达实现。因此,FLVCR1-AS1可能作为CRC诊断及治疗的潜在靶点。但关于体内实验与临床研究中FLVCR1-AS1与miR-381-3p的表达及其调控作用仍需进一步证实,同时关于miR-381-3p下游可能调控的靶基因还需深入研究。

