转染靶向Bcl-xL脱氧核酶后直肠癌细胞SW837的辐射和化疗敏感性变化
于震,曾祥岳,孟涛,葛磊,杨新辉
新疆医科大学第三临床医学院(附属肿瘤医院),乌鲁木齐830010
结直肠癌(CRC)是临床常见的恶性肿瘤之一,治疗方法主要为手术切除及放化疗[1];当手术切除肿瘤组织后,一些患者需行化疗或放疗等辅助疗法清除残存肿瘤细胞[2]。5-氟尿嘧啶(5-FU)是一种临床常用化疗药物,放疗中多使用电离辐射如X射线,二者均通过诱导细胞凋亡的方式达到抗肿瘤治疗作用[3,4]。Bcl-xL属于抗凋亡蛋白,可通过调控线粒体膜通透性及抑制细胞色素C释放来阻止细胞凋亡[5]。已有研究表明,Bcl-xL在CRC组织中高表达,且与患者不良预后呈正相关[6,7]。这些结果提示,直肠癌细胞中Bcl-xL高表达可能会增加治疗的抗性程度。因此,从凋亡角度开发靶向Bcl-xL的药物,将有助于提高放化疗的疗效。脱氧核酶是一种兼具较高催化活性及较好稳定性的新型核酶,能特异地切割单链RNA(ssRNA)中嘌呤-嘧啶连接的寡核苷酸,具有催化降解RNA的作用[8]。RNA切割作用是目前研究的热点,可用来靶向敲低目的基因的表达[9,10]。Yu等[11]针对Bcl-xL设计出了一系列脱氧核酶,其中DT888、DT884、DT883和DT882可有效抑制Bcl-xL在人前列腺癌PC3细胞中蛋白水平的表达,DT882可诱导PC3细胞凋亡并降低其细胞活力。2018年9月~2019年1月,我们观察了靶向Bcl-xL脱氧核酶对直肠癌细胞SW837辐射和化疗敏感性的影响,为靶向Bcl-xL脱氧核酶的临床研究提供实验基础。
1 材料与方法
1.1 材料 细胞:直肠癌细胞系SW837购自美国ATCC细胞库。主要试剂:胎牛血清、L-15培养基购自美国Hyclone公司;MTT试剂、蛋白裂解液购自上海碧云天生物科技有限公司;Bcl-xL抗体购自美国CST公司;5-FU购自美国MCE公司;Annexin V-FITC/PI试剂盒购自中国贝博生物;DT882以及随机对照序列由生工生物工程(上海)股份有限公司合成(DT882序列:5′-TTTTTATAAGGCTAGCTACAACGAAGGGATGGG-3′);转染试剂Lipofectamine3000以及TRIzol试剂购自美国Thermo Fisher公司。
1.2 实验方法
1.2.1 细胞培养与辐射、化疗剂量的确定 将SW837细胞培养在含有10%胎牛血清的L-15培养基中,待细胞处于对数生长期时消化细胞,按照1×104/孔接种到96孔板中培养过夜。取SW837细胞,分别以终浓度5、10、20 mg/L的5-FU处理,或采用美国RadSource直线加速器(设置参数为160 kV、25 mA,剂量率为1.15 Gy/min)以2、4、6、8 Gy的X射线进行照射处理。处理48 h后加入20 μL MTT溶液,孵育4 h。弃去培养液,加入150 μL DMSO,震荡摇匀;用酶标仪检测波长492 nm时的吸光度,计算细胞增殖抑制率。结果显示,X射线以及5-FU均呈剂量依赖性抑制SW837的细胞活力,X射线剂量为8 Gy时抑制率最高(88.46%±1.70%),5-FU浓度为20 mg/L时抑制率最高(65.03%±1.15%)。在后续实验中,采用8 Gy X射线以及20 mg/L 5-FU进行处理。
1.2.2 细胞分组与转染处理 将SW837细胞培养在含有10%胎牛血清的L-15培养基中,待细胞处于对数生长期时消化细胞,按照3×105/孔接种到6孔板中培养过夜。将细胞随机分为6组:转染对照组、转染辐射组、转染化疗组均先用Lipofectamine3000转染试剂转染脱氧核酶DT882,对照组、对照辐射组、对照化疗组均不转染处理;转染48 h后,转染辐射组、对照辐射组均以8 Gy X射线处理48 h,转染化疗组、对照化疗组均以20 mg/L 5-FU处理48 h,转染对照组和对照组不处理。
1.2.3 细胞中Bcl-xL mRNA检测 采用荧光定量PCR法。收集各组细胞,采用TRIzol提取细胞总RNA,反转录成cDNA;以cDNA为模板,采用荧光定量PCR试剂检测Bcl-xL mRNA表达。引物序列:Bcl-xL上游为5′-ACTTACCTGAATGACCACCTAGAGCC-3′,下游为5′-GAAGAGTGAGCCCAGCAGAACC-3′;β-actin上游为5′-CAACCGCGAGAAGATGACCCAGAT-3′,下游为5′-ACGGCCAGAGGCGTACAGGGAT-3′。采用2-ΔΔCt法进行数据分析,以β-actin作为内参,计算Bcl-xL基因相对表达量。
1.2.4 细胞中Bcl-xL蛋白检测 采用Western blotting法。收集各组细胞,以RIPA裂解液提取细胞总蛋白,采用10% SDS-PAGE凝胶进行电泳;采用PVDF膜进行蛋白转移,分别用Bcl-xL、β-actin一抗以及对应的二抗进行孵育;ECL发光液曝光,采用凝胶成像仪拍照并进行分析,以目的蛋白与内参吸光度比值作为Bcl-xL蛋白相对表达量。
1.2.5 细胞凋亡情况观察 采用流式细胞术。收集各组细胞,以胰酶消化细胞;先用Annexin V-FITC试剂染色15 min,再以PI复染15 min;采用BD公司流式细胞仪检测凋亡细胞,计算细胞凋亡率。
2 结果
2.1 各组细胞中Bcl-xL表达比较 细胞中Bcl-xL mRNA及蛋白表达量对照组>对照辐射组、对照化疗组>转染对照组>转染辐射组、转染化疗组,P均<0.05或<0.01;对照辐射组与对照化疗组、转染辐射组与转染化疗组比较,P均>0.05。见表1。
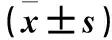
表1 各组细胞中Bcl-xL表达比较
2.2 各组细胞凋亡率比较 细胞凋亡率对照组(3.41%±1.22%)<对照辐射组(26.16%±3.60%)、对照化疗组(29.17%±4.29%)<转染对照组(28.72%±3.07%)<转染辐射组(55.58%±6.16%)、转染化疗组(58.15%±7.39%),P均<0.01;对照辐射组与对照化疗组、转染辐射组与转染化疗组比较,P均>0.05。
3 讨论
细胞凋亡通路的抑制在多种肿瘤发生发展中具有重要作用,诱导细胞凋亡也是目前肿瘤治疗的重要手段。本研究发现,临床常用的治疗手段如放疗使用的X射线以及化疗药物5-FU均可诱导直肠癌细胞SW837凋亡,并降低Bcl-xL的表达;通过使用脱氧核酶DT228靶向敲低SW837细胞中Bcl-xL表达后,则极大地增加X射线以及5-FU治疗的放化疗敏感性。以上结果表明,靶向Bcl-xL脱氧核酶DT228可通过降低Bcl-xL表达的方式,提高直肠癌细胞SW837辐射敏感性和化疗药物敏感性。
Bcl-xL属于Bcl-2家族成员,在细胞凋亡信号转导中具有重要作用。Bcl-2家族蛋白可通过与具有BH3结构域的促凋亡蛋白Bax或Bak蛋白结合,形成的异源二聚体可抑制细胞凋亡发生[12]。Bcl-2家族蛋白成员包括Bcl-2、Bcl-w、Mcl-1、Bfl-1和Bcl-xL,只有Bcl-xL在人结肠癌组织中高表达[7,13]。特异性敲除小肠上皮细胞Bcl-xL表达可显著降低炎症刺激所诱导的肿瘤发生,且Bcl-xL抑制剂ABT-737可诱导结肠癌细胞凋亡[7]。这些研究结果均表明,Bcl-xL高表达介导的凋亡逃逸在结肠癌发生发展中发挥重要作用,靶向Bcl-xL是结肠癌潜在的治疗靶点。
脱氧核酶是一类兼具有较高催化活性及稳定性的新型核酶[8],完全由DNA构成。在体内环境中,其结构上的稳定性远高于内源性RNA构成的核酶,并能够使得RNA发生水解,从而在转录水平上发挥基因调控作用[10]。已有研究发现,靶向Bcl-xL脱氧核酶可诱导前列腺癌PC3细胞凋亡[11]。本研究发现,靶向Bcl-xL脱氧核酶DT882不仅可抑制直肠癌SW837细胞Bcl-xL的表达,同时可诱导细胞凋亡,提示靶向Bcl-xL脱氧核酶具有抗直肠癌细胞作用。
目前,以5-FU为基础的化疗和X射线为基础的放疗被广泛用于临床CRC的治疗。5-FU以及X射线主要通过线粒体依赖的凋亡方式诱导肿瘤细胞凋亡[13]。研究发现,多种肿瘤细胞中抗凋亡蛋白(如Bcl-xL)表达异常升高,这可能是导致其放化疗抵抗性的重要机制[14]。已有研究表明,Bcl-xL高表达可抑制5-FU对CRC细胞凋亡的诱导作用[15]。这些结果提示,靶向抑制Bcl-xL表达可能有效提高5-FU的化疗效果。反义脱氧核酸和miR-122均可通过靶向Bcl-xL下调其表达的方式诱导CRC细胞凋亡,并增加CRC细胞对5-FU的药物敏感性[16,17]。研究发现,靶向Bcl-xL脱氧核酶DT882可增加前列腺癌细胞PC3对紫杉醇的药物敏感性[9]。本研究发现,与单一处理相比,DT882与5-FU复合处理显著诱导直肠癌细胞SW837凋亡,同时抑制Bcl-xL的表达,提示靶向Bcl-xL脱氧核酶DT882可增加直肠癌细胞SW837对5-FU的化疗敏感性。
与对5-FU的抗性机制类似,肿瘤细胞辐射敏感性的降低亦与Bcl-xL高表达相关。因此,靶向抑制Bcl-xL也能够增加肿瘤细胞的辐射敏感性。通过siRNA方法降低Bcl-xL表达不仅可以抑制CRC细胞增殖、迁移与侵袭,也通过促进凋亡的方式增加细胞的辐射敏感性[18]。与单独X射线处理相比,Bcl-xL抑制剂ABT-737可有效抑制肺癌移植瘤的生长[19]。在细胞水平上,Bcl-xL抑制剂ABT-737也可增加HeLa细胞的辐射敏感性[20]。此外,下调Bcl-xL表达也可显著增加骨肉瘤细胞以及前列腺癌细胞的辐射敏感性[21,22]。除Bcl-xL抑制剂外,靶向Bcl-xL也可达到与ABT-737相同的治疗效果。本研究发现,X射线可抑制直肠癌细胞Bcl-xL表达,提示Bcl-xL表达下调可能参与了X射线对细胞凋亡的诱导作用;当靶向Bcl-xL脱氧核酶与X射线复合处理时,DT882显著增加X射线诱导的细胞凋亡。这些结果表明,脱氧核酶与X射线的联合使用可能是CRC有效的治疗手段。
值得注意的是,虽然靶向Bcl-xL脱氧核酶可与Bcl-xL抑制剂达到相同的促进凋亡效果,但其具体机制不同。广泛研究的Bcl-xL抑制剂ABT-737属于BH3类似药物,其作为拮抗剂可与Bcl-2家族蛋白高亲和力结合,从而破坏Bcl-2家族蛋白与促凋亡蛋白Bax、Bak结合,达到促进凋亡的作用[23]。而脱氧核酶可以选择性地与靶基因结合,从转录水平上直接抑制靶基因表达。此外,相比于其他类型的药物,脱氧核酶更加便宜且具有较高的稳定性[8,24],这些优点使脱氧核酶成为具有广泛应用前景的分子靶向治疗药物。本研究发现,靶向Bcl-xL脱氧核酶DT882可增加直肠癌细胞SW837对X射线的辐射敏感性以及对5-FU的药物敏感性,其机制可能与DT882抑制Bcl-xL表达进而促进细胞凋亡相关。因此,靶向Bcl-xL脱氧核酶DT882可能具有一定的临床应用前景。

