lncRNA-SNHG5在重度子痫前期胎盘组织中的表达及其对滋养细胞增殖能力影响的机制▲
彭迎春 张 媛 杨志娟 万晓丽 杨 洋 师增增
(1 四川省乐山市人民医院妇产科,乐山市 614000,电子邮箱:344875025@qq.com;2 西安医学院第一附属医院妇产科,陕西省西安市 710077;3 中国人民解放军空军军医大学第二附属医院妇产科,陕西省西安市 710038)
子痫前期是一种以新发高血压和蛋白尿为特征的妊娠期常见特异性疾病,危及母儿安全[1]。子痫前期的确切发病机制不清,相关研究表明,其是多因素、多机制及多通路引起的疾病,其中滋养细胞增殖障碍、凋亡增加,螺旋动脉重塑受损引发后续病理性胎盘形成,为主要的机制学说[2]。因此,了解滋养细胞功能相关影响因素,对探究子痫前期的病因具有一定意义。
长链非编码RNA(long non-coding RNA,lncRNA)长度超过200nt且不能编码蛋白质,其不仅参与细胞增殖和凋亡、血管生成、肿瘤转移等过程,还能以多种方式调控同为非编码RNA属性的微小RNA(microRNA,miRNA),间接影响miRNA的靶基因,从而发挥相关生理功能[3]。研究显示,部分lncRNA能够调节滋养层细胞的侵袭和迁移,与子痫前期有关[4]。lncRNA-小核仁 RNA宿主基因5(small nucleolar RNA host gene 5,SNHG5)在黑色素瘤细胞中能够通过对miRNA-155发挥竞争性内源RNA(competing endogenous RNA,ceRNA)作用,促进细胞增殖,并抑制细胞凋亡[5]。而miRNA-155与子痫前期的相关性研究已较为深入,其在子痫前期患者胎盘组织中病理性高表达,并靶向调控细胞周期蛋白D1(cyclin D1)的表达从而影响滋养细胞增殖、迁移[6]。因此,lncRNA- SNHG5是否与子痫前期相关,及其能否通过对miRNA-155发挥ceRNA作用,从而影响滋养细胞功能参与疾病发病过程,值得探究。本研究主要分析了lncRNA-SNHG5在重度子痫前期(severe preeclampsia,sPE)孕妇胎盘组织中的表达情况,及其通过调控miRNA-155及cyclin D1对人正常滋养细胞HTR8增殖的影响。
1 材料与方法
1.1 临床标本来源 收集2018年10月至2019年6月于乐山市人民医院妇产科住院首次接受剖宫产分娩的60例产妇的胎盘组织,其中sPE孕妇30例(sPE组)、健康孕妇 30例(正常组)。sPE组的诊断均符合第9版《妇产科学》[7]中的相关标准。两组均排除合并糖尿病、心脏病、慢性高血压、慢性肾炎、自身免疫疾病、血栓形成病症、精神疾病者,以及既往有阴道或剖宫产分娩史、胎儿畸形和HELLP综合征病史者。两组研究对象在体质指数、年龄、妊娠时间比较,差异均无统计学意义(均P>0.05),见表1。收集的胎盘组织用无菌磷酸盐缓冲盐水洗涤,立即在液氮中快速冷冻,然后在-80℃下储存待检。本研究经医院伦理委员会批准,所有纳入研究对象均签署知情同意书。
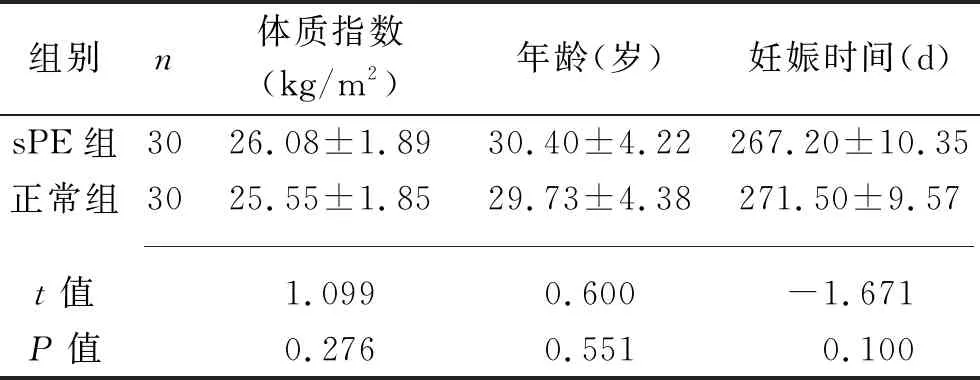
表1 两组研究对象一般资料比较(x±s)
1.2 细胞株及主要试剂、仪器 人绒毛膜滋养层细胞HTR8购自美国ATCC公司。RPMI-1640培养基、胎牛血清购自美国Thermo Fisher Scientific公司(批号:MFCD00217820、10099141);空质粒(pcDNA3.1)和SNHG5过表达质粒(pcDNA3.1-SNHG5)购自中国上海吉玛公司;SNHG5抑制序列小干扰RNA(small interfering RNA,siRNA)、PCR引物由中国广州瑞博公司合成;TRIzol试剂购自美国Invitrogen公司(批号:15596026);PrimeScript RT Master Mix及PrimeScriptⅡ 1st Strand cDNA Synthesis Kit反转录试剂盒、SYBR Premix Ex Taq试剂盒购自日本TaKaRa公司(批号:RR036A,6210A,DRR041A);脂质体 2000试剂盒购自美国Invitrogen公司(批号:11668-027);细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自中国碧云天公司(批号:C0037);SDS裂解液及蛋白提取试剂盒购自美国Invitrogen公司(批号:88700);鼠抗人cyclin D1单克隆抗体、鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、辣根过氧化物酶标记的二抗购自英国Abcam公司(批号:EPR2241,EPR16891,ab6728)。CFX96型实时荧光定量PCR分析仪购自美国Bio-Rad公司,iBright CL750化学发光检测系统、Multiskan FC酶标仪购自美国Thermo Fisher Scientific公司。
1.3 细胞培养与转染 将HTR8细胞复苏后,接种培养在含10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素(购自中国碧云天公司,批号:ST488-1、ST488-2)的RPMI-1640培养基中。将细胞置于37℃、5%二氧化碳培养箱中培养,取对数生长期HTR8细胞,将细胞分为对照组、过表达组、抑制组采用六孔板进行细胞转染实验,按照脂质体2000试剂盒说明书步骤,分别进行空质粒(pcDNA3.1)、lncRNA-SNHG5过表达质粒(pcDNA3.1-lncRNA-SNHG5)、siRNA(lncRNA-SNHG5抑制序列)的转染,转染后培养条件同前。每组设置5个复孔,转染后6 h行第1次细胞换液。
1.4 实时荧光定量PCR法检测相关基因表达水平 按照TRIzol试剂盒说明步骤,提取冻存sPE组、正常组胎盘组织以及各转染组转染48 h后细胞的总RNA,并检测RNA质量及浓度。根据PrimerBank(https://pga.mgh.harvard.edu/primerbank/)公布的基因序列设计合成lncRNA-SNHG5、miRNA-155、cyclin D1及内参U6、β-肌动蛋白(β-actin)的引物序列,具体序列见表2。使用PrimeScript RT Master Mix反转录合成lncRNA-SNHG5、cyclin D1 cDNA,使用PrimeScriptⅡ 1st Strand cDNA Synthesis Kit 反转录合成miRNA-155 cDNA。分别以U6、β-actin为内参,按照SYBR Premix Ex Taq试剂盒说明行实时定量PCR。PCR总反应体系为25 μL,其中含2 μL cDNA、上下游引物各1 μL、12.5 μL SYBR Premix Ex Taq试剂、8.5 μL灭菌蒸馏水。采用两步法进行扩增反应,反应条件为95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环。采用基于比较Ct法计算目的基因的相对表达水平。每次设定3个复孔,实验重复3次。

表2 目的基因引物序列
1.5 CCK-8 法检测细胞增殖 按照CCK-8测定试剂盒说明步骤,检测各组细胞转染后增殖能力。对数生长期HTR8细胞,调整细胞密度至2×103个/100 μL,接种于96孔细胞培养板中,分为对照组、过表达组、预制组,按照1.3步骤进行转染,24 h、48 h、72 h后,加入等量CCK-8试剂溶液孵育1 h后,于酶标仪上读取波长为450 nm处的吸光度值(A值)。实验重复3次。
1.6 免疫印迹法检测各组细胞cyclin D1蛋白的表达水平 采用SDS裂解溶液裂解各组细胞后提取总蛋白,二喹啉甲酸法蛋白测定试剂盒检测蛋白质浓度。蛋白上样后进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量的蛋白质,然后将蛋白转移到聚偏二氟乙烯膜上。用5%脱脂乳在室温下将膜封闭1 h,然后在4℃下与鼠抗人cyclin D1(1 ∶2 500)、鼠抗人GAPDH(1 ∶1 500)单克隆抗体孵育过夜。次日用TBST洗膜后将膜与辣根过氧化物酶标记的二抗(1 ∶5 000)在室温下孵育1 h。使用化学发光检测系统检测印迹条带。目的蛋白的表达量以cyclin D1/内参GAPDH灰度值比值表示。实验重复3次。
1.7 统计学分析 使用SPSS 19.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用两独立样本t检验;多级间比较采用单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组胎盘组织lncRNA-SNHG5的表达情况 sPE组lncRNA-SNHG5相对表达水平为0.63±0.14,低于正常组的0.99±0.06(t=-13.007,P<0.001)。
2.2 转染后各组HTR8细胞中 lncRNA-SNHG5、miRNA-155以及cyclin D1的表达情况 抑制组、对照组、过表达组的lncRNA-SNHG5、cyclin D1 mRNA及蛋白相对表达水平均依次升高、miRNA-155相对表达水平依次降低(均P<0.05)。见表3、表4、图1。
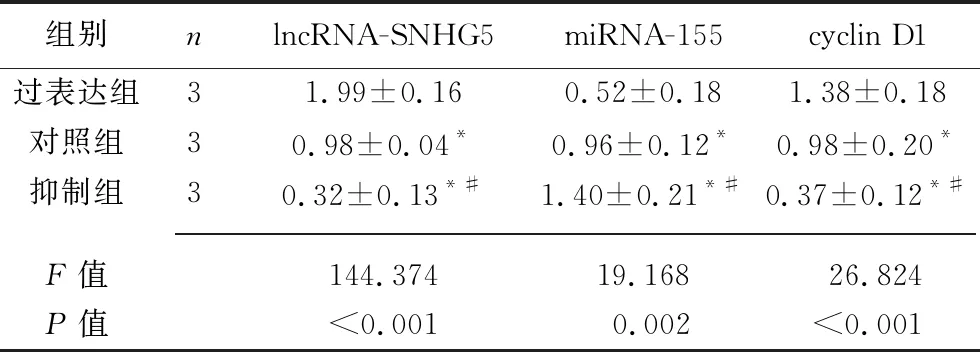
表3 转染后3组细胞SNHG5、miRNA-155、cyclin D1 mRNA相对表达水平的比较(x±s)

表4 转染后3组细胞cyclin D1蛋白相对表达水平的比较(x±s)
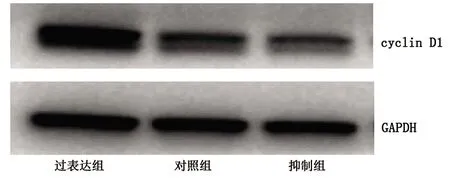
图1 转染后3组HTR-8细胞cyclin D1蛋白电泳图
2.3 各组HTR8细胞增殖能力比较 CCK-8法检测结果显示,在转染后不同时间节点(24 h、48 h、72 h),与对照组相比,过表达组HTR8细胞增殖能力均升高,而抑制组HTR8细胞增殖能力均降低(均P<0.05)。见表5。

表5 3组HTR-8细胞转染后不同时间点的A值比较(x±s)
3 讨 论
子痫前期严重威胁母婴健康,其病因尚未完全明确,螺旋动脉重铸不足,血管内皮细胞损伤、炎症、遗传等因素均与子痫前期相关[8],滋养细胞功能异常导致的螺旋动脉重塑障碍已被认为是子痫前期发病机制的重要过程[9]。目前,已有诸多研究明确了子痫前期妊娠胎盘组织中差异表达的非编码RNA(包括miRNA、lncRNA),这些非编码RNA能够介导滋养细胞功能发生变化,可能参与了子痫前期发病过程[2,10]。lncRNA-SNHG5通过调控肿瘤细胞增殖、侵袭、凋亡等参与疾病过程,与直肠癌、黑色素瘤、乳腺癌等肿瘤密切相关[11]。但目前有关lncRNA-SNHG5与妊娠相关疾病(如子痫前期等)关系的相关研究报告不多,且lncRNA参与疾病的相关具体机制仍需进一步探究。在本研究中我们发现,与正常晚孕胎盘组织相比,lncRNA-SNHG5在sPE患者胎盘组织中呈病理性低表达(P<0.05),提示lncRNA-SNHG5与sPE的发生可能相关。
基因组测序项目表明,人类基因组中有超过90%的基因组被转录为非编码RNA,而lncRNA 与miRNA作为最为重要的两类非编码RNA,除能够通过影响基因表达、表观遗传学等参与调节多种生理过程外,这两者间还能够通过竞争结合、“海绵效应”等方式[12-13],相互关联、影响,共同构成了一个精细、复杂、值得探究的调控网络。在黑色素瘤细胞中lncRNA-SNHG5与miRNA-155之间的负向调控关系已得到验证[5],SNHG5能够通过对miRNA-155发挥ceRNA作用,间接影响相关细胞功能。本研究中,我们更换细胞平台,在人绒毛膜滋养层细胞HTR8中分别转染SNHG5过表达质粒、SNHG5抑制序列后,细胞中lncRNA-SNHG5的过表达与抑制效果显著(P<0.05);并且与对照组比较,过表达组细胞的miRNA-155表达水平降低,而抑制组miRNA-155表达水平升高(P<0.05),提示HTR8细胞中的miRNA-155表达可被lncRNA-SNHG5负性调控,这与Yan等[5]的研究结果具有相似性。
miRNA-155与子痫前期的相关性研究已较为深入,其在子痫前期胎盘组织中病理性高表达,并靶向调控cyclin D1表达从而影响滋养细胞增殖、迁移[6]。因此,我们在明确了lncRNA-SNHG5与sPE的关系,以及其在滋养细胞中可能与miRNA-155具有竞争性结合关系的基础上,通过CCK-8法检测转染lncRNA-SNHG5后HTR8细胞的增殖能力,发现转染后不同时间点过表达lncRNA-SNHG5后HTR8细胞增殖能力升高,而抑制其表达则HTR8细胞增殖能力降低(均P<0.05);进一步检测miRNA-155靶基因cyclin D1的表达,发现lncRNA-SNHG5表达增强后HTR8细胞中cyclin D1在mRNA及蛋白水平上均表达升高(P<0.05)。
cyclin D1能够通过影响周期独立性激酶-4的生物学活性,从而参与细胞周期G1/S的调控,与细胞增殖密切相关[14]。cyclin D1与miRNA-155在3′ 非翻译区端具有互补结合的种子序列,两者间具有负性调控关系;cyclin D1对 HTR8细胞的迁移能力具有促进和保护作用[6]。因此,结合本实验结果,我们推测:与sPE相关的lncRNA-SNHG5过表达后,可能对miRNA-155发挥了ceRNA样作用,内源性竞争性结合、吸附miRNA-155,抑制其表达,继而间接降低了miRNA-155对cyclin D1的负性调控,致使cyclin D1表达增高,解除了miRNA-155对滋养细胞增殖能力的抑制作用,使HTR8细胞增殖力提高。但是lncRNA-SNHG5与miRNA-155在滋养细胞中竞争性结合的靶点,以及在HTR8细胞中具体的结合部位、相关机制,均是我们后续应该完善和探究的问题。
综上所述, lncRNA-SNHG5可能与sPE的发生有关,其可能通过调控miRNA-155/cyclin D1途径,影响滋养细胞增殖能力。而新近研究表明,lncRNA已经具有了作为子痫前期早期诊断与治疗靶点的潜在可能[15],因此,本研究结果或可为后续探究子痫前期的病因机制,丰富子痫前期疾病诊治手段提供了新的思路和基础。

