Stanford A型主动脉夹层患者主动脉壁中簇集素的表达水平及其临床意义▲
霍 博 蒋丁胜 魏 翔 刘立刚
(华中科技大学同济医学院附属同济医院心脏大血管外科,湖北省武汉市 430000,电子邮箱:huobo1992@foxmail)
主动脉夹层是指主动脉内膜破裂后,主动脉腔内的血液从破口进入主动脉中膜,并沿主动脉长轴方向扩展,导致血管壁分层形成“双腔主动脉”。主动脉夹层是一类发病急、病情复杂多变、进展迅速、预后差、误诊率及病死率高的心血管疾病,许多患者的主动脉夹层随着病情进展逐步扩张最终导致血管破裂[1]。因其发病机制复杂,除外科手术和介入治疗外,目前主动脉夹层并无有效的保守治疗方案,因此进一步深入研究主动脉夹层的发病机制及防治策略具有重要的理论和临床意义。
簇集素(Clusterin)是由Blaschuk等[2]于1983年在山羊睾丸液中发现的一种分泌糖蛋白。近年来的研究表明,Clusterin蛋白在心血管疾病发生过程中发挥重要作用,在中国人群中血清Clusterin的表达水平与早期冠状动脉疾病发生密切相关[3]。Clusterin蛋白可以与血浆HDL和极高密度脂蛋白相结合[4],广泛分布于人体多种组织,参与体内多种生理功能,如脂类交换和运输、补体作用的调节、细胞凋亡、细胞增殖,与干眼症、阿尔茨海默病、乳腺癌、膀胱癌、前列腺癌等疾病的发生都密切相关[5-7]。目前未见关于Clusterin与主动脉夹层关系的研究报道。因此,本研究通过检测主动脉夹层患者主动脉壁中Clusterin的表达,分析其对主动脉夹层发生的影响,并探讨其作为潜在治疗靶点的可能性。
1 资料与方法
1.1 样本来源 样本来源于2017年至1月至2019年4月间在我院心脏大血管外科进行手术的9例扩张型心肌病或冠心病患者(对照组)和13例Stanford A型主动脉夹层患者(病例组)。对照组主动脉壁组织在心脏移植术中获得,病例组主动脉壁组织在血管置换术中获得,两组的样本均取自升主动脉部分。所有主动脉夹层患者术前均经计算机断层扫描血管造影明确诊断。对照组扩张型心肌病经超声心动图检查有心腔扩大与心脏收缩功能减低,并排除其他特异性病因引起的心脏扩大确诊。冠心病患者经冠状动脉造影检查确诊。两组均排除合并马凡氏综合征、创伤性或医源性主动脉夹层、肿瘤、免疫系统疾病等患者。所有涉及人体组织样本的采集程序均符合世界医学协会赫尔辛基宣言的原则,均获得患者本人或家属的知情同意。本研究经华中科技大学同济医学院附属同济医院医学伦理委员会批准。
1.2 资料收集 收集所有患者的临床资料,包括性别、年龄、吸烟史、饮酒史、既往史等。
1.3 主要仪器与试剂 BX53光学显微镜(日本Olympus公司),CFX Connect荧光定量PCR仪(美国Bio-Rad公司),蛋白电泳及转膜仪(美国Bio-Rad公司),ChemiDocTMXRS+凝胶成像系统(美国Bio-Rad)。伊红染液(批号:G1002)、苏木精染液(批号:G1004)、EVG染色试剂盒(批号:G1042)均购自武汉赛维尔生物科技有限公司;TRIzol Reagent购自美国Life Technologies公司(批号:15596018); Transcriptor First Strand cDNA Synthesis Kit购自美国罗氏公司(批号:4896866001); ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司(批号:Q711-02);放射免疫沉淀(radioimmunoprecipitation assay,RIPA)裂解缓冲液(批号:P0013)、苯甲基磺酰氟(批号:ST505)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳蛋白上样缓冲液(5×)(批号:P0015L)均购自碧云天生物技术有限公司;二喹啉甲酸蛋白质定量试剂盒购自美国Thermo Fisher Scientific公司(批号:23225),聚偏二氟乙烯膜购自美国Millipore公司(批号:IPVH00010),Clusterin一抗购自美国CST公司(批号:34642),碱性磷酸酶标记的山羊抗兔IgG购自美国Jackson ImmunoResearch公司(批号:111-035-003);丙烯酰胺免染制胶试剂盒(批号:1610183)、ECL化学发光底物(批号:170-5061)均购自美国Bio-Rad公司。
1.4 苏木精-伊红染色和EVG弹性纤维染色 术中获得主动脉组织样本后,取部分组织立即置于10%福尔马林中固定。经脱水、固定、石蜡包埋等处理,并将主动脉壁横向切成5 μm厚的石蜡切片,按照标准流程将切片进行苏木精-伊红(hematoxylin-eosin,HE)染色和EVG弹性纤维染色。苏木精染液主要使细胞核内的染色质与胞质内的核酸着紫蓝色,伊红染液主要使细胞质和细胞外基质中的成分着红色;EVG弹性纤维染色显示弹力纤维呈黑色,胶原纤维呈红色。
1.5 Clusterin基因表达检测 取冻存主动脉壁组织约100 mg,采用TRIzol法提取总mRNA后,使用oligo(dT)引物和Transcriptor First Strand cDNA Synthesis Kit反转录为 cDNA,将所得cDNA产物按1 ∶5体积比稀释后作为模板,采用实时定量PCR检测Clusterin基因mRNA的表达水平。Clusterin的上游引物为5′-AGATCTTGTCTGTGGACTGTTC-3′,下游引物为5′-GTATTTCCTGGTCAACCTCTCA-3′;以18 s核糖体为内参基因,上游引物为5′-CTCAACACGGGAAACCTCAC-3′,下游引物为5′-CGCTCCACCAACTAAGAACG-3′。取ChamQ Universal SYBR qPCR Master Mix 5 μL、 上下游引物各0.5 μL、模板cDNA 2 μL和ddH2O 2 μL制备反应体系。反应条件为95℃ 30 s;95℃ 5 s、60℃ 30 s,40个循环。所有反应均设3个复孔,记录PCR仪返回的Ct值,采用2-ΔΔCt法计算病例组主动脉壁组织中Clusterin表达量的倍数。先分别计算两组各样本目的基因的ΔCt,ΔCt1=CtClusterin-Ct18 s;再计算出对照组目的基因ΔCt的均值ΔCt2;分别计算两组各样本相对于ΔCt2的ΔΔCt,ΔΔCt=ΔCt1-ΔCt2;最后利用2-ΔΔCt计算出两组个样本Clusterin的相对表达量。
1.6 Clusterin蛋白表达检测 取冻存主动脉壁组织约100 mg,将组织剪碎后进行研磨。采用RIPA裂解缓冲液提取主动脉壁组织中的总蛋白,使用二喹啉甲酸蛋白质定量试剂盒测定蛋白质浓度,严格按照说明书进行操作。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳技术将24 μg总蛋白转移到聚偏二氟乙烯膜上(恒压80 V,电泳2 h)后,将膜置于5%脱脂牛奶室温封闭1 h后,置于含有相应一抗的抗体稀释液(1 ∶1 000)中4℃孵育过夜;次日用含0.1% Tween 20的Tris-HCl缓冲盐溶液洗膜3次,5 min/次;随后加入相应碱性磷酸酶标记的二抗(1 ∶20 000),室温下孵育1 h;用含0.1% Tween 20的Tris-HCl缓冲盐溶液洗膜3次,5 min/次;加入显影液立即显影,在成像系统中检测蛋白信号。Clusterin有不同剪切体,分子量大小分别为32 000、52 000、53 000,故在蛋白图像上会显示3个条带。按丙烯酰胺免染制胶试剂盒说明书制胶后在250 V电压下电泳30 min,Bio-Rad凝胶成像系统选择蛋白质凝胶免染胶成像模式激活2.5 min后得到样品的总蛋白条带;用Image Lab软件检测每条泳道的所有蛋白条带将总蛋白归一化定量,以Clusterin与总蛋白比值作为目的蛋白相对表达水平[8]。
1.7 免疫组化染色 将未经染色的石蜡切片置于65℃烤箱中1 h,常规二甲苯浸洗切片3次进行脱蜡;梯度酒精水合,双蒸水漂洗,微波炉中进行柠檬酸缓冲液抗原修复,置于3% H2O2中孵育20 min,用磷酸缓冲盐溶液漂洗3次;8%山羊血清室温封闭1 h,滴加Clusterin一抗(1 ∶500)4 ℃孵育过夜,次日用磷酸缓冲盐溶液漂洗3次,二抗(1 ∶500)室温孵育30 min,用磷酸缓冲盐溶液漂洗3次后行二氨基联苯胺显色,在光学显微镜下观察拍照。用Image J图像处理软件测定主动脉壁组织Clusterin的平均光密度值,其表达水平以图像3个阳性区积分光密度的平均值表示。
1.8 主动脉直径测量 在病例组患者的计算机断层扫描血管造影图像中分别测量气管分叉处升主动脉、主动脉弓、降主动脉以及腹腔干处主动脉直径最大值[9]。
1.9 统计学分析 采用SPSS 23.0统计学软件进行数据分析。符合正态分布的计量资料以(x±s)表示,组间比较采用两独立样体t检验或t′检验;非正态分布的计量资料以中位数和四分位数间距[M(Q)]表示,比较采用秩和检验;计数资料以例数或百分比表示,组间比较采用χ2检验或Fisher确切概率法。采用GraphPad Prism 6.0软件进行线性相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者的一般资料的比较 病例组患者的收缩压、合并高血压比例均高于对照组(均P<0.05);两组患者其余各指标比较,差异均无统计学意义(均P>0.05)。见表1。
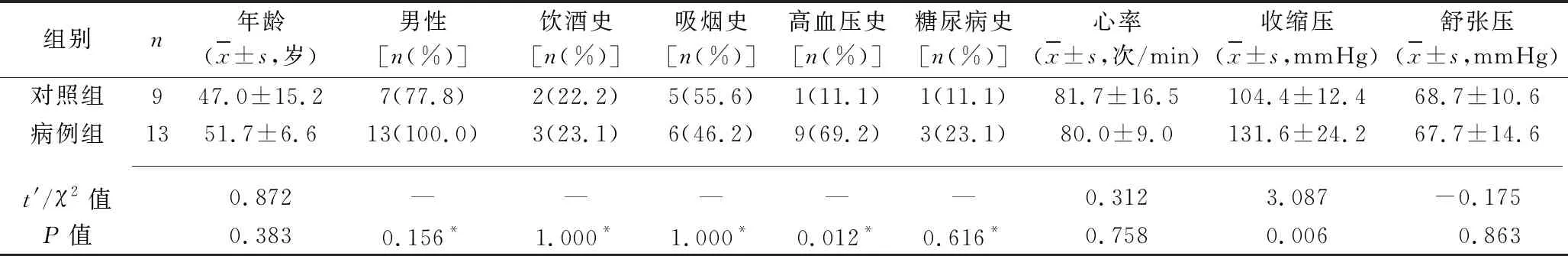
表1 两组患者的一般资料的比较
2.2 HE染色与EVG染色结果 HE染色结果显示,对照组主动脉壁结构完整,平滑肌细胞排列规则;病例组患者主动脉壁中层细胞明显减少,平滑肌细胞排列紊乱。EVG染色结果显示,对照组主动脉壁中弹力纤维完整无明显断裂,而主动脉夹层患者主动脉壁中弹力纤维有所减少且断裂明显。见图1。
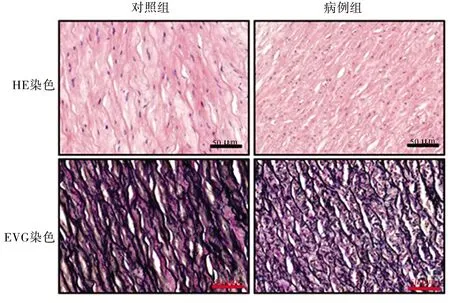
图1 两组主动脉壁组织HE和EVG染色结果(×400)
2.3 两组Clusterin mRNA的表达比较 病例组Clusterin mRNA的相对表达水平为[3.718(11.320)],对照组为[0.053(1.330)];病例组Clusterin mRNA的相对表达水平高于对照组(z=-2.104,P=0.035)。
2.4 两组Clusterin蛋白的表达 病例组32 000、52 000、53 000 Clusterin蛋白的相对表达水平分别为(1.865±0.686)、(0.970±0.282)、(2.429±0.893),对照组32 000、52 000、53 000 Clusterin蛋白的相对表达水平分别为(1.000±0.426)、(1.000±0.145)、(1.000±0.761);病例组32 000、53 000 Clusterin蛋白表达水平均高于对照组(t=3.348,P=0.003;t=3.911,P=0.001),而52 000 Clusterin蛋白表达水平差异无统计学意义(t=0.292,P=0.773)。见图2。

图2 两组主动脉壁组织Clusterin蛋白的表达水平
2.5 免疫组织化学染色结果 结果显示,Clusterin主要表达于细胞质及细胞外基质中。病例组多数细胞的细胞质中可见有明显的棕染颗粒沉着,对照组主动脉壁中仅有少量Clusterin的表达;病例组Clusterin的相对表达水平为(10.391±0.524),高于对照组的(0.737±0.110) (t=64.409,P=0.001)。见图3。

图3 免疫组织化学染色结果(×400)
2.6 病例组Clusterin mRNA表达水平与各主动脉直径的相关性 病例组患者主动脉壁Clusterin mRNA的表达水平与降主动脉、腹腔干处主动脉直径均呈正相关(均P<0.05)。见图4。
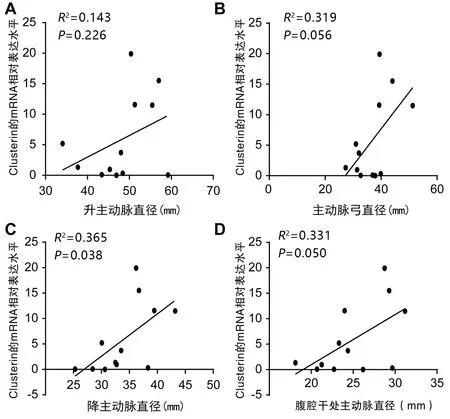
图4 病例组患者主动脉壁Clusterin mRNA表达水平与各主动脉直径的相关性
3 讨 论
Clusterin在人体精液、尿液、乳液等多种体液以及心、脑、肝、肾等多种组织器官中均有表达,且该蛋白质有不同的分型,包括分泌型和核型[10-11]。有研究显示,分泌型Clusterin具有促进细胞生长的作用[12],如在肺动脉高压大鼠模型中,分泌型Clusterin的表达水平显著升高;且分泌型Clusterin能通过调控细胞外调节蛋白激酶1/2信号通路来促进肺动脉平滑肌细胞的增殖、迁移,并抑制其凋亡[13]。在动脉粥样硬化或损伤诱导的血管内膜增生过程中,Clusterin的表达均增加,而敲除Clusterin基因能显著抑制通过敲除载脂蛋白E基因而诱导形成的动脉粥样硬化斑块[14],但通过腺病毒在主动脉中过表达Clusterin可抑制主动脉平滑肌细胞的增殖和迁移,从而抑制球囊损伤诱导的主动脉内膜增生[15]。由此可见,Clusterin在血管性疾病中发挥重要作用,且在血管损伤过程中会代偿性升高。本研究结果显示,在主动脉夹层患者的主动脉壁中,Clusterin mRNA和蛋白的表达水平均显著升高,且Clusterin mRNA的相对表达水平与降主动脉和腹腔干处主动脉直径呈正相关性,提示Clusterin表达升高可能不仅参与主动脉夹层的发生,还与主动脉扩张的进展相关。
目前认为,主动脉夹层的基础病理变化与主动脉中层退行性变有关。主动脉中层退行性变致使主动脉中层弹力纤维断裂、发生中层空泡变性,并出现大量蛋白聚糖和黏多糖等胞外基质成分聚集[16]。此外,主动脉夹层中层退行性变还包括因平滑肌细胞凋亡和过度自噬而导致的平滑肌细胞丢失[17]。分泌型Clusterin是一种细胞保护的分子伴侣,具有抗凋亡的作用,但核型Clusterin的表达上调却是细胞发生凋亡的标志[18]。本研究免疫组化染色结果显示,在主动脉夹层患者主动脉壁中,Clusterin蛋白的表达显著升高,且Clusterin主要定位于细胞质及细胞外基质中,提示在主动脉中主要表达的是分泌型Clusterin。因此,我们认为主动脉夹层患者主动脉壁组织中分泌型Clusterin表达上调很可能是一种代偿性升高,并不能够逆转主动脉夹层患者的细胞损伤。
主动脉夹层发生的分子机制是近年的研究热点。有研究表明,转化生长因子β(transforming growth factor β,TGF-β)信号通路在主动脉夹层的发生和发展中起到重要作用[19],其主要通过调控细胞外基质的动态平衡参与主动脉夹层的病理过程;此外,TGF-β2、转化生长因子β受体(transforming growth factor β receptor,TGFBR)1、TGFBR2、信号传导蛋白Smad3以及Smad4的基因突变均可导致主动脉夹层的发生[20]。TGF-β1能诱导Clusterin蛋白的表达升高[21],而升高的Clusterin可与TGFBR2结合,增加TGF-β诱导的Smad2/3转录活性并增加Smad2/3蛋白表达;此外,Clusterin可通过正反馈调控Smad2/3蛋白的稳定性来调节TGF-β信号通路[22]。炎症是参与主动脉夹层发生发展的重要机制之一,有研究报告,Clusterin能够调控核因子κB的转录活性,参与炎症信号通路的调节[23]。Clusterin参与调节TGF-β信号通路和炎症信号通路,而TGF-β和炎症信号通路与主动脉夹层发生相关,由此推测Clusterin升高对主动脉夹层的发生可能有影响。
此外,有研究报告,高血压是主动脉夹层发生的主要危险因素之一[24],而本研究结果也显示,病例组患者的收缩压、合并高血压比例均高于对照组,与既往文献报道一致。
综上所述,在急性Stanford A型主动脉夹层患者的主动脉壁中Clusterin表达水平升高,且其表达水平与主动脉夹层患者的降主动脉直径、腹腔干处主动脉直径呈正相关。但调控Clusterin表达水平升高的分子机制有待进一步阐明,且Clusterin对主动脉夹层的发生有何影响,以及何种分子机制参与其中,这些问题均有待更深入的研究加以证实。

