早期肠内营养支持对胃癌患者术后恢复的疗效观察
关美云,施 尧,李景倩,陈 梅,侯韦莲
1 解放军联勤保障部队第901 医院 营养科,安徽合肥 230031;2 解放军联勤保障部队第901 医院 卫勤处,安徽合肥 230031 ;3 解放军联勤保障部队第901 医院 外科,安徽合肥 230031 ;4 安徽医科大学附属省立医院 营养科,安徽合肥 230001
胃癌是消化系统常见疾病,位居全球癌症病死率第2 位[1]。由于胃癌患者容易出现消化功能障碍,导致营养物质摄入减少,且术后处于高分解高代谢状态,患者营养不良的发生率较高[2]。营养不良如不及时纠正,可导致免疫力下降,导致术后并发症,影响患者术后的康复。有研究显示,术后早期肠内营养对患者的康复和减少术后并发症有积极作用[3-5]。本研究通过观察肠内营养和肠外营养对术后患者康复的效果,为临床胃癌术后患者选择合理、有效的营养支持途径提供依据。
对象和方法
1 研究对象 选取2018 年10 月- 2019 年10 月在解放军联勤保障部队第901 医院肿瘤内科确诊住院的180 例胃癌患者作为研究对象,患者均为胃大部切除或全胃切除。其中男101 例,女79 例,年龄38 ~ 70(59±10.5) 岁。纳入标准:1) 首次确诊为胃恶性肿瘤;2) 无其他内分泌、消化系统疾病史;3) 无明显代谢性疾病及肝肾功能障碍。
2 研究方法 采用随机抽样方法将180 例胃癌患者分为肠外营养组(PN 组)90 例和肠内营养组(EN组)90 例。肠外营养组术后第1 天通过中心静脉输注三大营养素和微量元素,包括氨基酸、葡萄糖、脂肪乳等,治疗7 d。肠内营养组术中插入鼻胃管或鼻肠管,术后第1 天给予肠外营养;术后6 ~ 8 h通过鼻胃管或鼻肠管给予温生理盐水200 ml,滴速25 ~ 30 ml/h,观察患者胃肠道耐受情况及管道有无堵塞情况。术后24 h 开始给予肠内营养混悬液5 00 ml,开始滴速控制在30 ~ 60 ml/h,第2 天逐渐增加至1 000 ml,第3 天给予1 500 ml,营养液滴速、温度和浓度根据患者耐受情况逐渐调整,治疗7 d,肠内营养组与肠外营养组能量保持相同。
3 观察指标 1) 营养状况指标:术前第1 天体质量,总蛋白和白蛋白的数值;术后第7 天体质量,总蛋白和白蛋白数值。2) 免疫功能指标:术前1 d和术后7 d 免疫球蛋白A(IgA) 值,免疫球蛋白G(IgG) 值,免疫球蛋白M(IgM) 值。3) 术后恢复指标:首次肛门排气时间,首次肛门排便时间,住院时间。4) 并发症发生情况:术后密切观察患者发生感染、腹胀、腹泻、呕吐情况。
4 统计学方法 使用SPSS23.0 进行研究资料分析。观测资料中的计量数据,均通过正态性检验,以-x±s描述。两组间的比较为成组t检验或校正t检验( 统计量为t)。同组内前后比较为配对t检验( 统计量为t)。计数资料以例数及率描述。两组间比较为χ2检验或校正χ2检验( 统计量为χ2)。统计推断的检验水准α=0.05。
结 果
1 两组基线资料比较 180 例患者中,肠内营养组90 例,肠外营养组90 例,两组年龄、性别、胃癌分期等一般资料差异均无统计学意义(P>0.05)。见表1。
2 两组营养指标比较 两组术后7 d 体质量、总蛋白、白蛋白水平与术前1 d 相比均有所下降。两组术前1 d 体质量、总蛋白、白蛋白差异无统计学意义(P>0.05)。肠内营养组术后7 d 体质量、总蛋白、白蛋白水平均高于肠外营养组,差异有统计学意义(P<0.05)。见表2。

表2 两组营养指标比较Tab. 2 Comparison of nutritional indexes between the two groups
3 两组免疫功能指标 两组术后7 d IgA、IgG、IgM 水平与术前1 d 相比均有所下降。两组术前1 d IgA、IgG、IgM 差异无统计学意义(P>0.05)。肠内营养组术后7 d IgA高于肠外营养组(P<0.05),差异有统计学意义;IgG、IgM 与肠外营养组相比,差异无统计学意义(P>0.05)。具体的组间组内比较结果见表3。
4 两组患者胃肠道功能恢复及出院时间比较 肠内营养组首次肛门排气时间、首次肛门排便时间、住院时间均早/ 短于肠外营养组(P<0.05)。见表4。
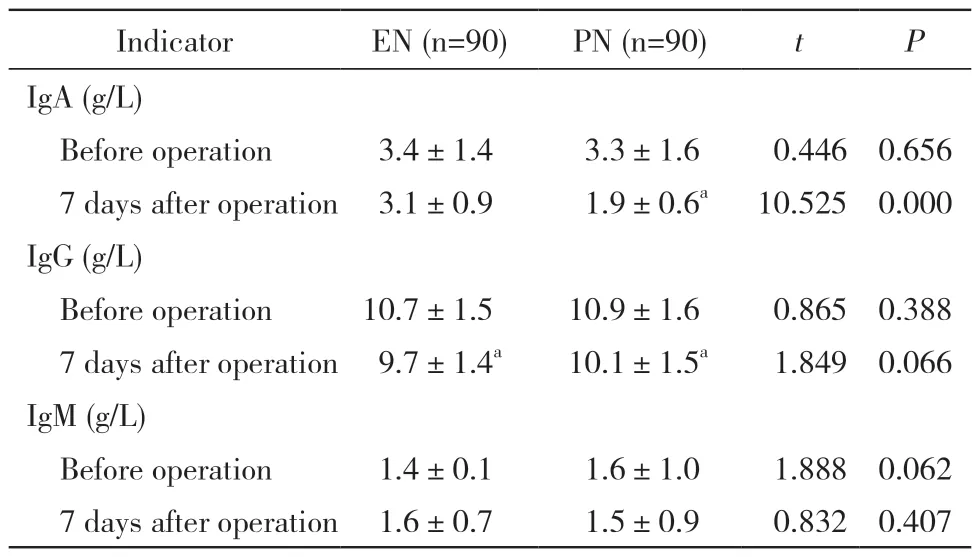
表3 两组免疫功能指标比较Tab.3 Comparison of immune function between the two groups
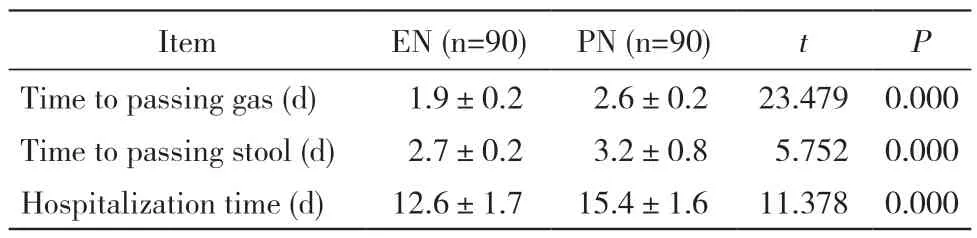
表4 两组胃肠道功能恢复时间及住院时间比较Tab. 4 Comparison of recovery time of gastrointestinal function and hospitalization time between the two groups
5 两组术后并发症发生率比较 肠内营养组术后发生1 例切口感染,2 例出现腹泻,并发症发生率3.3%;肠外营养组发生1 例吻合口瘘,2 例切口感染,1 例腹胀,并发症发生率4.4% ;两组并发症发生率差异无统计学意义( 校正χ2=0.000,P=1.000)。
讨 论
胃癌是我国最常见的消化道恶性肿瘤之一,手术是其首选的治疗方式,但容易导致营养不良,不利于预后[6]。有大量研究显示胃癌患者营养不良发生率普遍较高[7-9],另外,手术对患者的创伤较大,加上术后长时间禁食,加重了患者的营养不良,导致术后并发症增加,住院时间延长,影响患者生理功能的恢复[10]。有研究显示,术后早期进行合理的营养支持能够明显改善患者的营养状况,降低术后并发症发生率[11],因此术后正确合理的营养支持是胃肿瘤患者治疗中的重要一环,对患者生理功能的恢复具有十分积极的意义。
目前患者营养支持的途径主要包括肠内营养和肠外营养。肠外营养指无法经过胃肠道摄取营养或摄取营养物质不能满足自身代谢需要的患者,通过肠道外通路输注包括氨基酸、脂肪、碳水化合物、维生素及矿物质在内的营养素,提供能量,纠正或预防营养营养不良,改善营养状态,并使胃肠道得到充分休息的营养治疗方法。肠内营养是指不能正常进食或进食量不足的病人,经过胃肠道供给只需化学性消化或不需消化的、由中小分子营养素组成的流质营养制剂的治疗方法。肠内营养是临床营养支持治疗的重要手段之一,早期的研究认为胃肠道手术患者不宜过早进行肠内营养[12]。但近些年来的大量研究认为胃肠道手术患者早期进行肠内营养是安全可行的,尽早肠内营养可以维持肠道通透性,保护肠道黏膜屏障,防止细菌移位[13-15]。有研究显示,术后肠麻痹主要局限在胃、结肠,小肠恢复速度最快,通常在数小时内恢复,完全可以耐受营养物质的输入[16-17]。另外,术后早期肠内营养支持符合加速康复外科理念中的术后营养支持策略,术后早期恢复肠内营养是安全的,且对术后恢复至关重要[18]。
肠内营养虽然有很多优越性,但在实施的过程中如果护理不当也会出现很多问题。有研究显示,部分患者在肠内营养过程中会出现腹泻、误吸、堵管、再喂养综合征等并发症[19],这可能是由于肠内营养过程中营养制剂选择不当、护理质量差等。因此,肠内营养制剂的选择、并发症的预防和处理还需医护工作者关注。
本研究显示肠内营养组术后7 d 营养指标和IgA 指标明显优于肠外营养组(P<0.05),这与很多研究一致[20]。这说明早期肠内营养能够明显改善患者的营养状态,提高免疫力,改善患者的预后。本研究中肠内营养组首次肛门排气时间、首次肛门排便时间和住院时间早/ 短于肠外营养组(P<0.05),提示术后早期肠内营养更有利于肠道的蠕动,促进胃肠功能的恢复[21]。总之,早期肠内营养是临床营养治疗的重要手段之一,肠内营养不仅方便、快捷,而且符合人体的生理需求,尽早肠内营养能缩短住院时间,大大降低患者的医疗费用,促进患者康复,提高生存质量。

