VEGF复合透明质酸钠对异体BPTB重建兔前交叉韧带再血管化的影响
陈加荣,沈洪园,李凭跃
前交叉韧带(anterior cruciate ligament,ACL)是膝关节内的稳定结构,对维持膝关节功能极为重要。ACL断裂常导致严重膝关节不稳,或继发膝关节内软骨及半月板损伤,其有效治疗方法是进行ACL重建[1]。目前,同种异体骨-髌腱-骨(bone-patellar tendon-bone,BPTB)是重建ACL的常用肌腱移植物[2],重建术后这些移植物将经历坏死、细胞长入和塑形的过程[3]。移植物再血管化直接影响细胞长入及塑形过程,最终影响移植物生物力学特性的恢复,是决定移植物成活质量的关键因素[4]。
血管生成相关因子在血管化过程中发挥重要作用,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)是已知活性最强、特异性最高的血管生成因子[5],其他血管生成因子大都通过增强VEGF表达来发挥作用。但单纯VEGF在体内扩散快,易被蛋白酶分解而丧失生物学效应。因此,寻找一种能够保证VEGF缓慢释放并发挥作用的无免疫原性载体系统,能更好地促进血管和细胞长入,提高移植物的成活质量。
作为一种药物缓释剂,透明质酸钠(sodium hyaluronate,SH)可延缓药物的释放速度,对一些生物大分子药物还可能具有生物黏附作用[6]。本研究探讨VEGF复合SH对同种异体BPTB重建兔ACL术后再血管化的影响,为提高ACL重建术后移植物愈合质量提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
重组人VEGF(PeproTech公司,美国);小鼠抗人CD31单克隆抗体(Neomaker公司,美国);SH(Sigma公司,美国);FITC标记山羊抗鼠IgG(北京中杉金桥公司);4,6-联脒-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)穿细胞膜蓝色荧光染料C1002(上海碧云天生物技术研究所);PBS液(Gibco公司,美国);速眠新Ⅱ注射液(吉林圣达动物药品有限公司)。Olympus BX51研究级正置显微镜(Olympus公司,美国);Image Pro Plus图像分析系统(Media Cybernetics Inc,美国)。
1.2 实验动物
36只健康成熟新西兰大白兔由南部战区总医院实验动物室提供(动物许可证号:SYXK 2019-0100),平均体重2~3 kg,6~8月龄,雌雄不限。
1.3 实验方法
1.3.1 同种异体BPTB移植物制备 12只成熟新西兰大白兔于取材前30 min以速眠新Ⅱ注射液(0.1 g/kg)肌注麻醉。固定后双后肢脱毛,常规消毒铺巾。取髌前内侧切口,显露髌腱,切断髌骨侧连带部分股四头肌腱,胫骨侧锯断胫骨连同其前部约1.5 cm骨组织,止血后逐层闭合创口。将获取的BPTB进一步修整成股骨段骨长1 cm、宽4 mm,胫骨段骨长1 cm、宽4 mm,髌腱宽4 mm。以Co射线处理后装入无菌瓶中,置于-80℃深低温冰箱保存3个月以上待用。
1.3.2 同种异体BPTB术前处理 术前30 min向装有同种异体BPTB移植物的无菌瓶内,分别注入30 mL VEGF 溶液(30 μg/mL)、30 mL SH溶液(100 μg/mL)、15 mL SH溶液(100 μg/mL)和15 mL VEGF溶液(30 μg/mL)、30 mL PBS溶液。
1.3.3 实验动物分组及同种异体BPTB重建ACL动物模型制作 将24只新西兰大白兔随机分成A、B两组,每组12只,双膝均用于实验。麻醉、肢体固定及消毒方法与前述移植物取材制备步骤相同。取髌前内侧切口,将髌骨向外侧脱位,暴露ACL并剪断。钻头于ACL胫骨止点依次钻出胫骨隧道和股骨隧道。
A组(24膝)随机选择兔一侧膝关节植入前述经VEGF、SH复合处理的BPTB(SH-VEGF组),另一侧植入仅由PBS处理的BPTB(空白对照组);B组(24膝)同法随机选择兔一侧膝关节植入经VEGF处理的BPTB(VEGF组),另一侧植入经SH处理的BPTB(SH组)。
将BPTB由任一端穿过骨隧道后牢固缝合于骨隧道口周围筋膜组织上,悬吊式固定,彻底止血后逐层闭合创口。术后所有术肢均不予固定,自由活动,予青霉素10万U/kg,2次/d,连续注射3 d。分笼饲养,标准饲料,自由饮水。术后2、4、8周A、B两组分别安乐处死4只新西兰大白兔。
1.4 观察及评估指标
术后2、4、8周处死动物后对其双膝关节进行解剖,观察移植物表面及腱骨表面血管化情况。
对移植物进行苏木精-伊红染色及血管内皮特异性标记抗体CD31免疫组化染色,观察血管内皮细胞数量及分布;100倍光镜下观察免疫组化切片中移植物新生血管分布的大致规律,400倍光镜下随机选取50个视野进行图像分析,运用Image Pro Plus图像分析系统测算平均灰度值。
1.5 统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,手术前后比较采用重复测量的方差分析,各组之间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 解剖学大体观察
不同时相点关节内BPTB移植物均为白色致密纤维束状结构(图1A)。术后2周,SH组、空白对照组移植物表面未见明显滑膜包裹;VEGF组、SH-VEGF组可见移植物胫骨端、股骨端有少量滑膜包裹(图1B),隧道内移植物与骨道壁之间以疤痕组织相连。
术后4周,SH组、空白对照组移植物表面有少量血管及滑膜包裹,以胫骨端与股骨端为主;VEGF组两端及体部均有部分滑膜包裹,隧道内口及隧道内疤痕组织密集,移植物被疤痕组织包绕,难以分离,移植物与骨隧道之间仍有缝隙;SH-VEGF组移植物骨端可见大量血管及滑膜包裹,体部有部分滑膜包裹,骨隧道内口连接紧密,隧道内可见沿骨隧道排列的软骨样组织,移植物与骨隧道之间无缝隙,形成稳定的组织连接(图1C)。
术后8周,SH组、空白对照组两骨端有大量滑膜包裹,隧道内口见少量疤痕组织,部分隧道内口呈椭圆形,移植物与隧道壁之间充满疤痕组织;VEGF组、SH-VEGF组两骨端滑膜较4周前减少,移植物与骨隧道间填充大量软骨样组织,连接紧密(图1D)。
2.2 组织学观察
2.2.1 苏木精-伊红染色 术后2周,各组BPTB移植物表面已覆盖部分血管内皮细胞,但SH组、空白对照组细胞量较少,移植物深部未见明显血管形成;术后4周,血管内皮细胞由移植物表面逐渐进入深部(图2A),进入深部的细胞数量SH组和空白对照组远少于VEGF组和SH-VEGF组;术后8周,4组细胞均到达移植物深部,且初步形成管腔样结构(图2B)。
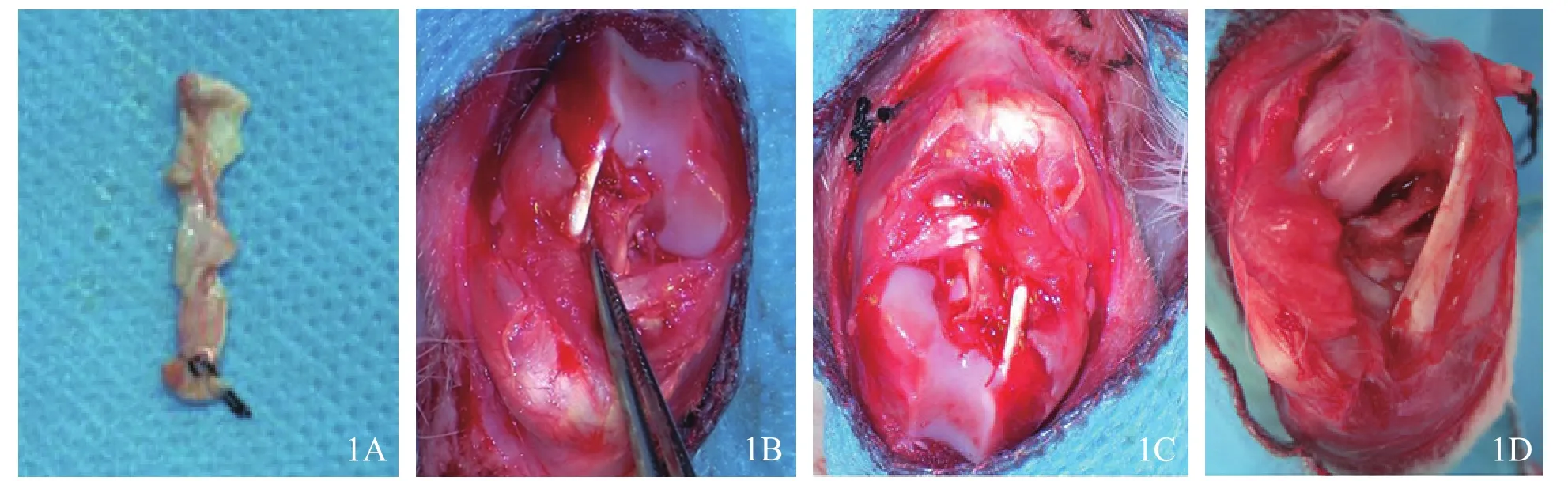
图1 SH-VEGF组移植物大体解剖观察 1A完整取出,为白色致密纤维束状结构 1B术后2周 1C术后4周 1D术后8周
2.2.2 免疫组化染色 术后2周,SH组、空白对照组移植物CD31免疫组化染色可见极少量棕色颗粒;VEGF组移植物胫骨端与股骨端有较多散在棕色颗粒着色,未见血管腔形成;SH-VEGF组可见少量血管腔形成。术后4周,SH组、空白对照组移植物有少量棕色颗粒着色,在胫骨端与股骨端可见少量血管腔形成,SH-VEGF组移植物阳性着色由两端向体部逐步长入(图2C)。术后8周,空白对照组移植物胫骨端、股骨端有较多棕色颗粒着色,可见血管腔形成,体部边缘有少量散在棕色颗粒,向深部逐步减少;SH-VEGF组可见移植物胫骨端、股骨端血管较4周前减少,体部深部可见较多散在棕色染色,并有血管腔形成(图2D)。
2.2.3 CD31染色灰度值 如表1所示,术后2、4及8周SH-VEGF组、VEGF组、SH组及空白对照组之间灰度值比较,差异均有统计学意义(P<0.05);术后2、4、8周SH-VEGF组CD31阳性细胞多于其他3组,VEGF组高于SH组及空白对照组(P<0.05),而术后不同时相点SH组与空白对照组比较无统计学差异(P>0.05)。
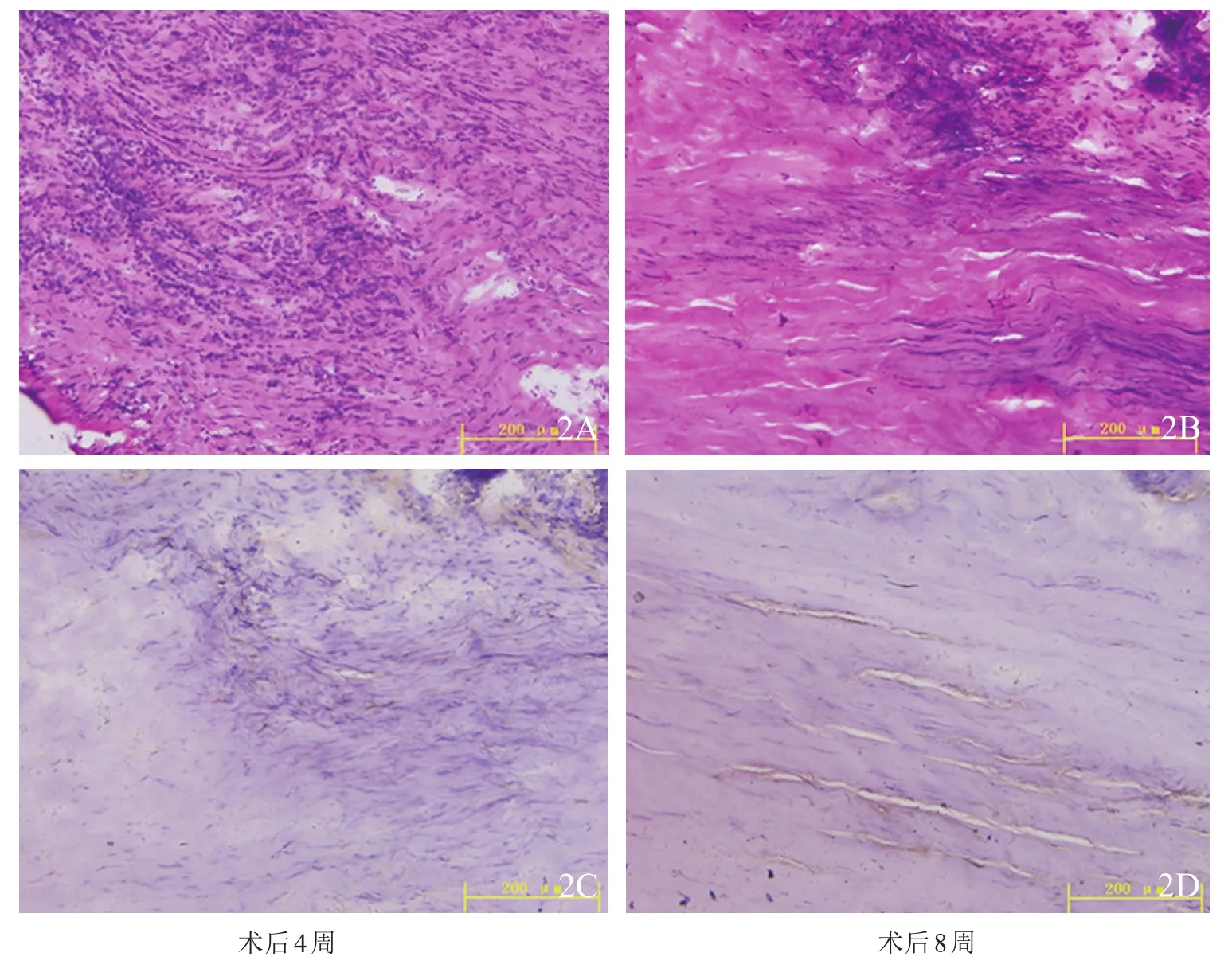
图2 SH-VEGF组移植物组织学观察(×400)2A,2B 苏木精-伊红染色 2C,2D CD31免疫组化染色
表1 同种异体BPTB重建兔ACL术后移植物CD31染色灰度值(±s,n=4)
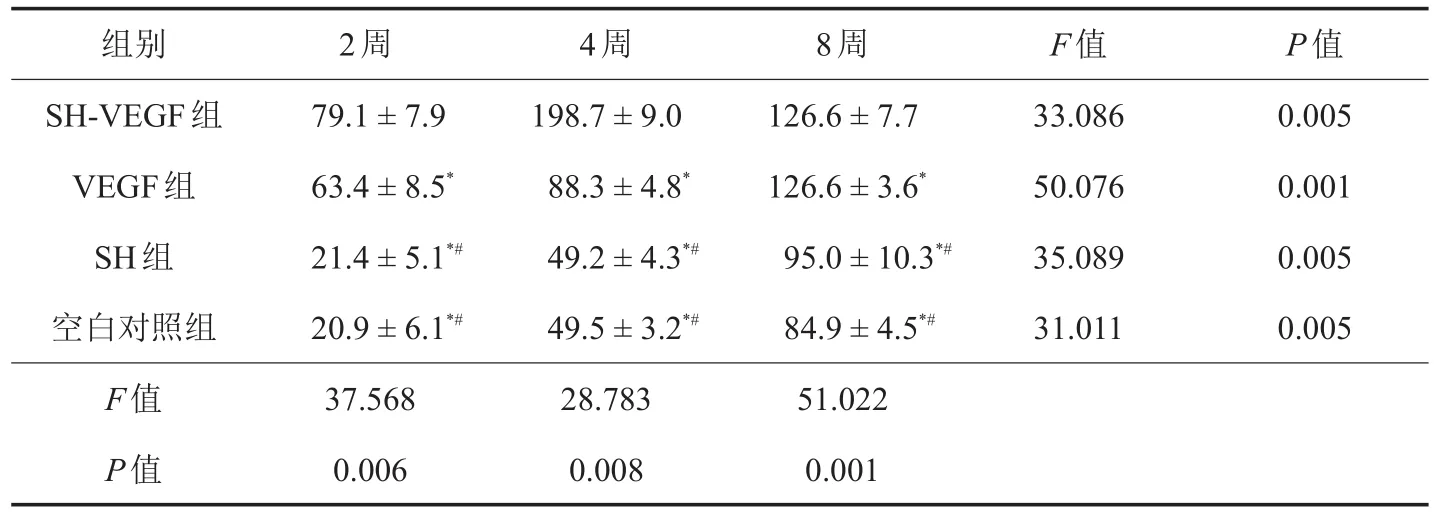
表1 同种异体BPTB重建兔ACL术后移植物CD31染色灰度值(±s,n=4)
注:BPTB:骨-髌腱-骨;ACL:前交叉韧带;SH:透明质酸钠;VEGF:血管内皮生长因子;*与SH-VEGF组相比,P <0.05;#与VEGF组相比,P <0.05;
组别SH-VEGF组VEGF组SH组空白对照组F值P值2周79.1±7.9 63.4±8.5*21.4±5.1*#20.9±6.1*#37.568 0.006 4周198.7±9.0 88.3±4.8*49.2±4.3*#49.5±3.2*#28.783 0.008 8周126.6±7.7 126.6±3.6*95.0±10.3*#84.9±4.5*#51.022 0.001 F值33.086 50.076 35.089 31.011 P值0.005 0.001 0.005 0.005
术后4周各组灰度值均高于术后2周,术后8周SH-VEGF组灰度值较4周有所下降,而其他3组术后8周灰度值均较术后4周时有所上升(P<0.01)。
如图3所示,VEGF组、SH组及空白对照组在术后随时间推移,平均灰度值逐渐增加;SH组与空白对照组无明显差异;SH-VEGF组先增后减,峰值出现在术后4周。
3 讨论
3.1 同种异体BPTB的处理
同种异体韧带和肌腱组织的抗原性主要来自于纤维细胞上的主要组织相容性抗原。异体韧带经深低温冷冻处理后其主要组织相容性复合体(major histocompatibility complex,MHC)遭到破坏,移植物抗原性有所降低[7]。Arnoczky等[8]对新鲜及低温冰冻处理后BPTB进行对比研究,发现前者排斥反应明显,后者排斥反应不明显。张培等[9]运用深低温冷冻异体ACL进行移植,术后未检测到任何免疫排斥反应;有学者将手、肩及膝关节等部位的冷冻异体软组织用于移植,未发现明显的排斥反应[10-11];Shino等[12]应用低温冷冻保存的BPTB异体移植重建ACL,也未检测到任何排斥现象。但Pinkowski等[11]对低温冷冻同种异体髌腱移植重建ACL患者进行临床研究,结果发现1例严重排斥反应。本研究所用同种异体BPTB均在-80℃深低温冰箱内储存3个月,目的就是为了彻底破坏细胞成分并降低抗原性,尽量减少排斥反应对再血管化可能造成的影响。

图3 不同时间点移植物CD31染色平均灰度值变化趋势
3.2 生长因子VEGF与韧带愈合
韧带愈合是由许多分子启动、控制、终止的复杂过程,多种生长因子在韧带正常愈合过程中起着重要的调节作用[13-14]。VEGF是1989年Ferrara和Henzel[15]在牛垂体滤泡星形胶质细胞体外培养液中分离纯化出来的一种糖蛋白,其主要生物学功能是促进新生血管形成和增加血管通透性。正常情况下内皮细胞并不表达VEGF,缺氧时可迅速诱导VEGF mRNA的表达。在正常氧状态下,VEGF半衰期是30~45 min,转变为低氧状态后半衰期可延长至6~8 h。
本实验中VEGF在兔体内表现出良好的生物学效应。免疫组化染色观察发现,复合30 μg/mL VEGF溶液组BPTB移植重建ACL后,无论在新血管形成时间、数量,还是血管长入韧带的时间、深度,都优于空白对照组。同时发现,SH-VEGF染色组血管形成高峰期在第4周,第8周已呈下降趋势,原因可能有以下三方面:①一次性外源VEGF的生物学效应消失;②机体自身调节作用;③正常ACL内缺乏血管,新生血管必然退化。而VEGF组则可能由于一次性外源性VEGF过早失效,其血管形成与对照组相似,相对延后。
3.3 SH-VEGF的促移植物血管化作用
作为药物制剂辅料,SH及其钠盐是人体自身固有物质,具有良好的可吸收性、生物相容性和黏膜黏附性,可以抑制药物的扩散、沉降和对流,并黏附在作用部位,缓慢释放药物作用。Matsumoto等[16]在吗啡肠道栓剂中加入3%SH,经兔直肠给药后发现,该栓剂具有缓释作用;Surendrakumar等[17]将10%(w/w)重组人胰岛素加入SH并喷雾干燥成可吸入性微粒,犬吸入后胰岛素平均停留时间和半衰期均较单纯胰岛素干燥微粒长;SH还可通过共价键修饰脂质体,借助吸附、静电作用包裹纳米球,从而延长药效,满足缓释要求。
研究表明,联合使用具有缓释作用的SH,VEGF可能更接近生理浓度,并持续促进血管再生形成[18]。本实验结果提示,VEGF复合SH后对移植物新生血管内皮细胞生长的促进作用明显优于单纯VEGF组,而单纯SH组与空白对照组无明显差异(P>0.05),说明在VEGF中加入SH能促进移植物的血管化,而这种促再血管化作用并不是单纯由SH引起的,其与VEGF之间可能存在协同作用。课题组下一步将对SH与VEGF之间的具体结合方式及作用机制进行深入研究。

