黑斑侧褶蛙蝌蚪皮肤抗菌肽最早表达时间的确定
Martina OPALIN 王 情 马 跃 王碧霄 郭 策 徐艳春,3*
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.国家林业和草原局野生动植物检测中心,哈尔滨,150040;3.国家林业和草原局野生动物保护与利用工程技术研究中心,哈尔滨,150040)
两栖类动物是由水生向陆生过渡的脊椎动物类群,皮肤通透性高,仅有1—2层轻微角质化的细胞[1],有利于呼吸、排泄、调节水分、离子运输等,但缺少机械屏障,容易受到环境中病原微生物的侵袭。作为对策,两栖类在皮肤表面形成了一种强大的化学屏障,包括黏蛋白为主的黏液层,还有溶解于黏液层的抗菌肽(antimicrobial peptide,AMP)等物质,共同构成了体表的先天性免疫系统,抵抗多种微生物的入侵[2]。
抗菌肽是一类具有生物活性的小分子,一般由12—100个氨基酸组成,分子量在4 KD左右,通常带正电,净电荷为+2—+9;具有两亲性[3-4]。抗菌肽的序列具有高度的多样性,1只蛙的皮肤可能有10—20种在大小、序列、电荷、疏水性、构象、抗菌谱等都不同的肽类;5 000多个现存的无尾目(Anura)蛙类物种可以产生大约100 000种不同的抗菌肽[5]。如此多样的抗菌肽是由庞大的基因家族来编码的,在一定环境条件刺激下有选择性地表达。当环境微生物较多时,两栖类会增加抗菌肽的表达量,在无菌的环境中则不产生抗菌肽;而且在不同的微生物群落的刺激下会产生不同的表达谱[6-8]。
两栖类动物的生活史中,受精卵在水中发育,蝌蚪经过变态后登陆。两栖类的受精卵外被一层透明胶体,可以阻止微生物侵入[9]。蝌蚪孵化以后进入水中,失去了这层卵膜的保护,但是其皮肤分泌黏蛋白构建一层胶体屏障,使其免受水体微生物的挑战[10]。但是,这层屏障随着蝌蚪的发育逐渐变薄,保护作用逐渐减弱。与此同时,皮肤开始分泌抗菌肽来补偿胶体屏障削弱带来的影响[11-12]。但是,蝌蚪最早在哪个发育阶段开始分泌抗菌肽始终缺乏研究。解决这一问题对揭示蝌蚪的生存对策,理解两栖类的免疫进化的机制,研究不同生态背景下蛙类种群波动机制等具有重要意义。
黑斑侧褶蛙(Pelophylaxnigromaculatus)广泛分布于亚洲大陆东部,栖息于草原、森林、丛林和沙漠中的河流、湖泊、池塘、沼泽和农田等多种生境[13-14]。不同地理区域因气候、海拔等因素的差异,水体中微生物群落结构也各不相同[15]。本研究以东北地区黑斑侧褶蛙蝌蚪为对象,研究了各个发育时期皮肤组织学变化和抗菌肽表达情况,揭示其最早在T2期就开始表达抗菌肽。
1 材料与方法
1.1 样品的采集与形态测量
在黑龙江省尚志市帽儿山地区的人工池塘中,从5月中旬持续到7月中旬,采集从受精卵到完成变态各个时期的黑斑侧褶蛙蝌蚪和幼蛙。采集时,用纱网小心捞取受精卵或蝌蚪,根据形态进行物种鉴定[16],把其他物种的蝌蚪放回池塘。把黑斑侧褶蛙蝌蚪放在烧杯中,用鱼安定(MS-222)过量麻醉致死。根据Gosner的标准鉴别发育时期[17]。因为Gosner分期非常细,分期标准主要依据器官、结构的出现与否,而相邻时期的皮肤变化不够明显。而且受到环境温度波动的影响,每个时期难以采集到多个标本。故此把各个时期归纳到5个较宽泛时期:E期(embryo stage,对应Gosner’s stage 1—19)、H期(hatchling,对应Gosner’s stage 20—22)、T1期(对应Gosner’s stage 23—25)、T2期(对应Gosner’s stage 26)、T3期(变态前期,对应Gosner’s stage 27—41)、T4 期(变态期,对应Gosner’s stage 42—45)和J期(幼蛙期,对应Gosner’s stage 46)。把蝌蚪放置在带有刻度的塑料板上测量体长,精确到0.1 mm。E期、H期、T1期的各5只样本直接置于液氮中保存,3只样本置于10%的福尔马林缓冲液中固定。将T2期及以后的各个时期的消化道(胃+肠道)小心剥离出来,用柔软的细线按照其走向比齐,再置于刻度尺上测定长度,精确到0.1 mm。再把各时期的皮肤小心分离下来。操作完成后,把皮肤和消化道样本立即放入液氮中保存。
1.2 抗菌肽的检测
把蝌蚪、皮肤、肠道等材料从液氮中取出,分别置于0.1%的DEPC溶液处理过的研钵中,用RNase Free水迅速清洗,用滤纸吸干水分,在研钵内倒入液氮,把样品研磨成粉末。将粉末收集于1.5 mL的离心管内,用Trizol法提取总RNA。总RNA用NanoPhotometer(Implen,Germany)测定浓度,并在2%琼脂糖凝胶电泳检测完整性。
用RNA PCR Kit(AMV).Ver.3.0(TaKaRa,大连),分别以10条根据无尾两栖类抗菌肽信号肽区域设计的简并引物PS1—PS10为上游引物,以通用引物PC为下游引物(表1)进行抗菌肽cDNA的反转录合成和PCR检测,反转录反应体系和程序参照试剂盒的说明书。

表1 黑斑侧褶蛙抗菌肽cDNA克隆的引物序列[18]
抗菌肽cDNA的扩增采用50.0 μL体系,包含1×PCR buffer(Mg2+plus)、1U TaKaRa ExTaqHS、10 pmol上游引物PS1—PS10之一和5 pmol下游引物PC、10 μL反转录所得的cDNA。反应程序为:94°C/2 min;(94°C/30 s,Ta/30 s,72°C/1 min)35 cycles;72°C/10 min;10°C/∞。取5 μL PCR产物在1.8%的琼脂糖凝胶上电泳检测。在紫外灯下用无菌手术刀将目的片段切下,放入1.5 mL Eppendorf管中,用AxyPrep DNA凝胶回收试剂盒(爱思进生物技术,杭州有限公司)进行纯化回收。将每个时期所有的PCR产物混合后,再用pMD18-T Vector试剂盒(TaKaRa,大连)进行克隆。菌斑经过LB液体培养基扩繁后,取菌液1 μL,用10 μL上述体系进行PCR鉴定。每个时期取5个阳性克隆进行测序。测序采用Sanger法,用BigDye®Terminator v3.1 试剂盒在ABI 3100 Genetic Analyzer(Applied Biosystems,USA)上完成。用Lasergene中的EditSeq将测得的cDNA序列进行整理,在NCBI 数据库(http://www.ncbi.nlm.nih.gov/)中进行BLAST比对,根据序列的同源性判定是否为抗菌肽,并判定其所属基因家族。
1.3 皮肤的组织学观察
参照欧志杰等[19]的方法,把蝌蚪的皮肤样本制备石蜡切片,并进行AB-PAS染色[20]。组织切片在CX40生物显微镜(Olympus,日本)下观察,用ToupView显微成像系统(上海光学仪器厂)拍照记录和图像处理。
2 结果
2.1 蝌蚪不同发育时期的鉴定
比照Gosner的鉴别标准,把蝌蚪归纳为5个发育时期:受精卵及胚胎期(E期)、孵化期(H期)、T1期、T2期、变态前期(T3期)、变态期(T4期)和幼蛙期(J期)。各个时期的特点如图1和表2。

图1 黑斑侧褶蛙各个发育时期的外观特征Fig.1 Visual representation of different development stages of Pelophylax nigromaculatus 注:A.E期的受精卵团;B.H期刚孵化的蝌蚪;C.T1期腹面观;D.T1期背面观;E.T2期体型较大尚未出现后肢的蝌蚪;F、G.T3期变态前期的蝌蚪,身体背面可见成体蛙特有的斑点和条纹以及腺体;H.T4期正处于变态中的蝌蚪;I.J期完成变态的幼蛙 Note:A,spawn at stage E.B,hatchlings at stage H.C,lateral view of larvae at stage T1.D,dorsal view of larvae at stage T1.E,larvae at stage T2.F,G,pre-metamorphic larvae at stage T3,showing the specie-specific dorsal line and glands.H,metamorphic larvae at stage T4.I,juvenile frog at stage J

表2 黑斑侧褶蛙各个发育时期的特征
2.2 蝌蚪不同发育时期皮肤组织结构的变化
胚胎期(E期)能够观察到蝌蚪胚胎在卵囊中跳动,其皮肤仅有1—2层细胞构成,细胞层下面为基底层,显微镜下常不清晰。致密层(真皮)极薄,层位于表皮基底层之下。表皮表层分布大量巨型细胞,包括胞核位于边缘,胞质透明的黏液细胞和顶端有大量微小色素颗粒的分泌细胞(图2-A)。刚刚孵化进入水中的蝌蚪(H期),皮肤结构与E期相似,表皮有1—2层细胞,真皮层极薄。在表皮表面散在分布大量的微小色素颗粒(图2-B)。

图2 黑斑侧褶蛙各个时期皮肤的组织学变化Fig.2 Histological changes of skin at different development stages of Pelophylax nigromaculatus 注:A.胚胎期(×250);B.孵化期(×250);C.T1期(×250);D.T2期(×250);E.T3期(×500);F.T4期及幼蛙期(×500);GC.巨型细胞;EL.表皮层;CL.致密层;SL.疏松层;EFP.表皮微小色素颗粒;EMP.表皮载黑素细胞;DMP.真皮载黑素细胞;MC.黏液细胞;GG.颗粒腺;MG.黏液腺 Note:A,embryo stage(×250).B,hatchling stage(×250).C,T1 stage(×250).D,T2 stage(×250).E,T3 stage(×500).F,T4 stage and juvenile frog (×500).GC,giant cells.EL,epidermal layer.CL,compact layer.SL,spongy layer.EFP,epidermal fine pigments.EMP,epidermal melanophores.DMP,dermal melanophores.MC,mucus cell.GG,granular gland.MG,mucous gland
进入T1期后,表皮细胞排列更为规则,散在的微小色素颗粒有所减少(图2-C)。T2期表皮细胞增加到3—5层,散在的色素颗粒进一步减少。表皮和真皮中开始出现载黑素细胞,胞质中色素大量聚集,呈团块状。同时疏松层开始发育,并偶见较小的颗粒腺和黏液腺,致密层也显著加厚(图2-D)。T3期表皮细胞排列更加规则,细胞层数稳定在3—5层,色素颗粒形态和分布与T2相同。疏松层显著加厚,载黑素细胞主要出现在表皮与疏松层的界面附近。疏松层内可见较多的黏液腺和颗粒腺,但体积较小。致密层显著加厚,可见数量较多的成纤维细胞和胶原纤维束(图2-E)。蝌蚪进入变态期(T4期)和幼蛙期(J期),皮肤已经具备了成年蛙的结构特点,表皮由多层细胞构成,载黑素细胞出现在表皮、表皮与疏松层的界面处,以及疏松层内,可见到大量的色素团块。颗粒腺和黏液腺更加发达,黏液腺稍小,靠近表皮层,颗粒腺较大,占据疏松层的主要空间。致密层显著加厚,胶原纤维束更为粗大(图2-F)。
2.3 蝌蚪不同发育时期体长及消化道的变化
蝌蚪不同发育时期体长的变化趋势如图3,H期体长为0.4—0.7 cm,平均为(0.56±0.12)cm;T1期为0.8—1.8 cm,平均为(1.28±0.34)cm;T2期为3.5—6.1 cm,平均为(4.86±0.75)cm;T3期进一步增大,达到4.2—6.8 cm,平均为(5.48±0.71)cm;到T4期时,体长随着尾部的吸收而缩短,处于3.7—6.2 cm,平均(5.38±0.91)cm;至变态完成之后的幼蛙期(J期),体长为3.5—5.2 cm,平均(4.19±0.64)cm。整个蝌蚪期的体长变化近似“S”形曲线。

图3 黑斑侧褶蛙不同发育时期体长和消化道的变化趋势Fig.3 The dynamics of body length and digestive tract length at different developmental stages of Pelophylax nigromaculatus
消化道在T1期的长度为2.7—4.2 cm,平均(3.35±0.51)cm。在T2期迅速延长到15.0—19.7 cm,平均达到(17.54±1.39)cm。到T3期较T2期稍有加长,保持在15.4—20.2 cm的水平,平均为(18.48±1.27)cm。至T4期时,消化道长度又缩短到12.7—16.1 cm,平均(13.78±1.34)cm。完成变态进入幼蛙期,消化道长度进一步缩短到5.9—6.4 cm,平均为(6.15±0.24)cm。
消化道相对体长的比例在T1期为2.63,T2期增加到3.61,T3期略有回落,为3.37,T4期回落到接近T1期的水平2.56,J期进一步降低到1.47。
2.4 蝌蚪不同发育时期抗菌肽的检测
蝌蚪不同发育时期的样本均成功提取了总RNA,电泳检测显示18S和28S两个清晰条带,表明RNA比较完整。E期、H期和T1期因为样品太小,未能分离皮肤、消化道等器官,而是整体提取总RNA。T2期至J期的样品均将皮肤、消化道分离开,分别提取了总RNA。
采用引物PS1-PS10进行TR-PCR反应检测抗菌肽的表达情况。结果显示,10对引物在E期、H期和T1期的总RNA中均未获得阳性扩增产物,表明这3个时期没有抗菌肽表达。从T2期开始,一些引物在皮肤、肠道和整体样本上均得到PCR产物,经测序确定为抗菌肽(表3)。
经过在GenBank中搜索比对,根据同源性和AMP序列特征最终确定T2期检测到的抗菌肽包括temporin-1N、esculentin-1N和nigrocin-7N等3个家族。T3期皮肤和肠道均检测到抗菌肽nigrocin-4N家族。到T4期皮肤检测到nigrocin-6N、esculentin-2N、nigrocin-4N等3个家族;肠道检测到的抗菌肽有nigrocin-6N、nigrocin-3N。幼蛙期皮肤中检测到的家族较多,包括nigrocin-5N、esculentin-1P、temporin-1N、esculentin-1N、nigrocin-7N等家族,肠道中的抗菌肽家族与皮肤相同。
3 讨论
两栖类皮肤非特异性免疫包括物理屏障、细胞屏障、化学屏障和微生物屏障。物理屏障主要是表皮层轻微角化的细胞和真皮的胶原纤维层;细胞屏障主要是皮肤中的树突状细胞、朗格罕氏细胞、淋巴细胞等各类免疫细胞;化学屏障主要是抗菌肽和黏液层;微生物屏障主要是皮肤上附着的微生物群落[21]。两栖类生活史早期是在水体中完成的,而变态之后也不离开湿润环境。这样的生活环境中,微生物极为丰富,其中不乏能够侵袭机体的致病微生物[22-23]。发育过程中,这些免疫屏障是如何建立和成熟的,如何有效保护机体免受攻击等,都是与蝌蚪的生存密切相关。
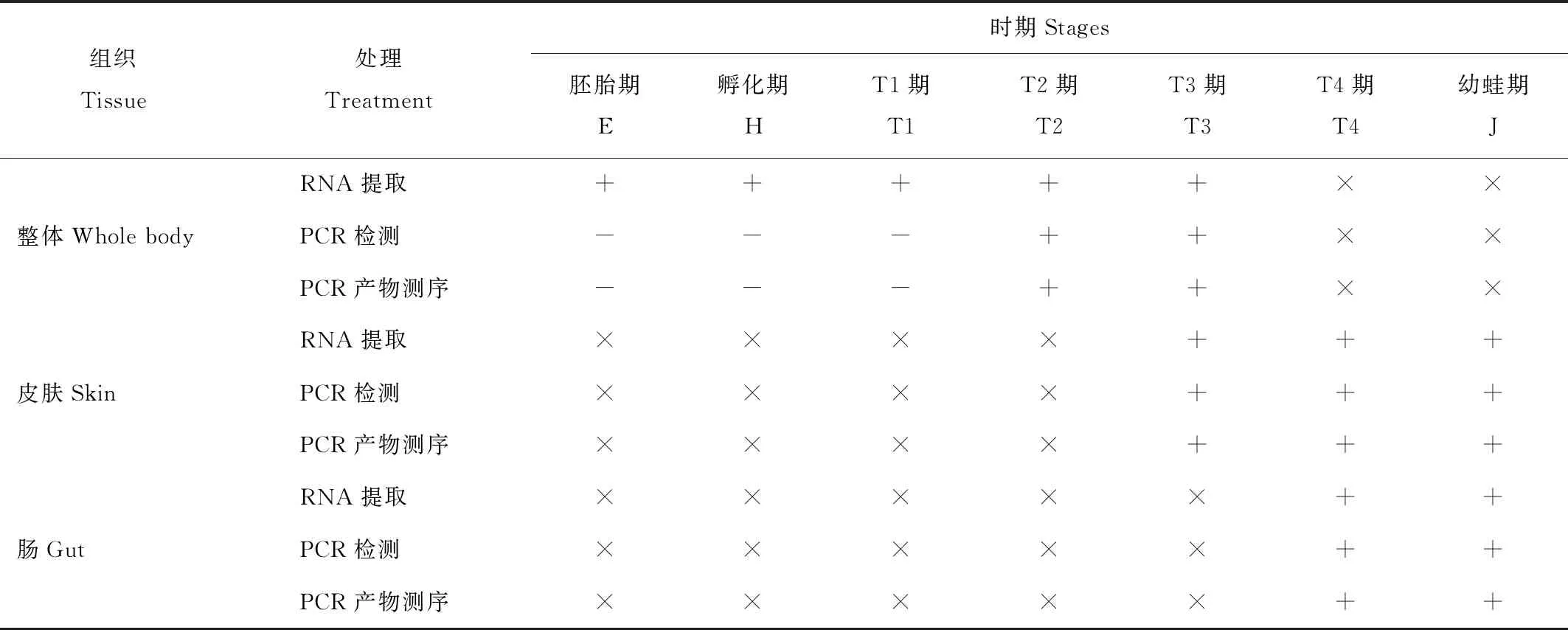
表3 黑斑侧褶蛙各个时期总RNA提取和扩增得到抗菌肽的总体结果(+阳性,-阴性,×未采样)
研究显示,受精卵和胚胎受到卵膜的保护。卵膜是透明胶体,可以阻止微生物侵入[9]。蝌蚪孵化以后进入水中,非特异性免疫主要依靠皮肤分泌的黏蛋白胶体屏障[10]。蝌蚪的发育是为陆地生活做准备,而陆地环境中难以维持较厚且含水量高的黏液层,因而,这个黏液层随着发育的进程不断变薄,这无疑会削弱免疫屏障。成体蛙依靠抗菌肽这一化学屏障来抵抗微生物的侵袭[24]。然而,物理屏障何时向化学屏障过渡,对于两栖类来说非常关键的。生态因子的作用下,蝌蚪发育受阻或加速,如果其皮肤发育水平不能及时完成这一过渡,就会面临着更高免疫风险[25]。
本研究发现,黑斑侧褶蛙胚胎期(E期)和孵化进入水体时(H期),皮肤真皮层极薄,表皮仅有1—3层细胞。表皮层中有大量的分泌黏液的巨型细胞,来维持体表黏液层。直到T2期时,真皮和表皮下面的疏松层才显著加厚,并出现较小的颗粒腺和黏液腺(图2),预示着T2期(对应于Gosner 26期)是抗菌肽最早表达的时期。抗菌肽的检测验证了这一点(表3)。我们采用了10条上游引物检测抗菌肽。这10条引物几乎覆盖了已知无尾两栖类各类抗菌肽前体信号肽的保守区域[18],理论上讲,组织中只要有抗菌肽的转录就能够检测出来。抗菌肽检测在E期、H期和T1期都是阴性,而到T2期才首次得到阳性结果,并持续到幼蛙期。这说明在黑斑侧褶蛙的皮肤最早合成抗菌肽是在T2期。
蝌蚪孵化进入水体后(H期),主要依靠残留的卵黄提供能量,到T1期时才开始在小范围内觅食,到T2期的则可以大范围自由移动,消化道较T1期大幅度延长(图3),以适应采食浮游生物和植物性食物的需要。理论上讲,T1期蝌蚪自主采食的同时,也开始在肠道中建立微生物群落[26]。与此同时,为了防御微生物的侵袭,肠道组织也应该开始转录抗菌肽[27]。然而,我们虽然把T1期的蝌蚪整体提取总RNA,但是并未检测出抗菌肽。组织学观察表明,T1期蝌蚪的皮肤并没有分泌抗菌肽的结构基础(图3),说明这一时期的蝌蚪肠道中也未建立足够的抗菌肽免疫屏障,到T2期才在皮肤和肠道同时建立起抗菌肽免疫。
这一结果暗示,如果蝌蚪在胚胎期和蝌蚪期的发育因温度和污染物等的影响出现加速或延迟发育[28-30],如果其皮肤的发育未能与环境致病微生物群落的变化相匹配,则其皮肤免疫屏障的效能有可能受到影响,进而影响到其生存。但是在气候变化、环境污染等生态背景下,两栖类蝌蚪的先天性免疫会受多大程度的影响,这种影响在种群层面有哪些效应,还需要进一步研究。
我们在黑斑侧褶蛙抗菌肽目前共发现有13个家族106种cDNA序列[31],本研究在每个时期仅测定了少数阳性克隆的序列,而未进行全部测序。因此,各个时期检出的抗菌肽只能说明该时期有抗菌肽转录,所鉴定的抗菌肽家族数量和种类不能代表该时期表达抗菌肽的多样性。关于抗菌肽在各个发育时期的变化动态以及免疫屏障的效能等问题,也有待进一步研究。

