多菌灵降解菌djl-6和啶虫脒降解菌D-2液体菌剂的研发
徐铭阳 卢家森 耿翔 刘卜郡 何健 黄星


摘要:以长期受多菌灵和啶虫脒农药污染的土壤中分离筛选得到的多菌灵降解菌株庆笙红球菌(Rhodococcus qingshengii sp. nov. )djl-6和啶虫脒降解菌株噬染料菌(Pigmentiphaga sp. )D-2为供试菌株,研究了降解菌菌剂的不同保存剂型与初步应用的情况。结果表明,2株降解菌均以苯甲酸钠作为防腐剂的处理效果最好,能维持活菌数较高且不产生杂菌污染。降解菌djl-6复配保护剂的最佳使用浓度:0.30%柠檬酸钠、0.30%羧甲基纤维素、0.20% CaCl2。降解菌D-2复配保护剂的最佳使用浓度:0.20%糊精、0.20%柠檬酸钠、0.30% CaCl2。与对照相比,添加保护剂后,菌株djl-6、菌株D-2活菌数分别够提高32.03%、38.70%。2株菌的液体菌剂保存45 d后,降解菌djl-6能够在10 d内将土壤5 mg/kg多菌灵降解95.23%,降解菌D-2能够在10 d内将土壤5 mg/kg啶虫脒降解92.75%,有效延长了液体菌剂的保存期。
关键词:多菌灵降解菌;啶虫脒降解菌;液体菌剂;保存条件
中图分类号: X172 文献标志码: A 文章编号:1002-1302(2020)17-0270-06
设施农业作为农业现代化发展的重要产业越来越受到各国政府的重视,设施农业不仅有效解决了我国淡季期间蔬菜短缺问题,还促进了居民传统消费结构的改变[1]。但是设施农业中蔬菜病虫害较多,农药的使用率也相对较高,以多菌灵和啶虫脒为代表的农药因其高效低毒的特点[2-4]而被广泛应用于设施农业之中。多菌灵是一种内吸性的广谱杀菌剂,土壤中残留的多菌灵会导致土壤微生物数量下降,抑制土壤脱氢酶、磷酸酶活性[5-6]。啶虫脒是一种内吸杀虫剂,残留在土壤中会抑制土壤固氮菌、放线菌活性,对土壤动物产生慢性毒性[7-8]。
应用微生物修复农药残留污染是一种公认的安全有效的方法。目前,我國农药残留相关研究主要集中在高效降解菌株的筛选和培育上,在微生物菌剂的开发应用方面的研究仍然不够完善[9-11]。微生物作为一种活体生物,其保存情况极易受到外界环境的影响,微生物液体菌剂的储存一直是阻碍降解菌菌剂的大规模应用的难题,而目前关于微生物液体菌剂保存条件的研究非常少[12-14]。笔者所在实验室分离并保藏了多菌灵、啶虫脒降解菌株,其中多菌灵降解菌株能在7 d内将5 mg/kg多菌灵降解80.0%,啶虫脒降解菌株在5 d内将 10 mg/kg 啶虫脒降解90.0%。由于液体菌剂中的微生物易受周围环境影响从而导致菌剂保存期短,本研究首先筛选出了2个菌株的液体菌剂防腐剂及其使用浓度,研究了菌剂不同保藏条件对其活菌数以及降解率的影响,以期为农药降解菌菌剂的保存与应用提供一定的理论基础。
1 材料与方法
1.1 试剂与培养基
多菌灵原药购自江苏省新沂农药有限公司(纯度99.8%)。啶虫脒原药购自绿源制药集团(纯度98.3%)。无机盐培养基:硝酸铵1.0 g/L,磷酸二氢钾0.5 g/L,磷酸氢二钾1.5 g/L,氯化钠1.0 g/L,MgSO4·7H2O 0.2 g/L,pH值7.0。
LB培养基:酵母浸出物5.0 g/L,蛋白胨 10.0 g/L,氯化钠10.0 g/L,超纯水1 L,pH值7.0,固体培养基加入1.5%~2.0%的琼脂。
D-2发酵培养基:葡萄糖9 g/L,硫酸铵 0.9 g/L,酵母膏0.3 g/L,氯化钠0.1 g/L,碳酸钙 1 g/L,磷酸氢二钾1 g/L,MgSO4·7H2O 0.5 g/L,pH值7.0~7.2。
djl-6发酵培养基:葡萄糖8 g/L,硫酸铵 0.8 g/L,酵母膏0.2 g/L,氯化钠0.1 g/L,碳酸钙0.5 g/L,磷酸氢二钾1.5 g/L,MgSO4·7H2O 0.1 g/L,pH值7.0~7.2。
1.2 供试菌株、供试作物与土壤
多菌灵降解菌株庆笙红球菌(Rhodococcus qingshengii sp. nov. )djl-6,啶虫脒降解菌株噬染料菌(Pigmentiphaga sp. )D-2,均由笔者所在实验室分离并保藏。
供试青菜品种为上海青,购自南阳青青种业。
供试土壤为黄棕壤,采集于南京农业大学牌楼试验基地。
1.3 液体菌剂防腐剂的筛选
1.3.1 防腐剂的初筛 设置菌株djl-6、菌株D-2这2组处理,每组处理取12个已灭菌的500 mL三角瓶(共24个)。每种菌设置4个防腐剂添加处理,依次为丙酸钙、苯甲酸钠、山梨酸钾、不添加试剂(CK),每个处理3个平行,共12个。每个处理依次加入相应的已发酵的菌株发酵液300 mL和添加量为发酵液的0.50%(1.5 mL)的防腐剂,CK为不添加防腐剂的对照组,添加等体积(1.5 mL)的无菌水。用封口膜封紧,置于常温条件下避光保存。放置3 d后,取样,采用稀释涂布平板法对菌株djl-6、菌株D-2以及杂菌进行计数,并计算杂菌率[15-16]。
1.3.2 防腐剂的复筛 根据防腐剂的初筛结果,分别向菌株djl-6和菌株D-2发酵液中添加苯甲酸钠作为防腐剂,添加量分别为发酵液的0.10%、0.30%、0.50%、0.70%、1.00%,同时设置不添加苯甲酸钠的对照,后续操作同“1.3.1”节。
1.4 液体菌剂保护剂的筛选
1.4.1 单因子保护剂的筛选 分别挑取菌株djl-6、菌株D-2的单菌落于LB液体培养基中,放置于30 ℃摇床中160 r/min培养至对数生长期,以1%接种量接入到盛有500 mL液体发酵培养基的三角瓶中继续培养至对数生长期。在无菌条件下装入已高温灭菌的50 mL无菌管中,再分别加入预先初筛过的氯化钙、氯化镁、氯化钾、糊精、黄腐酸、羧甲基纤维素、甲酸钠、乙酸钠、柠檬酸钠试剂作为助剂,使试管中的助剂添加量分别为0.10%和0.20%,同时设置不加助剂的对照,并向对照加入相同体积的无菌水,每个处理设置3个平行。30 d 后取样,通过稀释涂布平板法计算有效活菌数。
2.4 液体菌剂对土壤中农药残留的降解效果
按照“2.2.2”节中保护剂的配比分别将保护剂加入到djl-6、D-2的液体菌剂中保存45 d后,取 10 mL 菌剂各自加入到干土中含量为5 mg/kg多菌灵及啶虫脒干土的塑料杯中,10 d后测定土壤中农药的残留量,并计算降解率。如图3、图4所示,djl-6 液体菌剂对土壤中农药残留降解率最高的组合为正交组合9,10 d内降解率达95.23%;其他组合的降解率与CK(不加任何保护剂)相比也有明显提高,而在相同条件下CK降解率只能达到48.82%。D-2液体菌剂对土壤中农药残留降解率最高的组合为正交组合5,10 d内其降解率达到了92.75%,其他组合的降解率与CK(不加任何保护剂)相比也有明显提高,而CK在相同条件下降解率只能达到41.21%。
3 讨论与结论
微生物液体菌剂因工艺简单、制作成本低被广泛使用,但由于微生物极易受到周围环境的影响,在运输、保存、使用过程中菌剂的活性会发生变化[17-19],如何提高菌剂的活性以及有效菌存活率成为活菌制剂亟需解决的难题。研究表明,向菌剂中添加保护剂以及抑制剂可以提高菌剂的活性,降低菌剂产品的污染率[20]。本研究发现,加入防腐剂苯甲酸钠后,与对照组相比杂菌率大大降低。进一步研究发现,当苯甲酸钠的添加量达到一定值后,不会出现杂菌污染,这与车建美等的研究结果[21]一致。这说明防腐剂的加入有效地抑制了杂菌的生成,使多菌灵、啶虫脒降解菌株更好发挥功能。李剑峰等选择了青霉素作为保护剂加入到解磷菌剂中使得目标菌的增值速度变慢,提升了菌种的活力[22]。本研究通过正交试验研究出了保护剂的最佳组合,加入保护剂后,多菌灵、啶虫脒降解菌株的活菌数增加,液体菌剂保存30 d仍具有明显的降解效果,这表明保护剂的加入延长了菌剂的使用期。本研究均在盆钵中进行,下一步农药残留污染土壤的修复工作将在田间进行,实时监测菌株djl-6和菌株D-2在试验田中定殖的生物量和对农药的降解。
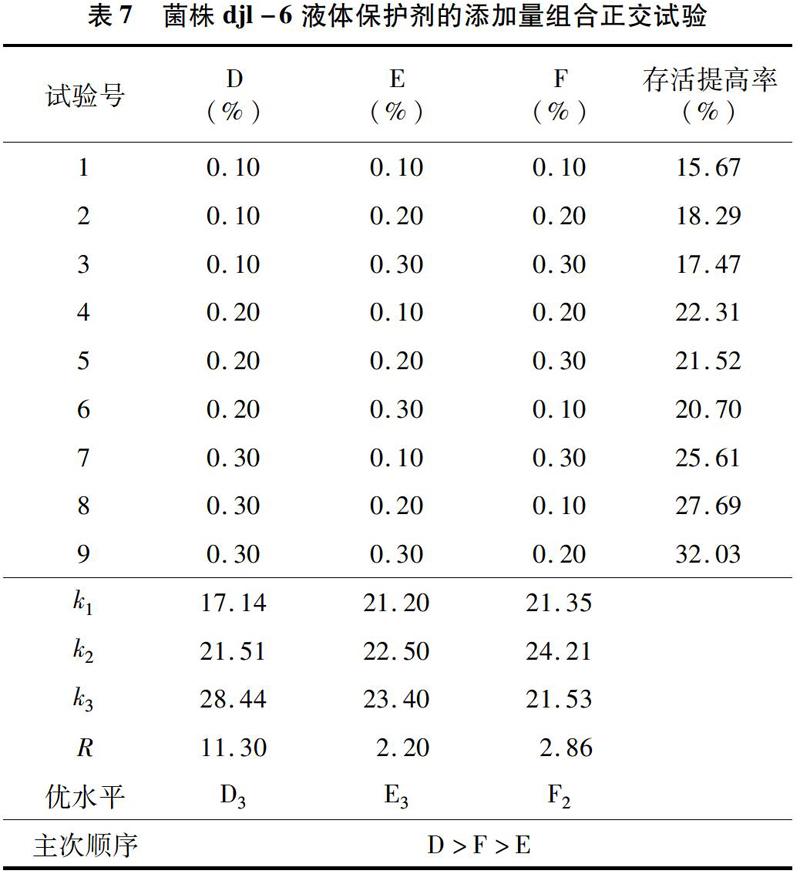
本研究表明,通过添加苯甲酸钠、丙酸钙、山梨酸钾3种具有抑菌防霉作用的防腐剂,分别对菌株djl-6和菌株D-2的杂菌率进行计算,发现2株降解菌均以苯甲酸钠作为防腐剂效果最好。通过液体菌剂保护剂的正交筛选,降解菌djl-6复配保护剂的最佳添加量为0.10%的柠檬酸钠、0.30%的羧甲基纤维素、0.20%的CaCl2。降解菌D-2复配保护剂的最佳添加量为0.10%的糊精、0.20%的柠檬酸钠、0.30%的CaCl2。通过正交试验筛选的菌剂助剂能够有效提高细菌存活率,其中djl-6的发酵液中活菌数能够提高32.03%,D-2的发酵液中的活菌数能提高38.70%。添加有保护剂保存30 d的菌株djl-6的液体菌剂在3 d内最多能够降解93.65%的50 mg/L多菌灵,添加有保护剂保存30 d的菌株D-2的液体菌劑在3 d内最多能够降解85.32%的50 mg/L啶虫脒。添加有保护剂的保存45 d的菌株djl-6的液体菌剂,在10 d内能将干土中含量为5 mg/kg的多菌灵降解95.23%。添加有保护剂的保存45 d的菌株D-2的液体菌剂,在 10 d 内能将干土中含量为5 mg/kg的啶虫脒降解92.75%。本研究为农药降解菌菌剂的生产应用及保存提供理论基础。
参考文献:
[1]Wang Y C,Zhou Q Y. Evaluation of development of agricultural modernization in central China[J]. IERI Procedia,2013,4:417-424.
[2]Burrows L A,Edwards C A. The use of integrated soil microcosms to assess the impact of carbendazim on soil ecosystems[J]. Ecotoxicology,2004,13(1/2):143-61.
[3]Sousa J P,Gestel C A M V,Loureiro S E,et al. Ring-testing and field-validation of a terrestrial model ecosystem (TME)—an instrument for testing potentially harmful substances:effects of carbendazim on soil microbial parameters[J]. Ecotoxicology,2004,13(1/2):61-74.
[4]宋 超,周杨全,李义强,等. 三种新烟碱类杀虫剂在土壤中的残留降解及影响因子[J]. 农药学学报,2016,18(6):738-744.
[5]龚芬芬. 多菌灵降解菌的分离鉴定、生物学特性及多菌灵水解酶基因的克隆和表达研究[D]. 南京:南京农业大学,2011:13-16.
[6]陈 锐,孙晓宇,邓 媛,等. 多菌灵降解菌的生物学特性及降解能力研究[J]. 生物技术通报,2018,34(5):187-194.
[7]刘少伟,阮赞林. 啶虫脒超标青菜[J]. 质量与标准化,2018,3(79):40-41.
[8]诸 力,王 晨,陈红平,等. 超高效液相色谱-串联质谱法同时测定茶叶中11种植物生长调节剂及吡虫啉、啶虫脒的残留[J]. 分析化学,2017,45(4):529-536.
[9]陈扬波,卞杰松,刘彩霞,等. 生物有机肥中微生物的分离鉴定及液体菌剂的构建[J]. 广东农业科学,2019,46(5):54-59.
[10]张晓波. 在玉米上应用微生物菌剂(液体)效果探讨[J]. 农业开发与装备,2016(6):63-64.
[11]Kaur T,Toor A P,Wanchoo R K. Parametric study on degradation of fungicide carbendazim in dilute aqueous solutions using nano TiO2[J]. Desalination & Water Treatment,2015,54(1):122-131.
[12]詹 祎,王云鵬,郭坚华. 保护剂和再水化剂对冷冻干燥保存的生防菌YT11的存活率及生防效果的影响[J]. 中国生物防治学报,2011,27(1):110-114.
[13]刘振华,邢雪琨. 微生物农药助剂研究进展[J]. 基因组学与应用生物学,2016,35(8):2109-2113.
[14]胡青青,沈文忠,张绪美,等. 新型微生物菌剂对小青菜生长及品质的影响[J]. 上海农业科技,2019(2):116-118.
[15]张安龙,王 晔,王雪青,等. 一株高效苯酚降解真菌的分离鉴定及其菌剂的制备[J]. 微生物学通报,2018,45(7):1450-1461.
[16]吴皓琼,沙长青,牛彦波,等. 保护剂与防腐剂对生物肥料保存期的影响[J]. 生物技术,2004,14(6):55-56.
[17]王 婧,方 蕊,蒋秋悦,等. 载体和保护剂对橘黄假单胞菌JD37微生物肥料活性的影响[J]. 上海师范大学学报(自然科学版),2012,41(2):179-185.
[18]李春光,张建萍,余柳青. 助剂在微生物除草剂中的应用[J]. 中国生物防治,2006,22(4):265-267.
[19]高鹤南,赵巍巍,马晓亮,等. 降解烟嘧磺隆微生物菌剂的制备及其稳定性[J]. 农药,2011,50(6):420-423.
[20]顾真荣. 苏云金杆菌晶体毒素稳定性和发酵液保存方法的研究[J]. 微生物学通报,1984(5):193-195.
[21]车建美,刘 波,刘国红,等. 动物益生菌短短芽胞杆菌FJAT-1501-BPA制剂的制备及其益生特性评价[J]. 中国畜牧兽医,2017,44(10):2897-2907.
[22]李剑峰,师尚礼,张淑卿. 不同Ca3(PO4)2含量及菌种保存温度下SL01菌株的解磷及生长能力[J]. 中国生态农业学报,2010,18(1):94-97.

