基于ISSR标记的29种石斛遗传多样性分析
胡利娟 贾元 田忠静 冯群 刘杰 朱斌


摘要:遗传多样性分析可为野生植物的开发与保护提供科学依据。采集贵州地区的29份石斛资源,通过简单重复序列间扩增(inter-simple sequence repeats,简称ISSR)标记对其进行遗传多样性和亲缘关系分析,从16条引物中筛选出13条多态性稳定的ISSR引物进行扩增。结果表明,13条引物共扩增出214个条带,其中多态性条带数为212个,多态性比例为99.07%,平均每个引物扩增的条带数为16.46条。随后利用非加权平均距离法(UPGMA)对其进行聚类分析,结果显示,29份石斛材料的遗传相似系数为0.678~0.804。在遗传相似系数为0.715处,可以把29种石斛植物划分为10个类群,从而证明所取石斛材料的遗传多样性十分丰富。
关键词:石斛;ISSR分子标记;遗传多样性;亲缘关系
中图分类号: S567.23+9.01 文献标志码: A 文章编号:1002-1302(2020)17-0076-05
石斛属(Dendrobium)是兰科(Orchidaceae)的大属之一,属附生兰类多年生草本植物。全球约有 1 500 多种石斛属植物,主要分布于亚洲、欧洲、大洋洲等地[1],中国现共有76种石斛属植物,主要产区分布于四川、云南、广西和贵州等省份的原始森林以及安徽、浙江等省份[2]。大多数石斛具有药用和观赏价值,目前发现的药用石斛有39种,具有润肺生津、活血化瘀、治疗心血管疾病等功效[3]。由于石斛种类繁多,历代本草著作称之为医工难辨的种类[4]。随着人们对药用及观赏石斛需求量的不断扩大和森林砍伐等多方面的影响,野生石斛属植物资源面临枯竭,已经成为濒危植物[5]。近年来,由于人们对药用石斛需求量的加大,石斛种植面积不断增加,选育优良石斛品种供生产使用尤为重要。
为了更好地利用药用石斛种质资源,更准确地了解石斛种质资源的类型及亲缘关系,对石斛资源进行遗传多样性及亲缘关系分析显得尤为重要[6]。目前应用于石斛属植物种质资源鉴定和亲缘关系研究的分子生物学方法主要有随机扩增多态性DNA标记(random amplified polymorphic DNA,简称RAPD)、限制性内切酶片段长度多态性(restriction fragment length polymorphism,简称RFLP)、扩增片段长度多态性(amplified fragment length polymorphism,简称AFLP)、简单重复序列间扩增(inter-simple sequence repeats,简称ISSR)等[7-9]。ISSR技术是由加拿大蒙特利尔大学的Zietkewicz等发展起来的一种基于微卫星(SSR)序列的分子标记技术,与SSR相比,用于ISSR的引物不需要预先的DNA测序,而是用半随机引物进行扩增,可获得丰富的多态性[10]。ISSR标记的特点是数量丰富、广泛分布于整个基因组、具有较多的等位性变异与共显性标记、可鉴别出杂合子和纯合子、试验的重复性较好等。本研究选用29种石斛材料,采用ISSR-PCR分子标记研究其遗传多样性,并创建亲缘关系图谱进行分析。
1 材料与方法
1.1 材料、试剂和仪器
本研究共选用29种石斛材料(表1),其中27种为石斛属,1种为石豆兰属,1种为钗子股属,目前统一种植于贵州师范大学生命科学学院四楼实验室。
试验试剂:十六烷基三甲基溴化铵(CTAB)、Tris、乙二胺四乙酸(EDTA)、苯酚、三氯甲烷、异戊醇、盐酸、无水乙醇等,均购自贵州凯信生物科技有限公司;2×Taq Master Mix(Dye),含有0.1 U/μL Taq DNA聚合酶、3 mol/L氯化镁和40 μmol/L dNTPs,购自北京康为世纪生物科技有限公司;ISSR引物,由生工生物工程(上海)股份有限公司合成。
试验仪器:ETC811PCR仪(东胜创新生物科技有限公司);DYY-8C型电泳仪(北京六一生物科技有限公司);DYCP-31E型电泳槽(北京六一生物科技有限公司);K8360凝胶成像分析系统(北京科创锐新生物科技有限公司);离心机(湖南凯达科学仪器有限公司)。
1.2 基因組DNA的提取
从实验室栽培的石斛植株上取幼嫩叶片,参考CTAB法[11]并加以调整,用于提取植物基因组DNA。调整后的方法如下:剪取0.1 kg石斛的幼嫩叶片(新鲜叶片也可)放置于研钵中,加入750 μL 2%(质量分数)CTAB水溶液进行研磨,将叶片充分研磨后转移到1.5 mL离心管中,65 ℃水浴60 min(其间每 20 min 摇匀 1 次),取出离心管冷却到室温,在通风橱内通风状态下加入750 μL苯酚+三氯甲烷+异戊醇(体积比为25 ∶ 24 ∶ 1)的混合液,上下颠倒摇匀,置于离心机中12 000 r/min离心 15 min,轻轻取出,取上清液500 μL于新的试管中,向上清液中加入1 000 μL冰的无水乙醇沉淀DNA(无水乙醇在提取DNA前先置于-20 ℃冰箱中冻存一段时间),在-20 ℃条件下放置20 min或更长时间(放置时间的长短可根据DNA的析出程度调节,若DNA析出较多,则不用在-20 ℃条件下长时间放置)。DNA析出后,置于离心机中8 000 r/min离心5 min去除上清液,沉淀用50%乙醇清洗3次,第3次清洗时乙醇不倒出,放置过夜,第2天离心后倒掉上清液乙醇,放置于室温下晾干或置于通风橱中风干,至DNA沉淀呈透明状,再加入200 μL无菌去离子水溶解DNA,溶解后置于-20 ℃保存。
1.3 引物的筛选
ISSR引物是根据杨立昌等公布的引物序列[11-12]合成的,从生工生物工程(上海)股份有限公司合成的16个引物中筛选出13个扩增条带清晰、稳定、多态性较好的引物用于29份石斛材料种质资源遗传多样性的分析。
1.4 ISSR-PCR扩增
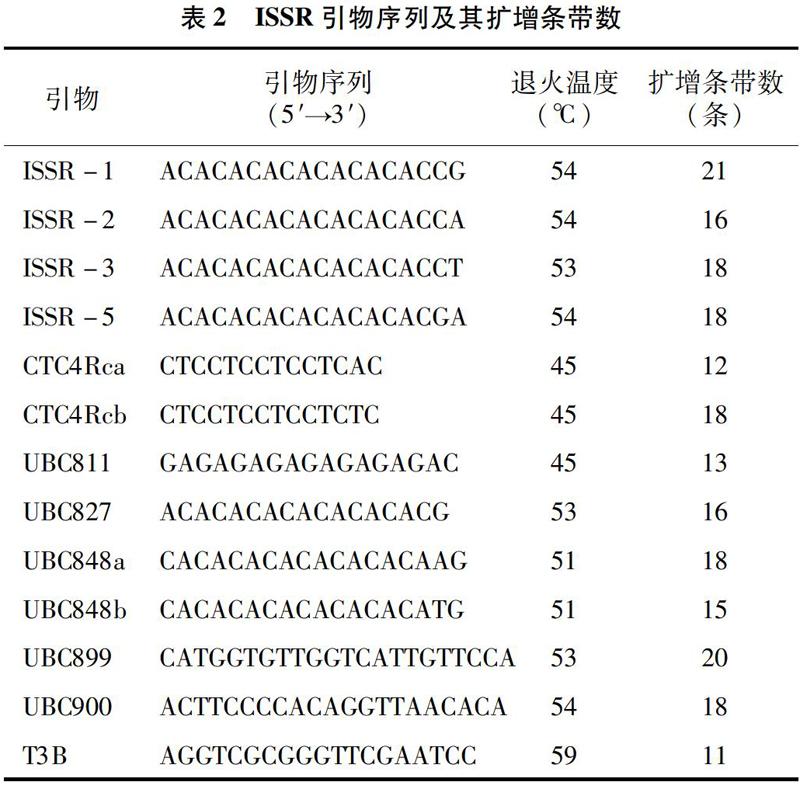
ISSR引物由生工生物工程(上海)股份有限公司合成(表2)。参考ISSR反应体系[13]并加以改进,改进后的22 μL反应体系如下:4 μL DNA,1 μL引物,8 μL Mix(含有氯化镁、dNTP、Taq酶、反应缓冲液),9 μL超纯水。
PCR扩增程序:94 ℃预变性7 min;94 ℃变性 1 min,退火45 s[退火温度依据不同引物而定(表2)],72 ℃延伸2 min,共45个循环;72 ℃复性 7 min,4 ℃保存PCR扩增产物。
1.5 电泳
用1×TAE缓冲液配制1.5%琼脂糖凝胶,将凝胶放置于含有1×TAE缓冲液的电泳槽中,使缓冲液没过凝胶表面约2 mm。PCR产物上样量为 18 μL,使用Super DNA marker标定扩散片段长度,在90 V电压下电泳90 min,再置于凝胶成像系统上观察,检测ISSR-PCR电泳谱带。
1.6 数据统计
按照电泳图谱中同一位置上DNA条带的有无进行统计,有条带的记为“1”,无条带的记为“0”,构成0/1矩形图,用NTSYS 2.10软件SHAN程序中的非加权配对算术平均法(unweighted pair-group method with arithmetic means,简称UPGMA)对样品进行聚类分析,构建29种石斛材料的亲缘关系树状图。
2 结果与分析
2.1 引物的选择
本研究用16个引物对29种石斛材料的基因组DNA进行预试验扩增,并对16个引物进行筛选,获得13个多态性较好的引物,然后用筛选出的13个引物对29种石斛材料进行扩增。从表3看出,扩增条带数最多的是引物ISSR-1,扩增出21个条带,扩增条带最少的是引物T3B,只扩增出11个条带。
2.2 ISSR-PCR扩增结果
根据对凝胶成像系统拍照结果的分析得到0/1矩阵图(本文未列出)。由图1和图2可以看出,电泳共检测出214个扩增條带,其中多态性条带数为212个,多态性比例为99.07%,平均每条引物扩增的条带数为16.46条,说明供试样品具有较高的多态性。
2.3 遗传相似性及亲缘关系
由图3可以看出,13条引物能将29种石斛材料分开,遗传相似系数(GS)变化范围为0.678~0.804,表明供试样品有较近的亲缘关系。在遗传相似系数0.715处,可以将石斛材料分为10个大组,每个大组又分为不同的小组:第1组,包含7种石斛,分别是铁皮石斛、报春石斛、铜皮石斛、串珠石斛、黄贝壳石斛、钗子股、石豆兰,说明该大组内7种石斛的亲缘关系比较近,其中铁皮石斛与报春石斛的遗传相似系数达到0.790,在29种石斛植物中,这2种石斛的遗传相似系数排第3;第2组,包含4种石斛,分别是尖刀唇石斛、鼓槌石斛与大龟背石斛、黑毛石斛,其中鼓槌石斛、大龟背石斛的遗传相似系数为0.800,是29种石斛材料中亲缘关系最近的2种;第3组,包含3种石斛,分别是扭瓣石斛、蜂腰石斛、赤水金钗石斛,其中扭瓣石斛与蜂腰石斛的遗传相似系数为0.795,在29种石斛材料中,是除了鼓槌石斛与大龟背石斛之外遗传相似系数最高、亲缘关系最近的2种石斛;第4组,包含3种石斛,分别是肿节石斛、杯鞘石斛、翅梗石斛;第5组,包含2种石斛,分别是密花石斛、喉红石斛;第6组,包含4种石斛,分别是反瓣石斛、球花石斛、杓唇石斛、灯笼石斛,其中反瓣石斛与球花石斛的遗传相似系数为0.790,亲缘关系也非常近;第7组,包含3种石斛,分别是蜻蜓石斛、剑叶石斛、线叶石斛;第8组,包含虎牙石斛;第9组,包含红牙刷石斛;第10组,包含天宫石斛。从聚类分析结果可以看出,虎牙石斛、红牙刷石斛、天宫石斛这3种石斛与其他26种石斛的亲缘关系较远。
3 讨论
石斛属植物分布在中国秦岭淮河以南诸省,其中云南、广西、台湾、贵州为分布中心[14]。根据传统的分类方法,石斛属植物可以分成不同的组别,《中国植物志》将中国石斛的74个种划分为12个组[15],其中药用石斛有39种,并且有的石斛种类仅从茎、叶等形态上无法加以区分[16]。因此,分子标记也被应用于石斛的分子鉴定中。DNA分子标记不受环境因素的影响,能直接反映基因组DNA之间存在的差异[17]。现代分子标记不仅可用于石斛植物的分子鉴定,还能全面揭示不同石斛种群的遗传多样性和亲缘关系。本研究选用29种石斛为样本,采用13条引物分析不同石斛品种资源的遗传多样性,结果显示,微卫星位点多态性比例达到99.07%,表明石斛的遗传多样性极其丰富。在所选择的13条引物中,有的引物扩增条带数较多,如引物ISSR-1的扩增条带数为21条,引物UBC899的扩增条带数为20条。但也有部分引物的扩增条带数较少,如引物T3B、CTC4Rca、UBC811分别只扩增出了11、12、13条条带,可见不同石斛有着复杂的遗传背景。
本研究中石斛的ISSR分子标记聚类分析结果与传统的分类结果基本相同,但也存在差异,可能与分析过程中取样的多少、基因组DNA的提取方法、PCR扩增体系的异同等有关。自然环境因子的复杂多样性也可能是造成这种差异的原因。随着科学技术的不断发展,越来越多的分子生物学方法被应用于石斛属植物种质资源的鉴定和亲缘关系的研究中,如RAPD、RFLP、AFLP等。在今后的研究中,应进一步采用多种分子生物学方法对同一石斛属植物材料的遗传多样性及亲缘关系进行分析。
参考文献:
[1]Dressler R L. Phylogeny and classification of the Orchid family[M]. Cambridge:Cambridge University Press,1993.
[2]刘 静,何 涛,淳 泽. 分子标记技术在石斛属植物中的应用研究进展[J]. 应用与环境生物学报,2008,14(6):855-862.
[3]陈晓梅,郭顺星. 石斛属植物化学成分和药理作用的研究进展[J]. 天然产物研究与开发,2001,13(1):70-75.
[4]包雪生,顺庆生,陈立钻. 中国药用石斛[M]. 上海:复旦大学出版社,2001:1-40.
[5]孔 琼,袁盛勇,薛春丽,等. 云南野生石斛ISSR-PCR分析[J]. 西南农业学报,2015,28(3):1242-1245.
[6]李永清,江金兰,叶 炜,等. 37份药用石斛种质资源亲缘关系的ISSR分析[J]. 福建农业学报,2015,30(2):131-135.
[7]张 婷,徐珞珊,王峥涛,等. 药用植物束花石斛、流苏石斛及其形态相似中的PCR-RFLP鉴别研究[J]. 药学学报,2005,40(8):728-733.
[8]冯夏蓮,何承忠,张志毅,等. 植物遗传多样性研究方法概述[J]. 西南林学学报,2006,26(1):69-74.
[9]王慧中,应奇才,施农农,等. 利用RAPD分析13种石斛属植物的遗传多样性和亲缘关系[J]. 中草药,2006,37(4):588-592.
[10]曾 民,郭鸿彦,胡学礼,等. 大麻研究中的分子标记应用[J]. 中国麻业科学,2007,29(4):189-191.
[11]杨立昌,邓 辉,乙 引,等. 药用石斛ISSR分子标记研究[J]. 中药材,2010,33(12):1841-1844.
[12]杜明凤,李明军,陈庆富. 淫羊藿属植物PCR-RFLP遗传多样性研究[J]. 中草药,2012,43(3):562-567.
[13]李盛清,张传博,乙 引,等. 石斛ISSR-PCR体系的优化[J]. 江苏农业科学,2012,40(8):37-39.
[14]李 琴,杨彦伶,彭 婵,等. 药用石斛研究进展[J]. 农学学报,2018,8(10):61-64.
[15]吉占和. 中国植物志(第十九卷)[M]. 北京:科学出版社,1999:67-146.
[16]张 智,霍立业. 霍山石斛营养器官的解剖结构[J]. 安徽农业大学学报,1995,22(3):301-304.
[17]莫建梅,刘莺燕,李庆国,等. “龙头凤尾”铁皮石斛基因鉴别及复方胶囊降血糖研究[J]. 江苏农业科学,2019,47(1):182-185.

