酸化剂对大肠杆菌经肛门攻毒的蛋鸡肠道影响
郭 华,王 珊,李春阳,庄志伟2
(1. 潍坊加易加生物科技有限公司,山东 潍坊 261108;2. 山东新希望六和集团有限公司,山东 青岛 266000)
有机酸(酸化剂)是一类重要的抗生素替代化合物,近几十年来在家禽日粮中的使用量有所增加。众所周知,这些添加剂可通过细菌膜的去极化改变微生物种群,从而改变其内部酸度,进而对家禽的胃肠道功能产生很大的影响[1],并使家禽能够更好地利用养分。近年来,在饮水中添加有机酸的情况有所增加。另一方面,据报道,饮水是家禽养殖场微生物传播的最重要因素之一[2]。因此,在饮水中添加有机酸可能有利于增加肉鸡消化道中有益菌的数量。本研究旨在通过探讨在饮水中添加不同饮水型酸化剂对饮水内菌落数量的影响以及添加不同饮水型酸化剂对经大肠杆菌攻毒后蛋鸡抗大肠杆菌侵染能力、肠道pH、肠道菌群组成和消化酶酶活力的影响,为饮水型酸化剂在蛋鸡养殖上的应用提供理论依据。
1 材料与方法
1.1 试验动物和分组
试验选择90羽25日龄的健康海兰褐蛋鸡,预试验3 d;各组饲喂新希望六和配合全价料。在29日龄时,将90羽蛋鸡随机分为对照组、试验组1和试验组2,每组设6个重复,每个重复5羽。对照组的饮水中不加任何物质,试验组1的饮水加入0.1%的潍坊某公司生产的LDS(甲酸、乳酸和肉桂醛),试验组2的饮水加入0.1%的青岛某公司生产的FLS(甲酸、丙酸和香芹酚),每周连续使用4 d,每日保证至少10 h酸化水的饮量,自由饮水,自由采食、自然光照,试验期为14 d。
1.2 主要试剂和仪器
1.2.1 主要试剂及菌种
LB液体培养基(L10010,青岛海博生物有限公司)、胃蛋白酶试剂盒(HY-60091,上海纪宁生物科技有限公司)、胰蛋白酶活性检测试剂盒(BC2310,上海纪宁生物科技有限公司)、淀粉酶活性检测试剂盒(BC0615,上海纪宁生物科技有限公司)、大肠杆菌(由新希望六和动保中心临床分离鉴定菌提供)、HiCrome(TM)ECC选择性培养基[西格玛奥德里奇(上海)贸易有限公司],乳酸杆菌选择性培养基(HB0385-1,青岛海博生物有限公司)等。
1.2.2 主要仪器
分光光度计(DR3900,美国哈希公司),气浴恒温振荡器(THZ-82A浙江赛德设备仪器有限公司),pH计(PHS-25上海仪电科学仪器有限公司),台式冷冻离心机[3K15,SIGMA(中国)公司]等。
1.3 体外试验:不同饮水型酸化剂的体外抗菌活性评价
将1 mL 2×105CFU/mL大肠杆菌注入9 mL LB液体培养基中。将不同浓度的酸化剂按体内使用的相同浓度(自来水、0.1%LDS、0.1%FLS)加入不同的试管内。然后在每个时间间隔用分光光度计测量吸光度后,将试管在37 ℃下孵育1 h、2 h和24 h。绘制不同吸光度的标准曲线,进行细菌计数。记录处理样本计数,并计算与各自对照相关的抑制率。
参考Bolder和Palmu的方法对用不同酸化剂处理后的蛋鸡饮水细菌总数进行评价:家禽饮用结束后,采集不同处理组的水样测定细菌总数,以评估不同酸化剂对蛋鸡饮水中细菌的抑制能力。
1.4 体内试验:不同饮水型酸化剂的体内试验评价
体内验证试验按照“1.1试验动物和分组”所述,采取对不同酸化剂处理至42日龄时的试验养殖对象进行攻毒(动物大肠杆菌病模型如下所述),验证不同饮水型酸化剂的实际应用效果。
动物大肠杆菌病模型的建立:在42日龄进行大肠杆菌(由新希望六和动保中心临床分离鉴定菌提供)攻毒试验,从对照组随机选取15羽蛋鸡,随机分为3组,每组5羽,用带有刻度的软管经倒立的鸡肛门缓慢插入并注入经复苏的临床分离鉴定大肠杆菌到回肠处,攻毒剂量分别为0.3 mL和0.5 mL;在44日龄随机宰杀,取23羽,其中试验组各8羽,对照组7羽,在食道和腺胃、腺胃和十二指肠以及空肠和回肠各处结扎冷藏备用。
1.4.1 攻毒试验
攻毒前复苏90 mL大肠杆菌12 h,测得OD值为2.43;试探选择攻毒剂量0.3 mL/羽和0.5 mL/羽,每个剂量组5羽,在攻毒1 h和1.5 h后观察鸡的粪便状态和精神状况;从有症状的攻毒鸡中选择攻毒剂量作为参考,再增加攻毒剂量到0.7 mL/羽和1 mL/羽,每个剂量攻毒5羽;观察鸡群是否有呼吸道症状以及精神状态和粪便情况,若有,此时的剂量为攻毒剂量,分别在试验组1和试验组2中各攻毒5羽。
1.4.2 日常养殖状况记录
观察鸡群临床状态(精神、呼吸症状、粪便和羽毛蓬松)以及采食和饮水情况。
1.4.3 肠道检测
将肠道内容物和离子水按照1∶9(W/V)搅拌均匀后静止5 min,用选择性培养基在37 ℃经24 h培养肠道微生物(乳酸菌/大肠杆菌) 或经48 h培养乳酸菌并计数;对余下的检测样本按2 000 r/min~3 000 r/min离心5 min,取样,用行业标准检测方法检测淀粉酶和胰蛋白酶的酶活力,再测定pH,每个样本测2个平行样,取其平均值。
1.4.4 腺胃检测
在腺胃内壁上用载玻片直接取黏液,每羽鸡吸取用胃蛋白酶试剂盒检测或将冷冻的腺胃于2 ℃~8 ℃保鲜下解冻2 h~3 h,称取 1 g腺胃黏液,加入9 g的pH 7.2~7.4的1×PBS液,充分混匀,在2 ℃~8 ℃下用2 000 r/min~3 000 r/min离心20 min,仔细收集上清液。分装一份待检测,其余冷冻备用。保存过程中如有沉淀,应再次离心,每个样本测2个平行样,取其平均值。
1.5 统计与分析
数据用SPSS 22.0软件进行单因素方差分析,多重比较用LSD法。所有数据均以“平均值±标准差”的方式表示。
2 结果
2.1 不同酸化剂对大肠杆菌培养的时间依赖性抑制作用
表1的结果表明,不同酸化剂发挥抑菌作用的时间不同,抑制培养基中大肠杆菌生长的能力也不同。0.1%LDS,1 h、3 h、24 h的抑制率分别为20.66%、42.74%、29.13%;0.1%FLS,1 h、3 h、24 h的抑制率分别为29.11%、49.19%、40.29%;对比相应时间点的抑制率可以发现,0.1%FLS抑菌能力强于0.1%LDS。

?
2.2 酸化剂对饮水样时间依赖性抑制作用
经不同酸化剂处理的饮水细菌总数评估结果见表2。与处理后7 d相比,感染后21 d,所有组(包括对照组)饮水的微生物含量都有所减少。感染7 d后,乙酸(3 m/L)和有机酸混合液处理组的饮水中细菌总数均显著低于未处理的对照组饮水的(P<0.05)。在感染21 d后,两种酸化剂处理的饮水细菌总数同对照组相比,有减少的趋势,无显著性差异(P>0.05),对比相应时间点的饮水样中的细菌总数发现,0.1%LDS的抑菌能力强于0.1%FLS的,同“2.1不同酸化剂对大肠杆菌培养的时间依赖性抑制作用”的试验结果一致。

?
2.3 蛋鸡攻毒后的临床表现
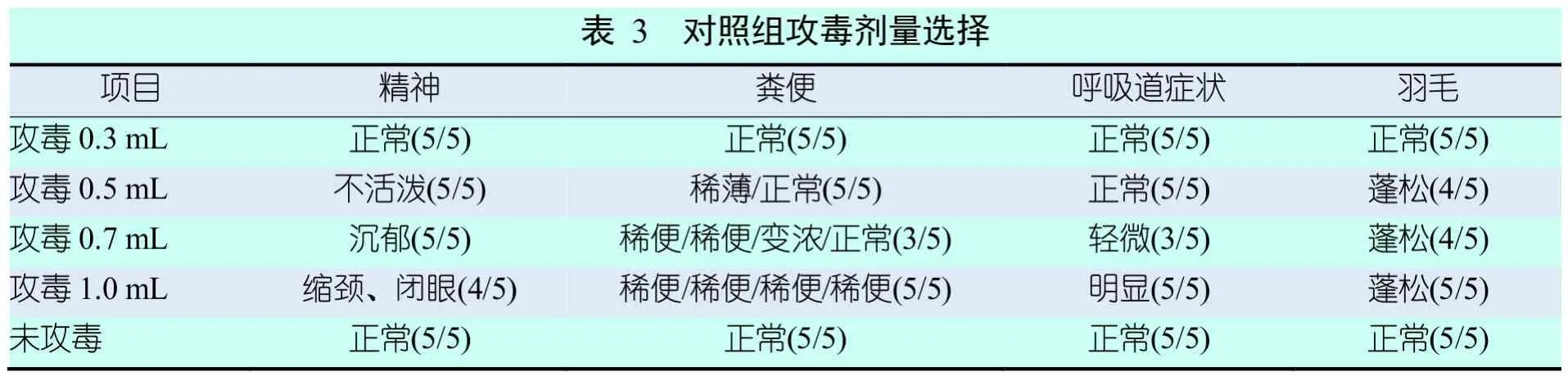
2.3.1 对照组攻毒剂量的选择及蛋鸡临床表现
分别对对照组的试验蛋鸡用0.3 mL、0.5 mL、0.7 mL及1 mL的大肠杆菌液攻毒,所有攻毒蛋鸡均进行正常采食和饮水,临床表现如表3所示。用0.3 mL大肠杆菌液攻毒的蛋鸡临床症状同对照组的蛋鸡一致。以精神状态为评价指标,蛋鸡用0.3 mL、0.5 mL、0.7 mL和1 mL大肠杆菌液攻毒后,精神状态依次呈现正常、不活泼、沉郁和缩颈以及闭眼状态;以粪便状态为评价指标,蛋鸡用0.3 mL、0.5 mL、0.7 mL及1 mL的大肠杆菌溶液攻毒后,粪便状态依次呈现正常、稀薄/正常、稀便/稀便/变浓/正常及稀便/稀便/稀便/稀便;以呼吸道症状为评价指标,攻毒剂量0.3 mL、0.5 mL、0.7 mL及1 mL,呼吸道症状依次呈现正常、正常、轻微及明显;以羽毛状态为评价指标,攻毒剂量0.3 mL、0.5 mL、0.7 mL及1 mL,羽毛症状依次呈现正常、蓬松、蓬松及蓬松。可以选择1 mL攻毒剂量,既不影响饮水及采食,又可客观明显地评判临床表现。
?
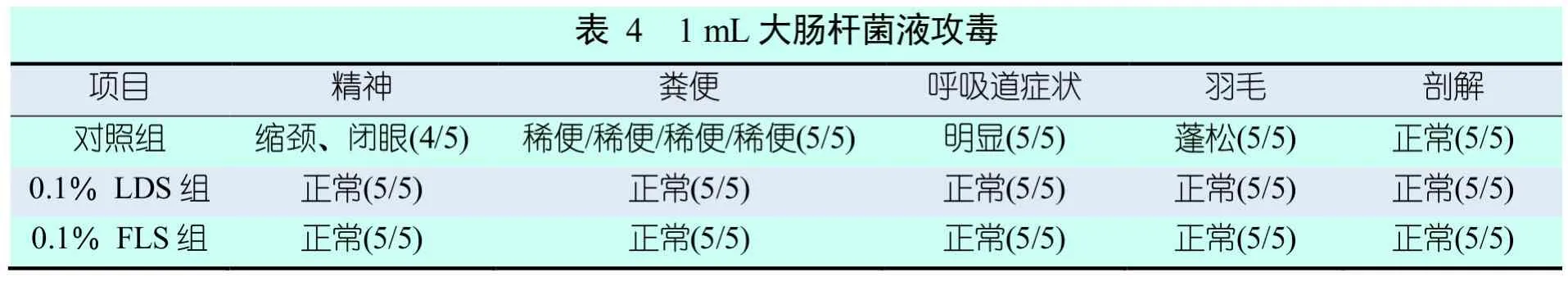
2.3.2 各试验组蛋鸡攻毒1 mL大肠杆菌后的临床表现
各试验组蛋鸡用1 mL大肠杆菌液攻毒后的临床症状见表4。供试蛋鸡注射1 mL大肠杆菌液后,两种酸化剂处理的供试鸡的精神状态、粪便、呼吸道症状及羽毛五项指标以及采食和饮水均正常;解剖试验组和对照组的蛋鸡发现内脏器官均无任何异常变化。从临床表现及剖解状况可以说明,前期饲养添加饮水型酸化剂可以增强蛋鸡机体的免疫力,增强抵抗大肠杆菌的侵染能力。
2.4 肠道腔内pH
不同酸化剂对蛋鸡肠道腔内pH的影响见表5。对照组蛋鸡空肠腔内pH在6.14左右;FLS组蛋鸡肠道腔内的pH不稳定,低于对照组蛋鸡的,但无统计学意义上的显著差异(P>0.05);LDS组蛋鸡肠道腔内的pH基本稳定在5.98,低于对照组蛋鸡的,与对照组蛋鸡相比存在统计学意义上的显著差异(P<0.05)。酸化剂能调节蛋鸡肠道腔内的pH,有益于肠道微生物生长。
?

?
2.5 肠道微生物
不同酸化剂对蛋鸡肠道菌落数的影响见表6。从表6可看出,在蛋鸡肠道中乳酸菌的数量上,实验组和对照组的大小关系依次为:C0.1%LDS>C0.1%FLS>C对照,其中,0.1%LDS可显著(P<0.05)提高蛋鸡肠道腔内有益乳酸菌的数量,而0.1%FLS对蛋鸡肠道腔内有益乳酸菌的数量呈增长趋势,且增长幅度大于其他试验组蛋鸡的。这说明酸化剂有益于蛋鸡肠道有益菌群的生长,两者都能起到调节蛋鸡肠道微生物作用。

?
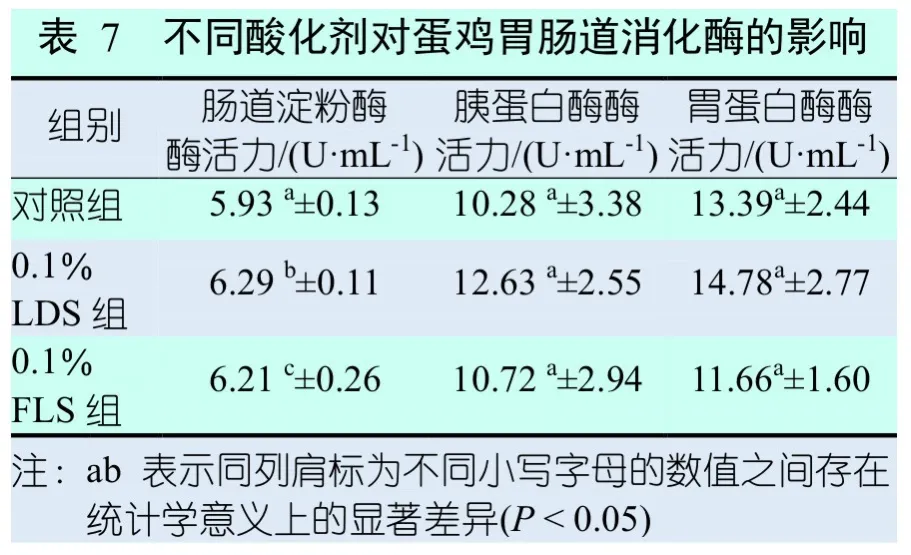
2.6 不同酸化剂对蛋鸡胃肠道消化酶的影响
不同酸化剂对蛋鸡胃肠道消化酶的影响见 表7。从表7可知,除胃蛋白酶外,两种酸化剂对蛋鸡肠道淀粉酶和胰蛋白酶的酶活力均有增益作用,其中肠道淀粉酶酶活力和胰蛋白酶酶活力的大小关系:U0.1%LDS>U0.1%FLS>U对照;试验组中蛋鸡胃蛋白酶酶活力大小关系为U0.1%LDS>U对照>U0.1%FLS,且两种酸化剂对淀粉酶酶活力的影响差异显著(P<0.05),对胰蛋白酶酶活力及胃蛋白酶酶活力无显著性影响(P>0.05)。
?
3 讨论
本试验结果所体现的有机酸效应与之前的相关报道一致,有机酸影响了微生物细胞膜或细胞大分子的完整性,或者有助于杀菌效果的养分运输和能量代谢[4]。在饮水中添加两种不同酸化剂对家禽的影响有一定的差异,本研究结果与Owens等[5]的研究结果类似。Pirgozliev等[6]发现,由于添加有机酸,肉鸡回肠和盲肠中的大肠杆菌数显著减少,与本试验对蛋鸡肠道微生物中乳酸菌及大肠杆菌的追踪结果基本一致。有机酸混合物的使用显著降低了肉鸡肠道中细菌总数和革兰氏阴性菌的数量[7],且使用酸化剂处理的家禽可以将症状和死亡率降至最低,减少饮水酸化引起的微生物脱落和定植,这可能是不同酸化剂抗菌作用的结果,也对胃肠道上皮细胞产生有利作用[8-9]。本试验的两种饮水用酸化剂使蛋鸡在攻毒后的临床症状上表现正常,同时解剖时的病理学检测也正常,这在一定程度上反映了在前期饲养期间饲喂饮水型酸化剂可以提高蛋鸡的抗大肠杆菌侵染能力,增强机体的免疫力。相关研究表明复合酸化剂可降低蛋鸡嗉囊、腺胃、肌胃、小肠和大肠腔内的pH,提高胰蛋白酶、胃蛋白酶和淀粉酶的酶活力[10-12],本试验在各消化酶的活力验证指标上,除胃蛋白酶酶活力U0.1%FLS低于对照组的外,其余均符合这一规律。
4 结论
0.1%饮水型酸化剂可抑制饮水中的大肠杆菌,且可以通过调节蛋鸡肠道腔内的pH,改善消化酶活性及肠道微生物菌群组成,激活酶活,提高消化;通过肛门攻毒成功发病但未死亡,又可避开胃酸的影响,提供了一种细菌攻毒的新方法,为制造动物细菌发病模型开启新思路和建立细菌发病动物模型提供了有力的证据,也有效补充了体外试验,值得临床试验推广;此外,用饮水型酸化剂处理的蛋鸡攻毒后临床及剖解均表现正常,证明此方式可以有效增强机体的免疫力;理论上,饮水酸化程度越高,效果越好,需要进一步的研究来评估家禽对水酸化的耐受程度以及饮水中酸化剂的持续或中断供给是否有更好的效果。

