大动脉炎患者外周血Th17/Treg细胞及相关细胞因子的表达
贾 雯 王 霞 柏欢欢 张文琦 谢戬芳
大动脉炎(takayasu arteritis,TA)是一种罕见的慢性系统性血管炎,主要累及主动脉及其一级分支。大动脉管壁的炎症发生是TA的病理基础,血管壁全层被炎性细胞浸润是主要病理表现,多种炎性细胞和炎性因子参与了TA的发生、发展[1]。当机体受到感染、异常代谢产物等致病因素时,树突状细胞(dendritic cells,Dcs)被激活分化为不同的辅助性T细胞(T helper cells,Ths)参与TA发病[2]。Th17细胞是促炎细胞,Treg细胞是抑炎细胞,正常情况下Th17/Treg处于动态平衡。近年来多项研究表明,Th17/Treg比例失衡在自身免疫性疾病发病中发挥重要作用[3~5]。本研究通过检测大动脉炎患者外周血Th17、Treg细胞及相关细胞因子的表达,探讨其与疾病活动的关系。
对象与方法
1.研究对象:收集2016年3月~2019年5月于笔者医院就诊TA患者46例,患者年龄14~64岁,平均年龄35.45±11.02岁,男女性别之比为1∶4.8,病程0.08~35.83年,平均病程6.15±9.14年。符合美国风湿病学会1990年TA诊断标准[6]。同时收集43例来笔者医院健康体检者为健康对照组,年龄18~58岁,平均年龄43.30±10.77岁,男女性别之比为1∶7.6。病例组和对照组的年龄、性别等一般资料比较,差异无统计学意义(P>0.05)。
2.研究方法:记录研究对象一般资料,收集发病症状、各项实验室检查资料,包括血小板(PLT)、补体(C)、血沉(ESR)、C反应蛋白(CRP)等,采用流式细胞仪技术(FCM)检测正常人和患者外周血Th17细胞、Treg细胞表达水平;采用流式液相多重蛋白定量技术(CBA)患者外周血IL-6、IL-10、IL-17及TNF-α的浓度。检测依据美国卫生研究所NIH的标准判断TA活动性[7];根据NIS评分,≥2分定义为疾病活动组,<2分定义为非活动组。
3.主要设备及试剂:采用美国BD公司提供的FACS Calibur 流式细胞仪。Th17细胞和Treg细胞检测使用试剂离子霉素、胎牛血清、1640液、高尔基阻断剂、刺激素PMA购自美国Sigma公司。单克隆抗体IL-17-PE、CD4-FITC、CD25-APC、FOXP3-PE购自美国BD公司。IL-6、IL-10、IL-17及TNF-α检测使用试剂人Th1/Th2/Th17亚群试剂盒购自江西赛基生物技术有限公司。
4.Th17、Treg细胞检测:抽取入选受试者外周血,采用流式细胞术检测外周血Th17细胞和Treg细胞。(1)Th17细胞培养与标记:取80μl抗凝血分别加入刺激剂10μl PMA工作液、10μl Ionomycin工作液和1μl GolgiStop,37℃恒温箱中培养5h。将其置于流式专用试管中,加入抗人CD4-FITC,室温避光孵育30min后,加入新鲜配置的Fixation/Permeabilization液1ml涡旋混匀,4℃避光孵育30min后,加入抗人IL-17-PE,室温避光孵育30min后,PBS洗涤,上机检测。(2)Treg细胞标记:取80μl抗凝血加入CD4-FITC和CD25-APC,室温避光孵育30min后,各管分别加入新鲜配置的Fixation/Permeabilization液1ml涡旋混匀,4℃避光孵育30min后,加入抗人FOXP3抗体,室温避光孵育30min后,PBS洗涤后,上机检测。(3)流式细胞仪测定:24h内上流式细胞仪(Calibur, 美国BD公司)测定分析结果。根据前向角散射光(FSC)对侧向角散色光(SSC)的散点图对淋巴细胞设门区分淋巴细胞,以CD4对SSC设门区分Th细胞(CD4+),取门内10000个细胞,以CellQuest软件获取、分析相对百分数。(4)计算各促炎淋巴细胞之比。利用促炎淋巴细胞绝对计数之比算出Th17/Treg的比值。
5.细胞因子检测:抽取入选患者外周血,采用CBA术检测IL-6、IL-10、IL-17及TNF-α的浓度。(1)采血后分离血清于-70℃保存备用。标准曲线制备:用反应稀释液将待测细胞因子标准品按照梯度法稀释为5000、2500、1250、625、312、156、80、40、20、10、5和0pg/ml共12个质量浓度。(2)混合微球制备:按每个测试每种微球1μl的量吸取捕获微球混匀,成为混合捕获微球,加0.5ml洗液以200g×5min离心,去上清,用血清捕获微球稀释重悬微球,并使终体积达50μl。按每个测试每种微球1μl的量混合PE标记的抗体,稀释至终体积达50μl。取待测血清和标准品50μl置于上样管,加入50μl混合捕获微球,室温避光孵育2h,离心,去上清,重悬,上机检测。(3)以Bio-Plex 200阅读器获取细胞因子数据,以BioPlex Manager软件测量荧光强度(MFI)和浓度(pg/ml)。
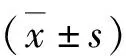
结 果
1.TA患者人口学信息、临床症状及辅助检查比较:TA活动组补体C3、补体C4、CRP、ESR、NIS评分均高于非活动组,差异有统计学意义(P<0.05)。TA活动组和非活动组的人口学信息、临床症状比较,差异无统计学意义(P>0.05,表1)。

表1 TA患者人口学信息、临床症状及辅助检查
2.TA活动组、TA非活动组及健康对照组外周血Th17细胞、Treg细胞及Th17/Treg表达水平的比较:TA活动组、TA非活动组Th17细胞绝对计数与相对计数明显高于健康对照组,差异有统计学意义(P<0.05);TA活动组Th17细胞绝对计数与相对计数高于非活动组,差异无统计学意义(P>0.05)。TA活动组、TA非活动组Treg细胞绝对计数与相对计数明显低于健康对照组,差异有统计学意义(P<0.05);TA活动组Treg细胞绝对计数与相对计数低于非活动组,差异无统计学意义(P>0.05)。TA活动组、TA非活动组Th17/Treg明显高于健康对照组,差异有统计学意义(P<0.05);TA活动组Th17/Treg高于非活动组,差异无统计学意义(P>0.05,表2)。
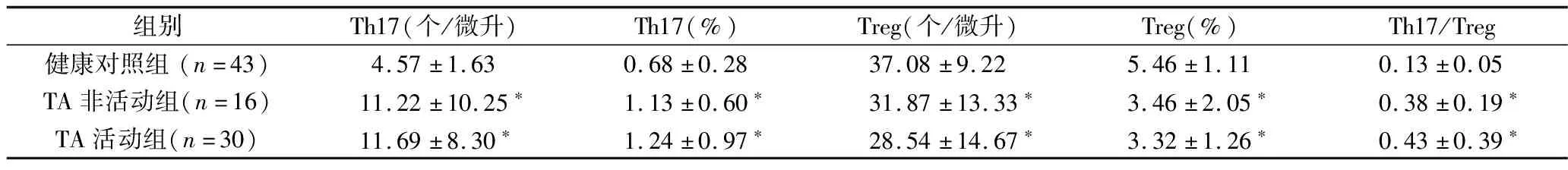
表2 3组外周血Th17、Treg细胞及Th17/Treg表达比较
3.TA活动组与非活动组患者细胞因子表达水平的比较:TA活动组IL-6、IL-17及TNF-α表达较非活动组明显增多,差异有统计学意义(P<0.05);TA活动组IL-10表达较非活动组显著减少,差异有统计学意义(P<0.05,图1)。

图1 TA患者血清细胞因子表达水平
4.细胞因子预测TA活动ROC曲线结果:以NIS评分为金标准,IL-6预测TA活动的AUC为0.806,最佳截断点为10.125pg/ml,其敏感度为81.48%,特异性为68.75%;IL-10预测TA活动的AUC为0.694,最佳截断点为8.490pg/ml,其敏感度为85.19%,特异性为56.25%;IL-17预测TA活动的AUC为0.704,最佳截断点为7.565pg/ml,其敏感度为66.67%,特异性为75.00%;TNF-α预测TA活动的AUC为0.767,最佳截断点为2.170pg/ml,其敏感度为81.5%,特异性为68.7%,详见图2。

图2 细胞因子的ROC分析结果
讨 论
大动脉炎是指累及主动脉及其主要分支的慢性非特异性炎症,可引起的不同部位动脉狭窄或闭塞,少数也可引起动脉扩张或动脉瘤,出现相应部位缺血表现[8,9]。其发病机制与遗传因素、内分泌异常、感染后机体发生免疫功能紊乱以及细胞因子的炎性反应有关[10]。
调节性T细胞(regulatory T cell,Treg细胞)是T细胞中的一类重要亚群,能够使机体保持免疫耐受功能从而抑制自身免疫病的发生。机体炎症发生后,树突状细胞和巨噬细胞等抗原提呈细胞被活化诱导Treg细胞到达炎症部位,通过分泌IL-10、TNF-α等抑制性细胞因子,下调自身反应性T细胞及炎性细胞因子表达,发挥免疫耐受从而维持机体自身免疫平衡。Th17细胞在自身免疫性疾病中主要发挥其致炎作用。Th17细胞及其相关细胞因子的过表达可趋向炎性细胞聚集于血管壁上,同时刺激成纤维细胞和巨噬细胞,诱导多种炎性细胞因子生成,造成炎症反复发生及内皮损伤从而导致动脉管壁增厚、血栓形成,严重者可发生狭窄及闭塞性病变[11]。
Th17细胞与Treg细胞在分化过程中密切相关,Th17细胞和Treg细胞在特定的细胞因子微环境下可以相互转化,机体在免疫稳定时,免疫系统产生的IL-10可抑制效应T细胞生成,促进Foxp3+Treg分化,维持自身免疫耐受;当机体存在炎性浸润,激活的免疫系统会产生IL-6、IL-17、TNF-α促进Th17细胞诱导炎性反应,同时抑制IL-10介导的Treg细胞生成。Th17/Treg平衡是机体自身免疫平衡的关键因素,促炎性Th17细胞和抑制性Treg细胞的比例失衡介导了多种血管炎症自身免疫病的发生、发展[12~14]。
本研究结果显示,TA患者外周血Th17细胞相对计数和绝对计数明显高于健康对照组,Th17/Treg比例高于健康对照组,Treg细胞相对计数及绝对计数低于健康对照组,且活动期患者Th17表达高于非活动期患者,Treg表达低于非活动期,其相应细胞因子也对应减少,推测TA发病与Th17细胞增多、Treg细胞减少所致Th17/Treg失衡相关。Misra等[15]研究发现,TA患者的Th17细胞相对计数较健康对照组有增加,以及Th17细胞所分泌的细胞因子IL-17A表达上调,这与笔者的研究结果相似。在TA患者体内,促炎性Th17细胞增多,抑制炎性Treg细胞减少,Th17/Treg比例失衡,从而导致疾病发生。
本研究结果还显示,活动期TA患者外周血IL-6、IL-17、TNF-α水平高于非活动期患者,IL-10水平低于非活动期患者。本研究进一步表明,IL-6、IL-10、IL-17和TNF-α预测TA活动的AUC分别为0.806、0.694、0.704和0.767,具有一定的预测价值。IL-6、IL-17是Th17细胞分泌的促炎因子,其中IL-6是可促进T细胞激活加重炎性反应,是Th17分化过程中重要起始因子,从而调节Th17细胞和Treg细胞之间的平衡[16]。Savioli等[17]研究发现,活动期TA患者IL-6表达高于缓解期,这与笔者的研究结果相同。目前IL-6表达拮抗剂治疗难治性大动脉炎已取得一定成效[18]。IL-17是强致炎因子,可以激活T细胞和刺激内皮细胞、上皮细胞以及成纤维细胞参与TA炎症,且IL-17与TNF-α具有协同作用,上调IL-6的表达,共同调节炎性反应[19]。活动期TA患者IL-6、IL-17表达增多,提示Th17分泌的炎性细胞因子参与了TA的发展过程。IL-10是一种典型的抗炎细胞因子,主要由巨噬细胞和Treg细胞产生,IL-10具有多种免疫调节和炎性作用,可传递负反馈信号,抑制激活的免疫系统,抑制巨噬细胞的活化从而减少T细胞产生的细胞因子。本研究结果显示,IL-10随着疾病活动表达降低,与Treg细胞表达水平变化一致。提示可通过调控IL-10水平变化,抑制炎性因子分泌缓解TA病情活动。
综上所述,Th17细胞表达上调、Treg 细胞表达下调、Th17/Treg 失衡参与了 TA的发生、发展过程。Th17、Treg 相关细胞因子IL-6、IL-10、IL-17和TNF-α在TA活动期表达异常,有望成为临床评估病情活动的重要标志物。本研究样本量较小且为回顾性研究,建议开展大样本队列研究进一步探讨 Th17/Treg 在活动期 TA发病过程中的作用。

