负载二甲双胍骨组织工程支架的制备及评价
戴桓琰 孙一丹 郑剑莹 费 凡 韩 冰
大段骨缺损的治疗一直是医学领域的研究难点,作为骨缺损修复的金标准,自体骨具有优越的骨诱导性能,但因手术创伤大、自体骨骨量有限,其在临床应用中仍有一定局限性,为此研究人员一直在寻找自体骨的替代品。组织工程支架骨可模拟骨细胞外基质微环境,是最具潜力及应用前景的新型骨修复材料[1]。聚乙烯醇(poly vinyl alcohol,PVA)是一种生物相容性良好的人工合成高分子材料,具有可调节的亲水性和较高的黏弹性,但由于缺乏细胞识别位点,PVA的细胞黏附性较差,因而常通过添加β-磷酸三钙(β-tricalcium phosphate,β-TCP)等生物活性颗粒来提高材料与骨键合的能力[2~4]。然而与自体骨比较,PVA/β-TCP复合支架的骨诱导能力有限,因此将成骨诱导性物质与支架材料结合是提高支架骨再生能力的关键[5]。
葡萄糖与骨代谢之间关系密切,二甲双胍(metformin,MET)作为治疗2型糖尿病的首选降糖药,可以降低糖尿病患者的骨折风险[6,7]。现有研究显示,二甲双胍可以诱导小鼠前成骨细胞(MC3T3-E1)、人绒毛膜间充质干细胞、诱导性多能干细胞成骨分化[8~10]。因此,本研究拟利用低温3D打印技术设计出一种负载二甲双胍的PVA/β-TCP功能支架,通过对支架进行一般性能表征、药物释放检测、体外细胞相容性检测,初步探讨其作为人工骨的潜能。
材料与方法
1.材料、主要试剂和仪器:β-TCP、PVA和二甲双胍(上海阿拉丁生化科技股份有限公司),H-DMEM培养基(美国Hyclone公司),胎牛血清(杭州四季青生物工程材料有限公司),CCK-8试剂盒(北京索莱宝科技有限公司)。3D打印机(中国科学院长春应用化学研究所),扫描电子显微镜(日本Hitachi公司),酶标仪(美国Thermo Fisher公司),荧光倒置显微镜(日本Olympus公司)。
2.支架的制备:将4g PVA加到46ml去离子水中,120℃水浴加热4h以制备8%质量分数的PVA溶液;待冷却后加入一定量的二甲双胍,超声分散并用玻璃棒搅拌20min,使药物颗粒均匀分布;称取与PVA等质量的β-TCP,过筛后与上述溶液混合,搅拌机继续搅拌1h至浆料均匀;打印机工作台为15~18℃,根据预设的打印程序进行支架的3D打印;将3D打印机支架置于通风橱干燥24h。根据上述步骤共制备两组支架:PT支架(PVA/β-TCP复合支架)、PTM支架(PVA/β-TCP/二甲双胍复合支架,二甲双胍载药量为占干燥后支架质量的1%)。各组支架经环氧乙烷灭菌备用。
3.支架表面形态观察:在干燥的支架表面喷金固定后,通过扫描电子显微镜观察支架表面微观结构。加速电压为3.0kV。
4.支架孔隙相关测量:使用Nano Measurer1.2对支架的显微镜下图片进行孔径测量;通过液体置换法对支架孔隙率进行测量。取干燥支架,称质量为Ws;将乙醇完全填充比重瓶,称质量为W1;将干燥支架浸入乙醇中,超声除气,待乙醇充分充满支架孔隙后,再向比重瓶中加满乙醇,称质量为W2;取出支架,称剩余乙醇和比重瓶质量为W3;当前室温下乙醇密度为ρe。孔隙率(Φ,%)=(W2-W3-Ws)/ρe/(W1-W3)/ρe×100%。
5.支架吸水率的测定:称重干燥支架质量为 W1,室温下将支架浸于去离子水中,24h后取出并用滤纸吸去材料表面的水分,称质量为W2。支架的吸水率(X,%)=(W2-W1)/W1×100%。
6.支架的药物缓释能力:取0.7g的PTM支架分别置于加入2ml中性PBS溶液的离心管中,离心管放于37℃,150r/min的恒温震荡箱中孵育;定期收集1ml PBS溶液并用新鲜PBS补足至原有体积,酶标仪检测233nm波长处待测液的吸光度。绘制标准曲线,按照二甲双胍标准品线性回归曲线的方程式,计算各待测液中二甲双胍含量,定量计算支架14天内药物总释放率。释放率(DR,%)=总药物释放量/支架中的总药物量×100%。
7.支架的细胞毒性测试:以0.1g/ml比例将灭菌支架浸于增殖培养基中并放入37℃,5% CO2敷箱,24h后收集支架浸提液,并于4℃密封储存。以1×104个/孔的细胞密度将MC3T3-E1接种至96孔培养板,使用增殖培养基培养24h,待细胞长满孔底95%以上,将培养介质更换为支架浸提液(PT支架、PTM支架)或新鲜增殖培养基(Ctrl),建立空白组,敷箱继续培养24h。按照CCK-8试剂盒说明,酶标仪检测450nm波长处待测液的吸光度(A)值。细胞生存率(CV,%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
8.支架的细胞黏附测试:将灭菌支架放置于24孔板中,以5×104个/孔的细胞密度将MC3T3-E1接种至支架表面,置入37℃,5% CO2恒温敷箱孵育。24h后,经4%多聚甲醛固定,使用DAPI溶液对支架上的细胞进行荧光染色。激发波长360~400nm,避光,在倒置荧光显微镜下观察细胞形态。
9.支架的细胞增殖测试:将灭菌支架放置于96孔板中,以2000个/孔的细胞密度将MC3T3-E1接种至支架表面,置入37℃,5% CO2恒温敷箱孵育。隔天换液。分别于培养1、3、5天时检测细胞的增殖活性。按照CCK-8试剂盒说明,酶标仪检测450nm波长处待测液的吸光度值。以A值间接比较细胞增殖程度。
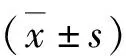
结 果
1.支架的宏观结构:3D打印的PTM支架呈白色的立方多孔结构, 支架的孔径规则且一致,具有相互连通的孔隙。通过3D打印技术可制备大小不等的支架,以针对不同需求(图1)。

图1 PTM支架
2.支架表面超微形态:通过扫描电镜观察,在放大40倍下,可见PT与PTM支架具有相互连通的孔隙结构,孔径大小均一;在放大500倍下,可见支架表面均具有微米级的孔隙结构,PTM支架表面粗糙程度略有增加;在放大5000倍下观察,PTM支架表面可见掺入的二甲双胍颗粒(图2)。

图2 两种支架扫描电镜照片
3.支架的孔径、孔隙率:PT、PTM支架的孔径分别为518.30±13.96mm和516.40±36.86mm,差异无统计学意义(P>0.05);PT、PTM支架的孔隙率分别为66.59%±0.87%和67.22%±1.30%,差异无统计学意义(P>0.05)。
4.支架的吸水率:PT支架的吸水率为35.00%±0.54%,PTM支架的吸水率为53.78%±0.73%,两组比较差异有统计学意义(P<0.05)。
5.二甲双胍的缓释结果:二甲双胍在前5天出现较快的释放,随后进入缓慢的释放阶段,至14天时释放率为74.03%±9.34%(图3)。

图3 14天内二甲双胍的体外释放曲线
6.支架的细胞毒性测试:两种支架的细胞生存率均大于90%,与阳性对照组(Ctrl组)比较没有明显的毒性效应,证明支架的毒性较小,不影响细胞的正常活动(图4)。

图4 两种支架的细胞毒性
7.支架的细胞黏附测试:细胞在支架上培养24h后,两种支架均表现出良好的细胞附着力和扩散力。与PT比较,PTM上的细胞铺展面积更大,由圆形变为板状平铺结构(图5)。

图5 两种支架细胞黏附的免疫荧光染色图
8.支架的细胞增殖测试:随着时间的增加,细胞在支架上的增殖活性随之增长。在1~3天,两种支架的增殖活性差异无统计学意义(P>0.05);当培养5天时,PTM支架上细胞的增殖活性明显增加,与PT支架比较,差异有统计学意义(P<0.05,图6)。

图6 两种支架的细胞增殖活性
讨 论
骨组织具有一定的自我修复能力,经过复杂的骨改建与重塑过程后可愈合而不留瘢痕;但当缺损达到临界范围时,骨失去再生能力,可导致炎症、骨不连和畸形等,严重降低了患者的生存质量[11]。临界骨缺损无法自我修复的原因为:①间充质干细胞向缺损部位迁移不足;②骨祖细胞数量不足;③骨祖细胞无法完全分化为成骨细胞[12]。二甲双胍作为抗高血糖的小分子药物,可激活AMP激活蛋白激酶信号通路,并上调骨祖细胞中核结合因子α1和脂蛋白相关蛋白5的表达,诱导向其成骨细胞方向分化[13]。为避免小分子药物在体液环境中突释,对组织产生细胞毒作用,选择合适的递送系统可保证其稳定、持续的释放[14]。PVA作为亲水的高分子材料,已用于携带和维持生物活性分子的释放,β-TCP因具有优于HA的骨传导性和降解性,在骨再生领域亦得到广泛应用[15,16]。
新兴的3D打印技术克服了传统制造技术的局限性,可设计出满足临床个性化需求的人工骨。本实验选用低温3D打印的PVA/β-TCP复合支架作为递送二甲双胍的骨传导载体,既可保证支架结构的精确性,亦可避免打印过程中的高温环境影响药物的生物活性,使其始终保持诱导新生组织的性能,进而保证PTM复合支架可实现药物控缓释的作用效果。相较之下,Chen等[3]采用熔融沉积成型技术制备支架,打印过程中175℃的高温会破坏骨诱导活性因子的生物活性。
支架结构是影响支架成骨活性的重要因素。在本实验中,二甲双胍的掺入对支架的三维多孔结构影响很小,PTM支架的孔径均一、形态规则且连通性良好,500μm的大孔有利于引导新生骨、血管向支架内部生长[17]。两种支架的孔隙率全部高于60%,满足人体松质的要求,为细胞迁移和营养物质运输提供了良好的组织结构[18]。
理想的骨组织工程支架微环境应促进周围组织的成骨矿化和血管生成。本实验通过向PVA溶液中掺入二甲双胍颗粒,使其均匀分布于所有的PTM支架中。结合扫描电镜进一步观察,支架表面可见微米级孔隙,裸露的二甲双胍颗粒无疑增加了支架表面的粗糙度。目前研究认为,微米级粗糙度有利于促进成骨细胞合成并分泌前列腺素E2和转化生长因子-β1,以创造利于成骨的微环境,也可为细胞黏附提供锚固点[19]。润湿性是细胞黏附与增殖的关键因素之一,与疏水性材料比较,亲水性材料具有更强的细胞亲和力[20]。PTM支架的吸水率较PT支架的明显提高,这表明支架中掺入的二甲双胍发挥了良好的亲水作用。良好的生物相容性是支架成骨的关键。支架细胞毒性检测显示,PTM支架的细胞生存率>90%,毒性不良反应很小,掺入的二甲双胍不影响细胞的正常活动。通过DAPI荧光染色观察也可进一步证实支架良好的细胞附着力和扩散力。
根据二甲双胍的缓释结果分析,PTM支架表面裸露的二甲双胍最先溶解,在前期经过一个快速释放阶段后,从第5天开始,随着PVA与β-TCP逐渐降解,包埋在支架内部的二甲双胍得以缓慢释放,至14天时药物累积释放约74%。这些结果表明,PTM支架可以达到持续缓慢释放二甲双胍的效果,这可对骨祖细胞提供一个长时间的刺激,从而加速成骨和成血管过程[21]。结果显示,将细胞与支架共培养1、3、5天,细胞的增殖活性逐步提高,尤其是第5天时,PTM支架的细胞增殖明显高于PT支架。
综上所述,通过低温3D打印制备的PTM支架具有互连良好的三维多孔结构和优良的生物相容性,二甲双胍的掺入提高了支架表面粗糙度和亲水性,为细胞黏附提供了锚固点,细胞在支架上黏附良好,随着药物的逐步缓释,提高了细胞的增殖能力。支架体内成骨的研究正在进行中,此研究在骨再生领域具有广阔的前景。

