RNAi沉默HPC2对鼻咽癌细胞迁移侵袭的影响及分子机制
吴 梅 丁 伟 唐 亮
鼻咽癌(nasopharyngeal carcinoma, NPC)是起源于鼻咽上皮的头颈部常见恶性肿瘤,东南亚和我国南部的珠江三角洲地带是高发区[1]。生活习惯、遗传和病毒感染被认为是3个重要的发病因素[2]。鼻咽癌具有易转移的生物学特性,包括区域淋巴结及远处转移,是患者死亡的主要原因,也是临床治疗的热点、难点问题[3]。筛选出鼻咽癌转移的驱动基因,针对性靶向干预是攻破转移的重要思路。
多梳基因蛋白家族(polycomb group of protein,PcG)与器官发育,细胞的增殖及分化调控,肿瘤的发生、发展有关[4]。其中人多梳蛋白2(human polycom 2,HPC2)又称为染色盒同源物4(chromobox homolog 4, CBX4)是PcG家族核心成员之一,常与RING1等其他PcG蛋白形成复合体,抑制homeotic基因,维持重要的生理功能[5]。据相关研究显示,HPC2与多种肿瘤预后相关,笔者课题组前期研究发现,HPC2表达是影响NPC放疗预后的独立危险因素。然而HPC2在鼻咽癌中的生物学功能尚不清楚,本研究旨在初步探讨HPC2在鼻咽癌细胞迁移侵袭中的作用和分子机制。
对象与方法
1.对象:人鼻咽癌细胞株5-8F由江西省委肿瘤转移与精准治疗重点实验室馈赠。RPMI1640、Optimum培养基和 RNAi Max 均购自美国Invitrogen公司。阴性对照 siRNA 及 HHPC2 靶序列siRNA 购自广州锐博生物公司,#1siRNA 序列(正义链)5′-AGAUGAAGAUAGUCAAGAA-3′,(反义链)5′-UUCUUGACUAUCUUCAUCU-3′;#2siRNA序列(正义链)5′-AGUACGAGCUCAACAGCAA-3′,(反义链)5′-UUGCUGUUGAGCUCGUACU-3′;scrambled 为无干扰功能对照序列。
2.细胞培养及转染:从液氮复苏的5-8F细胞,接种于10%胎牛血清的RPMI1640培养液,置于5%CO2、37℃的恒温箱培养。先将处于对数生长期的细胞,接种于含10%胎牛血清RPMI1640培养基的6孔板,使细胞在转染日能够达到约60%融合度。采用RNAi max进行细胞瞬时转染,将实验分为转染无功能scrambled 序列的对照组和两个特异性靶向HPC2的转染组(#1siRNA和#2siRNA组)。于6孔板的每孔加入Optimum无血清培养基1.5ml,各孔用EP管配制如下转染混合体系,A管:Optimum 250μl + RNAimax 5μl,轻柔混匀孵育5min;B管:Optimum 250μl +siRNA 5μl,轻柔混匀孵育5min,A加入到B管中,混匀后室温孵育20min。缓慢滴加入相应孔中,6孔板轻微晃动摇匀。转入5%CO2、37℃孵育箱,6h后换液,加入10%胎牛血清的DMEM培养基继续培养,24~48h 后用于后续实验。
3.PCR及Western blot 法检测HPC2的siRNA干扰效率:简要步骤如下,TRIzol法提取细胞系总RNA,紫外分光光度计检测RNA的纯度和浓度,反转录酶合成cDNA。引物均购自中美泰和生物公司。HPC2引物:Forward 5′-GCAGAGTGGAGTATCTGGTGA-3′,Reverse 5′-AGCTTGGCACGGTTGTCAG-3′;GAPDH引物:Forward 5′-GGAGCGAGATCCCTCCAAAAT-3′,Reverse 5′-GGCTGTTGTCATACTTCTCATGG-3′。先行RT-PCR,总反应体系50μl,95℃,预变性15min,95℃变性15s,55℃退火30s,72℃延伸30s,共40个循环。取扩增产物10μl,上样缓冲液2μl,在2%琼脂糖凝胶上电泳,65V,30min,凝胶成像系统拍照电泳结果。SYBR®Green mix(TaKaRa生物公司)进行qRT-PCR检测,反应的条件同前,扩增产物用2-ΔΔCt法计算,与内参基因GAPDH校准得到检测样本的相对表达水平。
4.蛋白免疫印迹(Western blot)法:检测转染 siRNA-HPC2 后的5-8F 细胞的HPC2及EMT关键蛋白表达,简述如下:RIPA 裂解液提取细胞总蛋白,BCA 法测定蛋白含量,试剂盒购自南京凯基生物科技发展有限公司(Cat.no,23227);配平后用4×的上样缓冲液煮蛋白,按照每孔30μg上样,经10% SDS-PAGE电泳,将胶上蛋白电转至PVDF膜,用5%脱脂奶粉室温封闭1h,PBST洗膜,配一抗:HPC2(Cat.no,A302-355A;Bethly,1∶1000),Snail(Cat.no,#3879;CST,1∶1000),E-cadherin(Cat.no,#3195;CST,1∶1000),MMP9(Cat.no,#3852;CST,1∶1000)和内参β-actin(Cat.no,AP0060;Bioworld,1∶2000),加至孵育盒的膜上,4℃ 孵育过夜,PBST洗膜,加 1∶10000稀释的二抗室温孵育1h,摇床洗膜,ECL(Cat no.P0018F,上海碧云天生物技术有限公司)化学发光后显影,用Image lab软件采集图像,β-actin为内参,实验重复3次。
5.细胞划痕实验:取对数生长期5-8F细胞,调整细胞浓度为5×105/个,铺6孔板,每孔均匀铺80%,用一次性20μl无菌移液吸头匀速用力划痕,用PBS洗去划落的细胞,加入10%胎牛血清的1640培养液,每间隔6h拍照,镜下测量各组细胞迁移距离,愈合率%=(0h划痕距离-各测量时点划痕距离)/0h划痕距离。
6.细胞侵袭实验:在有Matrigel胶的Transwell 小室中加入50μl 无血清培养基,置于37℃培养箱中30 min,用于水化基膜,取消化后重悬的对照组和转染组细胞,调整细胞浓度为3×104个/孔接种到上室中,在下室中加入500μl 10%胎牛血清的培养基,放入37℃、5%CO2培养箱中培养24h后,取出Transwell小室,用PBS洗两遍,甲醇固定下室20min,再用PBS洗2遍,1%结晶紫染色10min,缓慢流水中漂洗1min,晾干,高倍光镜下统计穿过Matrigel胶的细胞数目。
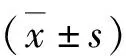
结 果
1.siRNA转染后鼻咽癌细胞HPC2的mRNA及蛋白表达:5-8F细胞转染siRNA后HPC2的mRNA丰度明显降低(图1A)。qRT-PCR检测结果提示,对照组HPC2的mRNA相对表达量为0.93±0.06,#1 siRNA组表达量为0.20±0.05,#2 siRNA组表达量为0.18±0.04。转染组的mRNA表达量较对照组降低,差异有统计学意义(P<0.01,图1B)。HPC2的蛋白水平也明显降低(图1C)。
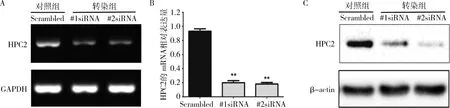
图1 在鼻咽癌5-8F细胞转染靶向HPC2的siRNA后HPC2的mRNA和蛋白水平检测
2.HPC2沉默后对鼻咽癌细胞划痕愈合的影响:用平板划痕实验比较HPC2沉默后细胞迁移愈合能力的变化。对照组6、12、24h的愈合率分别为30.43%±1.83%、64.75%±3.36%、97.32%±2.54%;#1 siRNA组6、12、24h的愈合率分别为22.43%±2.57%、48.75%±2.76%、75.46%±2.28%;#2 siRNA组6、12、24h的愈合率分别为18.65%±3.07%、37.51%±2.12%、68.72%±2.62%。在6、12、24h时间点,与对照组比较,沉默组的划痕愈合率降低,差异有统计学意义(P<0.05,图2)。

图2 沉默HPC2基因对5-8F细胞划痕愈合能力的影响
3.沉默HPC2后对鼻咽癌细胞侵袭能力的影响:用Transwell小室检测比较5-8F细胞侵袭能力,72h后光镜下观察发现,对照组穿膜细胞数为320±32,#1siRNA-HPC2转染组细胞数为190±28,#2siRNA-HPC2转染组细胞数为138±21。与对照组比较,siRNA-HPC2沉默组的细胞穿膜数减少,侵袭性下降,差异有统计学意义(P<0.05,图3)。
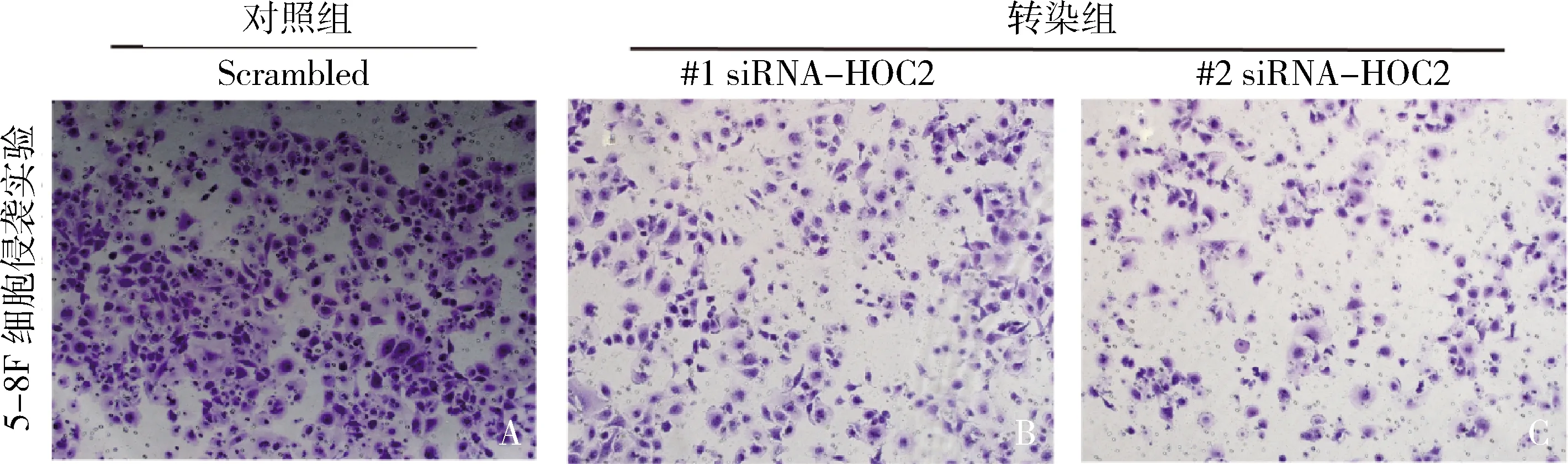
图3 沉默HPC2后对鼻咽癌细胞侵袭能力的影响(结晶紫,×100)
4.靶向沉默HPC2后对EMT信号通路的影响:转染HPC2对5-8F细胞中EMT关键分子Snail、E-cadherin及MMp9表达的影响。Western blot法检测结果显示,与对照组比较,两个siRNA-HPC2转染组的转录因子Snail下调,上皮标志物E-cadherin表达上调,转移标志物MMP9下调,提示HPC2沉默后5-8F细胞的EMT信号通路抑制,转移活性下降。
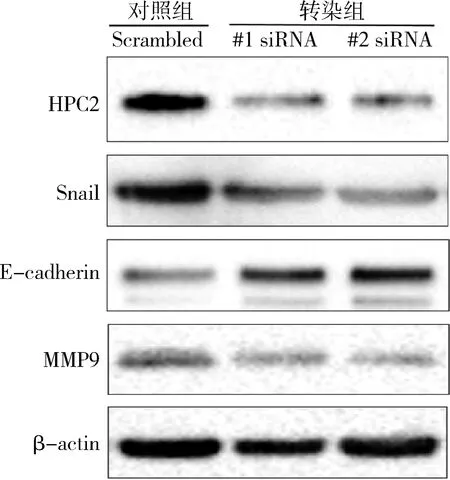
图4 HPC2靶向沉默后EMT通路关键分子Snail、E-cadherin、MMP9的变化
讨 论
骨、肺、肝脏是鼻咽癌(NPC)最常见转移部位。骨转移以骨盆、脊柱、四肢骨常见。约25%的T4或N3期的患者发生远处转移[6]。EBV介导的NPC转移及调控机制是目前研究的热点[7~9]。NPC的5-8F细胞株是持续感染EB病毒的SUNE1细胞株的亚株,具有高转移特性[10]。因此,5-8F是关于鼻咽癌转移研究的理想细胞模型。
1997年Otte等首次发现HPC2基因,定位于17号染色体长臂的25.3位置,由560个氨基酸残基组成,相对分子质量约61kDa。HPC2是一种低分子泛素修饰物,称为泛素连接酶SUMO E3,它包含如下3个功能结构域:①氨基端染色质区域介导Pc蛋白与染色质结合;②位于羧基端的COOH盒,可以与RING1和核小体颗粒结合介导转录抑制;③位于羧基端与伴侣分子CtBP特异结合的6氨基酸基序[11]。CBX4的SUMO化作用可以介导蛋白质的亚细胞定位,也可以调节转录因子的活性,参与肿瘤的发生、发展[12]。HPC2的转录本在人体正常组织中差别不大,但在不同肿瘤细胞株中存在较大差异,HPC2在骨肉瘤细胞、肠癌细胞表达量高,在Burkitt淋巴瘤中表达量却很低[13]。本课题组前期研究发现,HPC2在鼻咽癌组织及5-8F细胞株有较高表达。
据相关研究报道,CBX4在不同肿瘤中的作用并不一致。在结直肠癌中,CBX4募集HDAC3到RUNX2启动子抑制其转录,从而抑制结直肠癌转移[14]。研究显示,CBX4的癌基因样促转移作用,在肾透明细胞癌中,CBX4与HDAC1作用抑制KLF6抑癌基因启动子活性,促进肿瘤生长转移;在骨肉瘤中CBX4上调RUNX2促进其转移,靶向CK1α/CBX4有望使伴有转移的骨肉瘤患者获益;通过Notch1信号通路增强乳腺癌侵袭性;促进肝细胞癌高转移株MHCC97L的迁移与肺转移;调控BMI1促进肺癌增殖进展和转移[15~19]。本研究发现沉默HPC2后,鼻咽癌细胞侵袭迁移能力降低,提示HPC2在NPC中可能具有促转移作用。EMT通路是调控肿瘤转移的经典下游信号通路,肿瘤驱动基因介导EMT通路是促进鼻咽癌转移的重要途径。Dong等[20]研究显示,下调MLKL通过抑制EMT有效抑制鼻咽癌的侵袭转移。本研究发现沉默HPC2表达,snail下调,上皮标志物上调,转移标志物MMP9下调,提示HPC2可能通过Snail/Ecadherin/MMP9通路介导NPC 转移,具体的相互作用机制有待于进一步研究。
综上所述,本研究显示在鼻咽癌5-8F细胞沉默HPC2表达,可抑制鼻咽癌细胞的迁移及侵袭能力,实验结果还需深入开展动物实验研究。以上证据支持HPC2可能作为治疗鼻咽癌转移的新分子靶点。

