高温胁迫对黑木耳菌丝保护酶活性的影响
马银鹏 孔祥辉 韩增华 马庆芳 戴肖东 刘佳宁 张介驰 张丕奇
(黑龙江省科学院微生物研究所,黑龙江哈尔滨150010)
黑木耳(Auricularia heimuer)[1]营养丰富,具有药用价值,是一种珍贵的食药用菌[2]。东北地区由于其独特的冷凉气候特点,黑木耳色黑、肉厚、品质佳,受到消费者青睐[3]。目前,黑木耳栽培以全光地摆栽培模式为主[4],环境的可控性差,整个生长发育期间时常受到极端非生物胁迫影响。
温度、光照、湿度等环境因子均会影响食用菌菌丝体的正常生长,从而影响食用菌的产量和品质[5]。温度是影响食用菌生长发育最活跃、最重要的因素[6]。高温是导致食用菌产量降低和品质下降的重要非生物胁迫因子之一,生物体对高温胁迫的耐受性是其赖以生存和正常发育的重要特性[7-8]。
高温胁迫下,氧化应激反应引起活性氧(ROS)增加,ROS 氧化生物膜,形成脂质过氧化产物,损伤细胞[9]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等是重要的细胞保护酶系统,抗氧化酶作用尤为突出[10]。刘秀明等[11]对肺形侧耳高温胁迫生理的研究表明,高温胁迫导致菌丝内ROS 显著增加,抗氧化酶类活性均升高。郭敬等[12]研究发现高温(35 ℃)和低温(4 ℃)胁迫下白玉菇、杏鲍菇、真姬菇三种食用菌菌丝酶活性的动态变化规律各有差异。黑木耳胞外酶活性研究已有报道,王玉江等[13]研究了黑木耳栽培过程中胞外酶活性变化;李红等[14]研究了黑木耳栽培过程中抗霉能力及胞外酶活性变化。但是对于黑木耳高温胁迫条件下黑木耳酶活性变化研究报道较少。
为些,笔者研究高温胁迫对黑木耳菌丝体POD、SOD、CAT 保护酶活性和MDA 含量的影响,以探讨黑木耳菌丝体对高温的生理反应,为耐高温黑木耳菌株筛选奠定基础。
1 材料与方法
1.1 试验材料
黑木耳菌株为DH2、10 号。DH2 菌株菌丝体较耐高温,44 ℃热激4 h后仍能恢复生长;10号菌株菌丝体不耐高温,44 ℃热激4 h 后不能恢复生长。黑木耳菌株保藏于黑龙江省科学院微生物研究所菌种保藏中心。
1.2 菌丝培养
黑木耳菌株在培养皿中活化,活化后用1 cm 打孔器打孔,取接种块接种于加铺玻璃纸的PDA 平板上,28 ℃避光培养5 d、7 d 时分别收集菌丝体,培养7 d 时转移到44 ℃培养箱中热激4 h 后收集菌丝体,然后转移到28 ℃培养箱中恢复培养3 d、5 d 后分别收集菌丝体。菌丝体分别收集于1.5 mL 离心管中,液氮速冻后于-70 ℃下保存。
1.3 酶活性测定
POD、SOD、CAT 活性及 MDA 含量均采用试剂盒测定,具体操作步骤按照试剂盒说明书。试剂盒购自苏州格锐思生物科技有限公司。
1.4 数据统计分析
采用SPSS 16 软件进行数据分析,采用单因素方差分析方法进行显著性分析。
2 结果与分析
2.1 高温胁迫对供试黑木耳菌株菌丝体POD 活性影响
由图1可知,DH2菌株菌丝培养5 d、7 d,POD活性变化不明显。菌丝44 ℃热激4 h 后,POD 活性呈先升高后降低趋势。高温胁迫后菌丝体POD 活性与培养7 d 时酶活性相比差异不显著(P>0.05)。但是菌丝体恢复3 d(培养10 d)时,POD 活性显著升高,与热激前酶活性相比差异显著(P<0.05);菌丝体恢复5 d(培养12 d)时,POD活性下降。
10号菌株菌丝培养5 d、7 d时,POD活性变化不明显。菌丝44 ℃热激4 h 后,POD 活性呈先升高后降低趋势。高温胁迫后菌丝体POD 活性与培养7 d时酶活性相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养 10 d)、5 d(培养 12 d)时,POD 活性逐渐下降。
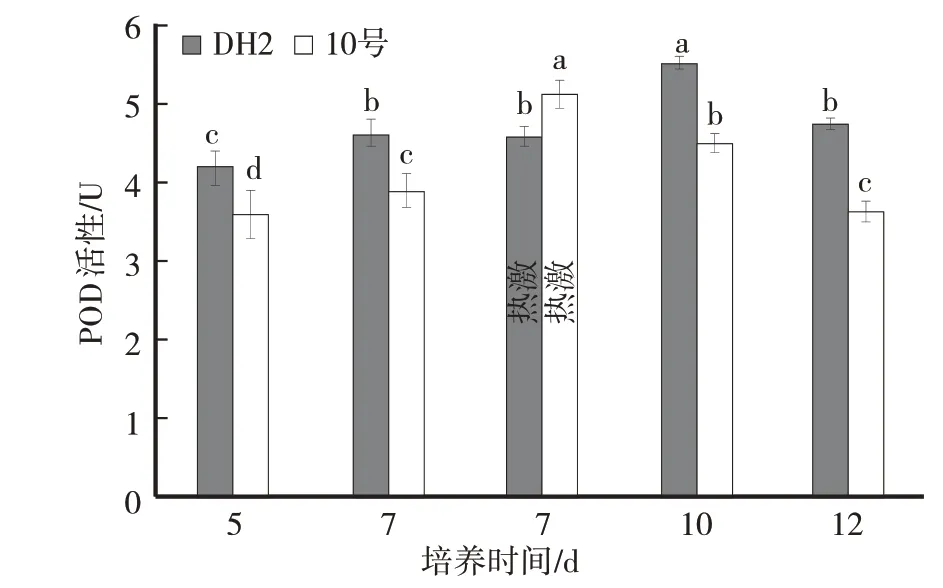
图1 高温胁迫对供试黑木耳菌株菌丝体POD活性影响
2.2 高温胁迫对供试黑木耳菌株菌丝体SOD 活性影响
由图2可知,DH2菌株菌丝培养5 d、7 d时,SOD活性变化不明显。菌丝44 ℃热激4 h 后,SOD 活性显著升高,菌丝体恢复时SOD 活性降低。高温胁迫后菌丝体SOD 活性与培养7 d 时酶活性相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养10 d)、5 d(培养12 d)时,SOD活性下降至高温胁迫前水平。
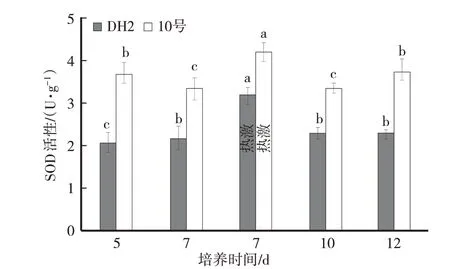
图2 高温胁迫对供试黑木耳菌株菌丝体SOD活性影响
10号菌株菌丝培养5 d、7 d时,SOD活性变化不明显。菌丝44 ℃热激4 h 后,SOD 活性显著升高,菌丝体恢复时,SOD 活性降低。高温胁迫后菌丝体SOD 活性与培养7 d 时酶活性相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养10 d)、5 d(培养12 d)时,SOD活性下降至高温胁迫前水平。
2.3 高温胁迫对供试黑木耳菌株菌丝体CAT 活性影响
由图 3 可知,DH2 菌丝培养 5 d 和 7 d 时,CAT 活性变化不明显。菌丝44 ℃热激4 h 后,CAT 活性升高,菌丝体恢复时CAT 活性逐渐降低。高温胁迫后菌丝体CAT 活性与培养7 d 时酶活性相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养10 d)和5 d(培养12 d)时,CAT活性呈下降趋势。
10 号菌丝培养 5 d 和 7 d 时,CAT 活性变化不明显。菌丝44 ℃热激4 h 后,CAT 活性升高,菌丝体恢复时,CAT 活性逐渐降低。高温胁迫后菌丝体CAT活性与培养7 d 时酶活性相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养10 d)、5 d(培养12 d)时,CAT活性呈下降趋势。

图3 高温胁迫对供试黑木耳菌株菌丝体CAT活性影响
2.4 高温胁迫对供试黑木耳菌株菌丝体MDA含量影响
由图 4 可知,DH2 菌株菌丝培养 5 d、7 d 时,MDA 含量变化不明显。菌丝44 ℃热激4 h 后,MDA含量上升,菌丝体恢复时MDA含量显著升高后又降低。高温胁迫后菌丝体MDA含量与培养7 d时含量相比差异不显著(P>0.05)。但是菌丝体恢复3 d(培养10 d),MDA 含量显著上升,与培养7 d 含量相比差异显著(P<0.05)。
10 号菌株菌丝培养 5 d、7 d,MDA 含量变化不明显。菌丝44 ℃热激4 h 后,MDA 含量显著升高,菌丝体恢复时,MDA 含量降低。高温胁迫后菌丝体MDA 含量与培养7 d 时含量相比差异显著(P<0.05)。但是菌丝体恢复3 d(培养10 d)和5 d(培养12 d)时,MDA含量与高温胁迫前基本一致。
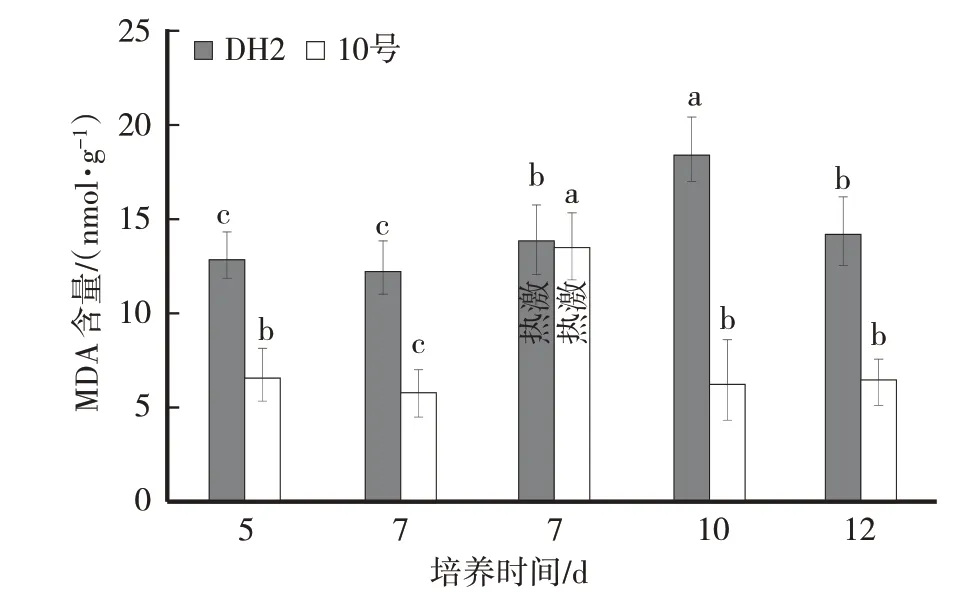
图4 高温胁迫对供试黑木耳菌株菌丝体MDA含量影响
3 小结与讨论
在食用菌生长发育过程中,高温能导致食用菌菌丝细胞组织结构损伤和生理代谢紊乱,从而造成食用菌菌丝生长停滞甚至死亡。高温胁迫下,细胞内活性氧增加,导致细胞结构损伤,多种保护酶发生应激变化,以缓解高温胁迫造成的伤害[15]。研究发现,黑木耳菌丝44 ℃热激处理4 h后,菌丝POD活性、SOD 活性、CAT 活性、MDA 含量上升。笔者研究与戚元成等[16]对40 ℃高温胁迫下糙皮侧耳(Pleurotus ostreatus)菌丝丙二醛含量、超氧化物歧化酶和过氧化物酶活性变化研究一致。因此,黑木耳菌丝中丙二醛含量、菌丝保护酶活性提高,能有效地清除各种活性氧基团,防止这些基团对细胞膜系统的损坏,这对于维持生物细胞自由基处于较低水平有重要作用。
研究发现,供试两个黑木耳菌株菌丝高温胁迫后,菌丝体保护酶响应时间有差异:DH2 菌株菌丝高温胁迫后,SOD 活性、CAT 活性迅速上升,但是POD 活性、MDA 含量对高温胁迫响应较慢,POD 活性、MDA含量在菌丝恢复培养时升高。10号菌株菌丝高温胁迫后,POD 活性、SOD 活性、CAT 活性和MDA 含量均迅速升高,表明10 号菌株对高温胁迫较敏感。
黑木耳菌丝高温耐受性与菌丝保护酶响应快慢是否有相关性需要进一步研究,另外后续可开展高温胁迫后热激蛋白表达相关研究。

